细胞色素P450 3A5基因多态性与原发性高血压的相关性
2013-03-04钟国强曾志羽涂荣会
肖 飞,邱 健,钟国强△,曾志羽,涂荣会,何 燕,李 烁
(1.广西医科大学第一附属医院心血管病研究所,南宁530021;2.广州军区广州总医院心血管内科 510010)
原发性高血压(essential hypertension,EH)作为一种病因未明的多基因多因素疾病,是个体的遗传易感性和环境致病因子共同作用的结果。国内外研究已发现数十种基因与EH相关。细胞色素 P450(cytochrome P450,CYP)超家族包括CYP1~4 4个家族和A、B、C、D、E亚家族及数十种同工酶,参与各种内、外源性物质的代谢,对某些疾病的发生发展也有重要影响。其中CYP3A酶类参与皮质醇和皮质酮的新陈代谢,使其转化为6β-羟基皮质醇和6β-羟基皮质酮,其活性与血压相关[1]。CP3A5是CYP3A家族中重要的亚家族,是人类肾组织中主要的CYP3A表达酶,肾脏内CYP3A介导的酶活性依赖于CYP3A5基因型[2],且其与肾脏近端小管钠的重吸收有关[3]。因此其本身所具有的遗传多态现象导致CYP3A酶类活性不同及CYP3A5表达差异,进而影响内源性皮质醇的新陈代谢作用,可能最终通过影响钠的重吸收而影响血压。本研究旨在检测EH患者和对照者的CYP3A5*3(6986A>G)位点多态性,分析其与中国汉族人EH之间的关系,及对血压的影响,寻找与EH有关的可能遗传标记。
1 资料与方法
1.1 一般资料 所有研究对象均从2011年10月至2012年6月本院老年心血管内科住院患者及健康体检人群中选取。(1)EH组:参照1999年WHO/ISH高血压指南的诊断标准,收缩压(SBP)≥140mm Hg和(或)舒张压(DBP)≥90mm Hg;或者既往有高血压病史,正在服用降压药物;其中男119例,女51例,年龄(63.05±10.54)岁。(2)对照组:符合SBP<140 mm Hg、DBP<90mm Hg,排除既往高血压史,其中男109例,女84例,年龄(58.18±12.62)岁。流行病学调查内容包括:吸烟史、血压以及临床一般生化指标的测定。所有研究对象均为自然人群,汉族且无血缘关系,均排除继发性高血压,排除肝、肾、肿瘤、糖尿病等其他严重的全身性疾病。
1.2 方法
1.2.1 人的基因组DNA提取 于清晨采集EH患者和对照者外周静脉血5mL,置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中保存于-70℃超低温冰箱中以备提取DNA。将储存抗凝血按人血液DNA提取试剂盒操作步骤提取白细胞基因组DNA,DNA提取试剂盒为Tiangen公司人血/细胞/组织DNA提取试剂盒,所提取的DNA于-20℃保存。
1.2.2 引物和Taqman MGB探针设计 根据GenBank收录的CYP3A5基因家族,查找CYP3A5*3等位基因序列,通过BLAST对比,针对CYP3A5*3等位基因保守序列设计引物和TaqMan MGB探针。引物F为:AAT GCT CTA CTG TCA TTT CTA ACC ATA ATC,引物R为:TCA CAC AGG AGC CAC CCA A,探针1(G)为:FTG TCT TTC AGT ATC TCT TP,探针2(A)为:6TGT CTT TCA ATA TCT CTT CP(F代表FAM,6代表HEX,P代表MGB基团)。以上均由上海基康生物技术有限公司合成。
1.2.3 实时荧光定量聚合酶链反应(RT-PCR)检测 对CYP3A5基因目的片段进行PCR扩增及SNP分型。RT-PCR反应体系(25μL)最终成分为:模板DNA 1μL、Master MiX酶12.5μL,引物各1μL,探针各0.5μL,灭菌双蒸水8.5μL。在Rotor-Gene 6000RT-PCR仪上反应:95℃预变性5min,然后95℃变性30s,60℃退火延伸1min,仪器同时收集荧光信号,共进行40个循环。软件分析得出SNP分型结果。
1.2.4 测序验证SNP分型结果 将DNA模板抽样共10例,经PCR法对CYP3A5基因目的片段进行扩增。引物序列参考文献[4]设计,上游引物为:5′-CAT GAC TTA GTA GAC AGA TGA C-3′,下游引物为:5′-GGT CCA AAC AGG GAA GAA ATA-3′,由上海英骏生物技术有限公司合成。10×PCR buffer、rTaqDNA聚合酶、dNTP等试剂由TaKaRa公司生产。扩增产物为293bp片段,建立50μL反应体系:10×PCR buffer 5μL,Takara Tap 0.25μL,2.5mmol/L dNTP 4 μL,10.0μmol/L的上下游引物各4μL,模板DNA 4μL,灭菌双蒸水补至50μL;扩增循环参数:94℃预变性7min,然后94℃变性1min,55℃复性1min,72℃延伸1min,共35个循环,最后72℃延伸7min。PCR产物送至上海英骏生物技术有限公司直接测序。
1.3 统计学处理 采用SPSS13.0统计软件进行统计分析。计量资料以±s表示,t检验,χ2检验用于计数资料的关联分析和Hardy-Weinberg平衡检验,应用logistic回归分析法进行多因素回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床特征比较 两组间尿素氮、血糖、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平比较,差异无统计学意义(P>0.05)。EH组年龄、SBP、DBP、三酰甘油(TG)水平明显高于对照组,差异有统计学意义(P<0.05),而高密度脂蛋白胆固醇(HDL-C)水平低于对照组,差异有统计学意义(P<0.01),见表1。
表1 高血压组与对照组临床资料比较(±s)
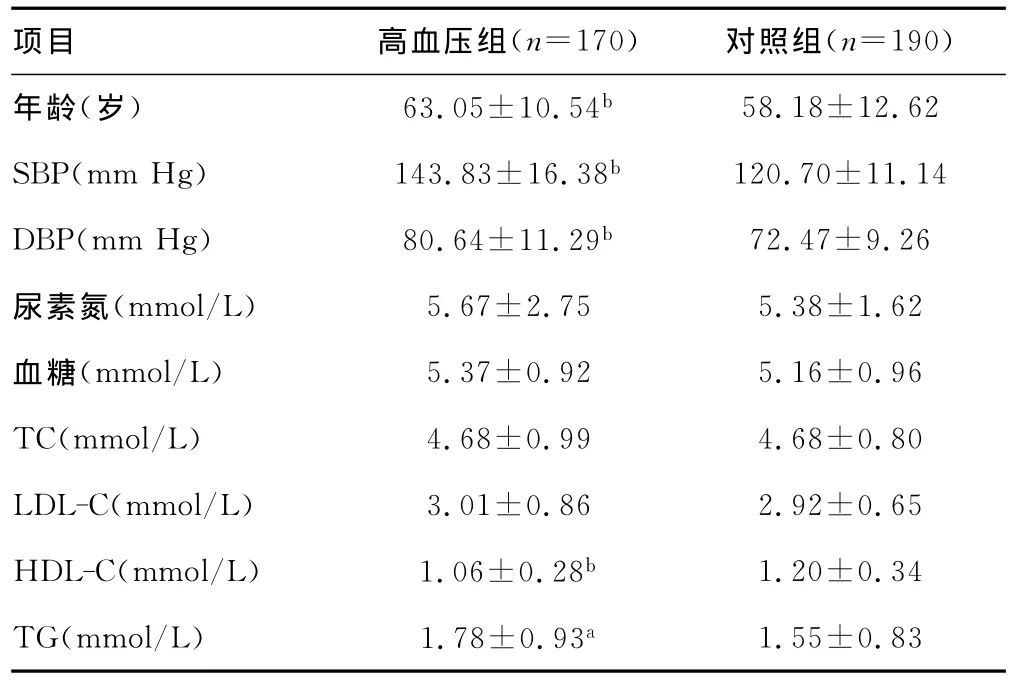
表1 高血压组与对照组临床资料比较(±s)
a:P<0.05,b:P<0.01,与对照组比较。
项目 高血压组(n=170) 对照组(n=190)58.18±12.62 SBP(mm Hg) 143.83±16.38b 120.70±11.14 DBP(mm Hg) 80.64±11.29b 72.47±9.26尿素氮(mmol/L) 5.67±2.75 5.38±1.62血糖(mmol/L) 5.37±0.92 5.16±0.96 TC(mmol/L) 4.68±0.99 4.68±0.80 LDL-C(mmol/L) 3.01±0.86 2.92±0.65 HDL-C(mmol/L) 1.06±0.28b 1.20±0.34 TG(mmol/L) 1.78±0.93a年龄(岁) 63.05±10.54b 1.55±0.83
2.2 CYP3A5基因扩增目的片段的Taqman MGB PCR体系分型结果 本实验Taqman MGB探针1的5′端标记FAM,通过绿色通道检测G碱基,探针2的5′端标记HEX通过黄色通道检测A碱基,3′端标记不发光的粹灭基团并连接 MGB基团。当黄色通道未检测到荧光信号,绿色通道检测到荧光信号,表现为GG纯合型;当绿色及黄色通道均检测到荧光信号,表现为GA杂合型;当绿色通道未检测到荧光信号,黄色通道检测到荧光信号时,表现为AA野生型;运用Taqman MGB探针法,所有研究对象的CYP3A5基因扩增目的片段均得到满意SNP分型结果,获得3种基因型:GG纯合突变型(CYP3A5*3/*3)、GA 杂合突变型(CYP3A5*1/*3)、AA 野生型(CYP3A5*1/*1)。
2.3 CYP3A5基因扩增目的片段的测序结果 抽样测序的10例DNA模板PCR产物均得到满意扩增。10例样本测序结果与Taqman MGB分型结果一致。检测到2种基因型:GG纯合突变型(CYP3A5*3/*3)、GA 杂合突变型(CYP3A5*1/*3),未检测到 AA野生型(CYP3A5*1/*1)。
2.4 CYP3A5*3(6986A>G)多态性位点基因型分布频率及等位基因频率分布 两组CYP3A5*3(6986A>G)基因型和等位基因分布均符合Hardy-Weinberg平衡(P>0.05)。EH组 GG、GA、AA基因型频率分别为51.2%、42.4%、6.5%,而对照组则为39.9%、50.8%、9.3%;EH 组 GA+AA基因型频率低于对照组,差异有统计学意义(χ2=4.643,P=0.031),通过相对危险度分析发现,GG基因型者EH的患病风险是GA+AA基因型者的1.579倍,见表2。等位基因频率分布在两组间相比也有统计学差异,EH组A等位基因频率分布低于对照组(χ2=4.192,P=0.041),见表3。
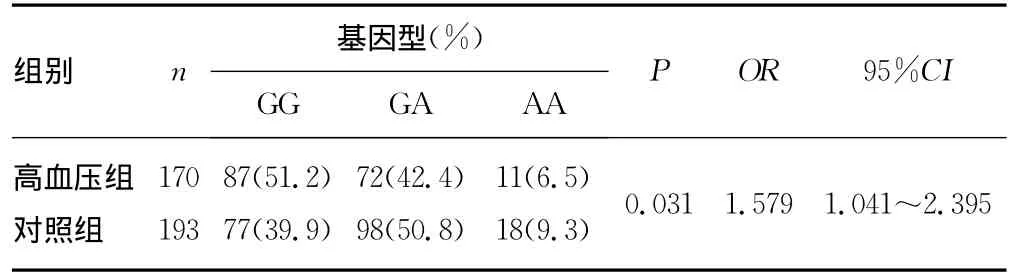
表2 CYP3A5*3基因型分布频率

表3 CYP3A5*3等位基因分布频率
2.5 EH危险因素的非条件Logistic回归分析 以有无高血压为因变量,将性别、年龄、吸烟、TC、LDL-C、HDL-C、TG、基因型引入Logistic回归模型。结果显示,基因型(GG)是EH的一项独立危险因素,见表4。
2.6 CYP3A5*3各基因型间血压水平的比较 以基因型分组,比较分析发现EH组GG基因型者SBP(143.60±17.12)mm Hg和DBP(79.54±11.12)mm Hg与GA+AA基因型者SBP(144.06±15.75)mm Hg和 DBP(81.72±11.43)mm Hg相比,差异无统计学意义(P>0.05);对照组GG基因型者SBP(122.82±11.82)mm Hg和DBP(73.12±9.70)mm Hg与GA+AA 基 因 型 者 SBP(119.37±10.54)mm Hg 和 DBP(72.07±9.00)mm Hg比较,差 异 也 无 统 计 学 意 义 (P>0.05),但可以发现GA+AA基因型者存在稍低的SBP水平。
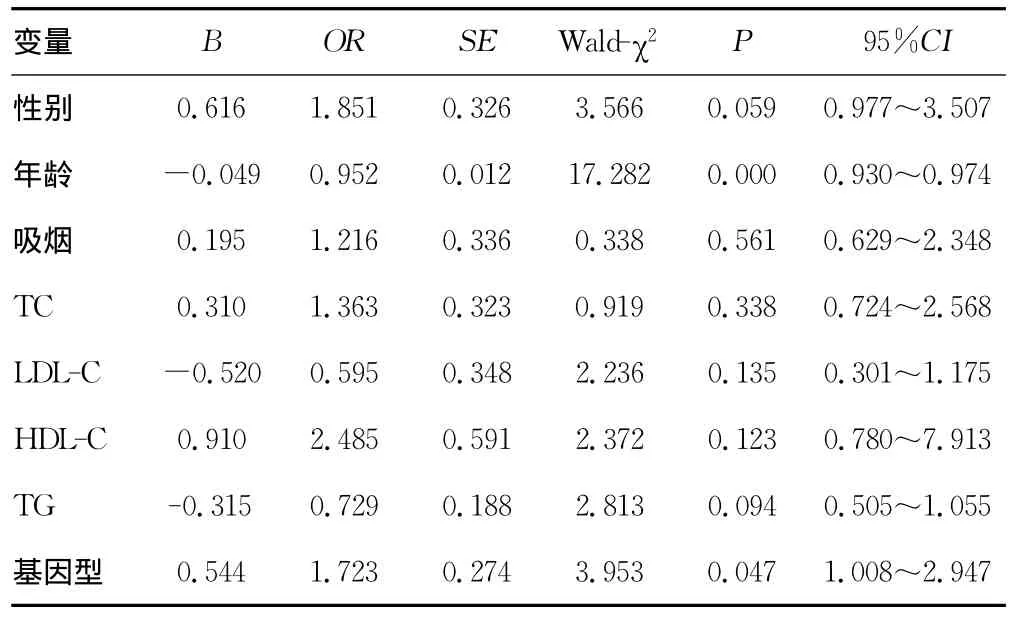
表4 高血压危险因素的Logistic回归分析
3 讨 论
CYP3A5是CYP3A亚家族中主要的酶系,它的表达及活性有着很大的个体和种族差异,这种差异与其单核苷酸多态性有关,是造成CYP3A代谢的外源性及内源性物质差异的最重要因素。目前在已经发现的30多种CYP3A5突变型中,位于第3号内含子的6986A>G突变最具功能意义,它导致mRNA的剪接发生改变以及蛋白质截短,使得应至少携带一个CYP3A5*1(A)等位基因,才能在体内转录完整的CYP3A5mRNA及表达,而携带基因为CYP3A5*3/*3(GG)的不表达CYP3A5[5]。CYP3A5*3的基因频率存在明显的种族差异,在白种人中的分布频率为70%~85%,在黑人中为27%~50%,在亚洲人中为65%~85%[6],在中国汉族人中为72.7%[7]。
研究提示CYP3A5基因多态性与EH的发病具有相关性,但研究结论不一。最初在高血压大鼠模型实验中发现,CYP3A活性的增加能增强6β-羟基类固醇的生成,导致高血压[8]。在人类所进行的相关研究中,Givens等[2]首先发现了CYP3A5*1等位基因型个体与CYP3A5*3等位基因型个体比较拥有较高的SBP、平均动脉压和内生肌酐清除率。随后Herbert等[9]在黑种人的研究中,发现CYP3A5*1等位基因可能与EH的发病具有相关性。在关于白种老年人的研究中,发现CYP3A5*1/*3表达子显著高的出现在高血压组[10]。而Lieb等[11]及 Langaee等[12]的研究发现,CYP3A5*1等位基因对血压无明显影响,与高血压发病不具有相关性。Reinhold等[13]的研究结果提示携带CYP3A5*1等位基因者存在较低的SBP及脉压水平。Fromm等[14]在青年白种人的研究中发现,CYP3A5*3/*3基因型者比*1/*3者拥有显著升高的24h动态收缩压值。最近Zhang等[15]在对238例日本男性的研究中发现,CYP3A5*3/*3基因型者的SBP和DBP与其盐的摄入水平显著相关。Xi等[16]经 Meta分析得出,在白种人中CYP3A5*1等位基因携带者拥有低的SBP。本实验通过对170例EH患者和193例对照者CYP3A5*3基因多态性分析,发现高血压组GA+AA基因型分布频率低于对照组,GG基因型者EH的患病风险是GA+AA基因型者的1.579倍,同时高血压组A等位基因频率分布也低于对照组。提示A(CYP3A5*1)等位基因可能降低EH的患病风险,与Reinhold等[13]的研究结论基本相符。与在高血压大鼠模型试验[8]中得出的结论不一,考虑可能人类肾脏CYP3A5同工酶的表达模式与大鼠不同[17],同时,要比较人类与大鼠肾脏内所有的CYP3A酶类的活性与功能比较困难。也与Givens等[2]的研究结论不符,可能与人种、性别、年龄等混杂因素,以及高血压在不同种族或民族中发病机制的不同,基因型及等位基因频率的分布状况,以及基因多态性对该基因转录表达水平的影响在不同种族间的差异、血压水平的被动性、环境和遗传因素的相互作用等多种影响因素有关。另外对照组GA+AA基因型者存在稍低的SBP水平,与 Reinhold等[13]、Xi等[16]研究结论类似。此外本研究中对照组CYP3A5*3等位基因频率为65.3%,低于Li等[7]报道的中国人CYP3A5*3等位基因频率72.2%,可能是本研究中对照组研究对象均为年龄较大的非EH患者,也可以从侧面说明CYP3A5*1(A)等位基因可能对原发性高血压具有保护作用。
原发性高血压的发生受遗传、环境等多因素的相互影响,而基因多态性存在种族、民族及地域间的差异,CYP3A5*3基因多态性与原发性高血压之间是否真正存在相关性,是通过影响SBP还是DBP的水平而影响原发性高血压的发病,是否与盐的摄入水平相关等等,目前尚无定论。本研究结果仅仅是一个提示,但也不能完全排除由于样本数量和选择偏倚而产生的差异,因此今后的研究需要进一步进行大样本研究,以及研究EH纵多影响因素之间的相互作用。
[1]Ghosh SS,Basu AK,Ghosh S,et al.Renal and hepatic family 3Acytochromes P450(CYP3A)in spontaneously hypertensive rats[J].Biochem Pharmacol,1995,50(1):49-54.
[2]Givens RC,Lin YS,Dowling AL,et al.CYP3A5genotype predicts renal CYP3Aactivity and blood pressure in healthy adults[J].J Appl Physiol,2003,95(1):1297-1300.
[3]Bochud M,Eap CB,Elston RC,et al.Association of CYP3A5genotypes with blood pressure and renal function in African families[J].J Hypertens,2006,24(5):923-929.
[4]Hu TF,He J,Chen GL,et al.CYP3A5*3and CYP3A4*18single nucleotide polymorphisms in a Chinese population[J].Clinica Chimica Acta,2005,353(2):187-192.
[5]Kuehl P,Zhang J,Lin Y,et al.Sequence diversity in CYP3Apromoters and characterization of the genetic basis of polymorphic CYP3A5expression[J].Nat Genet,2001,27(3):383-391.
[6]Shih PS,Huang JD.Pharmacokinetics of midazolam and 1′-hydroxymidazolam in Chinese with different CYP3A5 genotypes[J].Drug Metabolism and Disposition,2002,30(12):1491-1496.
[7]Li D,Zhang GL,Lou YQ,et al.Genetic polymorphisms in MDR1and CYP3A5and MDR1haplotype in mainland Chinese Han,Uygur and Kazakh ethnic groups[J].J Clin Pharm Ther,2007,32(1):89-95.
[8]Watlington CO,Kramer LB,Schuetz EG,et al.Corticosterone 6beta-hydroxylation correlates with blood pressure in spontaneously hypertensive rats[J].Am J Physiol,1992,262(8):927-931.
[9]Herbert HO,Amar P,Stephen D,et al.Association Between the CYP3A5Genotype and Blood Pressure[J].Hypertension,2005,45(3):294-298.
[10]Kivist KT,Niemi M,Schaeffeler E,et al.CYP3A5genotype is associated with diagnosis of hypertension in elderly patients:data from the DEBATE study[J].Am J Pharmacogenomics,2005,5(3):191-195.
[11]Lieb W,Bolbrinker J,Daring A,et al.No association of the CYP3A5*1allele with blood pressure and left ventricular mass and geometry:the KORA/MONICA Augsburg echocardiographic substudy[J].Clin Sci(Lond),2006,111(4):365-372.
[12]Langaee TY,Gong Y,Yarandi HN,et al.Association of CYP3A5polymorphisms with hypertension and antihypertensive response to verapamil[J].Clin Pharmacol T-her,2007,81(4):386-391.
[13]Reinhold K,Mike Z,Silke K,et al.The role of the cyto-chrome P450 3A5enzyme for blood pressure regulation in the general Caucasian population[J].Pharmacogenet and Genomics,2005,15(7):831-837.
[14]Fromm MF,Schmidt BM,Pahl A,et al.CYP3A5genotype is associated with elevated blood pressure[J].Pharmacogenet Genomics,2005,15(10):737-741.
[15]Zhang L,Miyaki K,Wang W,et al.CYP3A5polymorphism and sensitivity of blood pressure to dietary salt in Japanese men[J].J Hum Hypertens,2010,24(5):345-350.
[16]Xi B,Wang C,Liu L,et al.Association of the CYP3A5 polymorphism(6986G>A)with blood Pressure and hypertension[J].Hypertens Res,2011,34(11):1216-1220.
[17]McArthur AG,Hegelund T,Cox RL,et al.Phylogenetic analysis of the cytochrome P450 3(CYP3)gene family[J].J Mol Evol,2003,57(2):200-211.
