梓醇增强缺血灶周围大脑皮质神经元轴突芽生及突触新生
2013-02-27祝慧凤
万 东,祝慧凤,罗 勇,谢 鹏
(重庆医科大学附属第一医院1.急诊医学科&重症医学科、3.神经内科,重庆 400016;2.西南大学药学院暨中医药学院,重庆 400716)
缺血性脑卒中后梗死灶周围大脑皮质(peri-infarct cortex,PIC)轴突芽生(axonal sprouting)是具有代表性的神经修复事件。芽生轴突可形成新的功能性突触连接,即突触新生(synaptogenesis),参与卒中后神经环路重构,奠定功能恢复的结构基础。因此,以PIC区轴突芽生和突触新生为研究切入点,可望筛选出有效促进脑卒中后神经修复的药物或治疗手段。
梓醇是地黄的主要活性成分,具有确切的脑保护作用和促神经修复效应。课题组及国内外其他学者研究发现[1-4],梓醇可促进神经元轴突生长,改善脑卒中大鼠神经缺失功能恢复状况。但梓醇能否促进芽生轴突形成新的突触终末尚不明确。因此,本研究制备大鼠大脑中动脉永久性闭塞模型,采用生长相关蛋白43(growth associated protein-43,GAP-43)标记芽生轴突,突触素(synaptophysin,P38)标记突触前终末,激光共聚焦检测PIC区GAP-43和P38共定位信号,观察梓醇对PIC区芽生轴突形成突触的影响;进一步采用透射电镜结合体视学方法检测PIC区突触数密度(number density,Nv)和面密度(sarface density,Sv),观察梓醇对突触重构的影响。通过上述研究,以期为明确回答梓醇能否促进有效轴突芽生,能否增强突触新生及突触重构能力等问题提供直接的形态学依据。
1 材料与方法
1.1 动物与分组36只成年健康Sprague-Dawley大鼠,♀♂不拘,体质量220~250 g,购自重庆医科大学实验动物中心(合格证号:检动字2002A040)。随机分为假手术组(n=6),模型组(n=6),生理盐水组(n=6),梓醇低剂量组(n=3)、中剂量组(n=6)、高剂量组(n=3)和胞磷胆碱组(阳性药物对照组,n=6)。
1.2 药品与器材梓醇购自中国药品生物制品检定所(产品批号:110808-200508,规格:20 mg/支),胞磷胆碱钠注射液为山西晋新双鹤药业有限责任公司产品(国药准字 H14021994,规格:125 g·L-1)。小鼠抗突触素(P38)单克隆抗体、兔抗GAP-43多克隆抗体、Cy3标记羊抗兔IgG、FITC标记羊抗小鼠IgG均购于武汉博士德生物工程有限公司。Leicacm1850型冰冻切片机、TCS SP2型激光共聚焦扫描显微镜和Leica-EM UC7超薄切片机均为德国徕卡公司产品,H7500型透射电子显微镜为日本日立公司产品。
1.3 模型制备右颞侧低位开颅,电凝大脑中动脉位于嗅束与大脑下静脉之间的一段,制备局灶永久性脑缺血模型。假手术组除不凝闭右侧大脑中动脉外,其余步骤与模型组相同。术中保持直肠温度在36.5℃ ~37.5℃。
1.4 模型成功的判断与纳入标准术后24 h,采用Bederson评分评估受累肢体神经缺失功能状况:0分,无神经功能缺失症状;1分,左前肢屈曲,但不伴其他异常,即提尾悬空实验阳性;2分,提尾悬空实验阳性,同时侧推抵抗力下降(即侧向推力实验阳性),但自由活动时无转圈行为;3分,同2分行为,且自由活动时向瘫痪侧转圈。评分为1~3分的大鼠纳入实验。
1.5 药物干预梓醇低、中、高剂量分别为1、5、10 mg·kg-1,胞磷胆碱给药剂量为 0.5 g·kg-1。梓醇和胞磷胆碱均用生理盐水配制,每次给药总体积为3 ml。生理盐水组腹腔注射等体积生理盐水。假手术组和模型组不给予任何药物干预。药物干预组均于术后24 h首次经腹腔注射给药,每日1次,连续7 d。
1.6 PIC区GAP-43和P38共定位信号检测与分析
1.6.1 标本采集与切片制备 术后d 15,每组取3只大鼠,深麻醉后用质量分数为4%的多聚甲醛灌流固定,参照大鼠脑立体定向图谱,采集视交叉前后2 mm范围的脑组织块(含感觉运动皮质区),速冻后制备30 μm厚的连续冠状位脑片,每隔5张取1张,每只大鼠共取10张脑片用于免疫荧光双标组织化学染色。
1.6.2 免疫荧光双标组织化学染色步骤 采用自由漂浮法免疫荧光组织化学染色,用FITC显示P38阳性表达,Cy3显示 GAP-43阳性表达。脑片用0.02 mol·L-1PBS漂洗3次,正常山羊血清工作液室温封闭30 min;转入GAP-43和P38混合一抗工作液(GAP-43和P38一抗工作浓度分别为1∶400和1∶200),4℃孵育过夜(14~16 h),阴性对照用0.02 mol·L-1PBS 代替一抗工作液;0.02 mol·L-1PBS漂洗脑片3次,转入Cy3标记羊抗兔IgG(稀释比例为1∶200)和FITC标记羊抗小鼠IgG(稀释比例为1∶100)混合工作液中,37℃避光孵育1 h;0.02 mol·L-1PBS漂洗脑片4次,裱片,缓冲甘油封片,激光共聚焦显微镜下观察并采集图像。
1.6.3 PIC区GAP-43和P38共定位信号分析 脑片置于TCS SP2型激光共聚焦扫描显微镜下观察,每只动物观察3张完整的脑片,相同光学条件下每张脑片随机拍摄PIC区(距病灶边缘1~3 mm脑区)3个互不重叠的视野,分别测量红色荧光强度系数(表征GAP-43表达强弱)和绿色荧光强度系数(表征P38表达强弱),并用系统自带软件进行图像叠加处理,获得GAP-43和P38共定位信号图像(共定位信号呈黄色),采用NIH ImageJ图像分析软件,分析每组图像的Pearson相关系数,以间接反映共定位像素值的大小。取各指标27个视野的平均值进行统计分析。
1.7 电镜标本制备及PIC区突触定量分析
1.7.1 电镜标本制备 术后d 15,将假手术组、模型组、生理盐水组、梓醇中剂量治疗组和胞磷胆碱治疗对照组余下的3只大鼠深麻醉后灌流固定,首先灌流生理盐水100 ml,然后用含4%多聚甲醛、2%戊二醛的0.1 mol·L-1磷酸盐缓冲液(PBS)灌流固定30 min。快速断头取脑,取视交叉前后2 mm的脑组织块(含大脑运动皮质区),冰台上分离缺血灶周边1~3 mm范围的幸存感觉运动皮质,制备1 mm×1 mm×1 mm大脑皮质块,放入4%戊二醛(用0.1 mol·L-1PBS配制)溶液中固定3~4 h;再用0.1 mol·L-1PBS溶液清洗组织块3次,每次15 min,继之 1%锇酸后固定 1 h(4℃),0.1 mol·L-1PBS溶液清洗组织块3次,每次15 min。常规脱水透明,618型环氧树脂包埋,半薄切片定位后,采用Leica-EM UC7型超薄切片机制备厚度60 nm的超薄切片,切片裱于300目铜网上,后经醋酸铀-柠檬酸铅双重电子染色,H7500型透射电子显微镜下观察。
1.7.2 图像采集与体视学定量分析 电脑采集图像,自左上往右下顺序采集图片12张,放大倍数均4万,每组测定36张电镜照片。参照文献[5],采用突触体视学铜网格法计算突触Nv和Sv。电镜下突触的辨认标准:①可见突触前后膜;② 可见突触间隙;③可见突触后致密带。
1.8 统计学处理每组数据以±s表示,采用SPSS 11.5版本进行单因素方差分析(ANOVA),组间两两比较用SNK法。
2 结果
2.1 梓醇促进PIC区有效轴突芽生荧光显微镜下见,绿色荧光显示P38标记的突触前末端,红色荧光显示GAP-43表达阳性的芽生轴突,GAP-43和P38共定位信号呈现黄色,显示新生轴突形成突触的部位。PIC区幸存大脑皮质神经毡内,可见点状和颗粒状密集分布的突触素P38阳性着色部位(呈现绿色荧光),部分阳性颗粒围绕在神经元周围,衬托出神经元胞体的轮廓;GAP-43在神经元及神经突起上表达较强,阳性着色部位呈点状、索条状,部分位于神经元胞质内;黄色的GAP-43/P38共定位颗粒散在分布于神经毡内,部分颗粒在神经元周围密集分布,显示出神经元胞体和突起的外形特征。阴性对照脑片未见阳性荧光信号。见Fig 1。
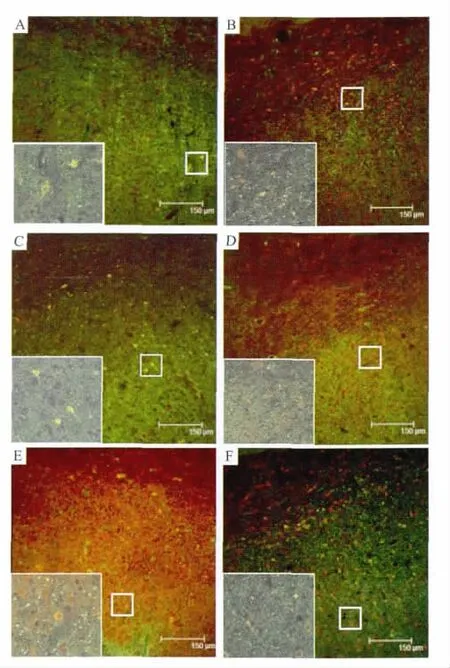
Fig 1 Representative images showing co-localisation(yellow)of P38(green)with GAP-43(red)in PIC region in each group
GAP-43和P38共定位分析,红色荧光强度系数间接反映GAP-43阳性表达信号强弱,系数越大GAP-43阳性表达水平越高。红色荧光强度系数模型组和生理盐水组均高于假手术组,但差异无显著性(P>0.05),梓醇各剂量组均明显高于模型组(P<0.05),且梓醇中剂量组明显高于胞磷胆碱组(P<0.05);提示梓醇可促进脑缺血后轴突芽生。绿色荧光强度系数间接反映P38表达量,系数越大,P38表达水平越高。各组间比较,梓醇各剂量组绿色荧光强度系数均比模型组和胞磷胆碱组明显增加(P<0.05),提示梓醇可增强脑缺血后突触重构。GAP-43和P38之间Pearson相关系数反映芽生轴突形成突触连接的频度。Pearson相关系数越大表明芽生轴突形成突触连接越多。模型组和生理盐水组Pearson相关系数明显大于假手术组(P<0.05),提示脑缺血后存在自发性轴突芽生及突触新生;梓醇各剂量组均比模型组明显增大(P<0.05),且梓醇中、高剂量组明显大于胞磷胆碱组,差异具有显著性(P<0.05),提示梓醇可促进芽生轴突形成新的突触连接。见Tab 1。
Tab 1 Comparison of parameters of co-localisation of P38/GAP-43 within PIC region in each group(±s,n=3)

Tab 1 Comparison of parameters of co-localisation of P38/GAP-43 within PIC region in each group(±s,n=3)
*P <0.05 vs sham operation group,▲P <0.05 vs model group,★P <0.05 vs citicoline treatment group.
Group co-localisation of P38/GAP-43/Pearson's correlation coefficient Sham operation 1.04±0.11 0.60 ±0.02 0.14±0.02 P38 expression/green fluorescence intensity GAP-43 expression/red fluorescence intensity Model 1.19±0.10* 0.66 ±0.09 0.27±0.04*Saline 1.14±0.18* 0.68 ±0.03 0.32±0.03*Citicoline 1.01±0.09 0.85 ±0.07*▲ 0.48±0.01*▲Low dose of catalpol 1.31±0.03*▲★ 0.83±0.03*▲ 0.50±0.04*▲Middle dose of catalpol 1.38±0.10*▲★ 0.92±0.06*▲★ 0.63±0.03*▲★High dose of catalpol 1.53±0.19*▲★ 0.80±0.10*▲ 0.72±0.06*▲★
2.2 梓醇增加PIC区突触数密度和面密度体视学定量分析结果显示,与假手术组相比,模型组和生理盐水组PIC区神经毡内突触Nv和Sv均明显降低(P<0.05),提示脑缺血损伤后存在突触丢失现象;中剂量梓醇组Nv和Sv均比模型组和生理盐水组明显增加(P<0.05),但与胞磷胆碱组差异无显著性(P>0.05),接近假手术组水平(P>0.05),提示梓醇可明显促进脑缺血后突触重构。见Fig 2和Tab 2。
3 讨论
缺血性脑卒中所致神经缺失功能的恢复依赖于缺血周围区幸存脑组织及病灶对侧功能相似脑区激活、结构重塑和功能重建。卒中后最初几周内,脑区激活较为泛化,涉及病灶同侧及对侧的多个脑区;随着神经缺失功能恢复及病程延长,泛化的脑区活化模式逐步被PIC区活化这一局限的类似生理状态的活化模式所取代[6]。因此,PIC区的神经可塑性事件一直是卒中后神经修复研究的焦点。
神经元轴突芽生及突触新生是PIC区代表性神经可塑性事件,其发生发展具备一定的时空特点。时间上,轴突芽生存在4个关键时段[7]:卒中后最初3 d内为轴突芽生触发阶段;3~7 d为起始阶段,伴随大量生长促进因子表达上调;7~14 d进入维持阶段,大部分轴突生长,促进蛋白呈峰值表达并维持在平台水平,如GAP-43、CAP23及c-jun等;14~28 d进入轴突芽生终末阶段,此时新的轴突投射模式基本构建完毕。空间上,大鼠感觉运动皮质小灶梗死后,梗死灶周边2 mm范围的幸存脑组织轴突芽生最明显[7-8]。可见,卒中后2周是对轴突芽生和突触新生进行过程性评价的关键时点,梗死灶周边1~3 mm的环形脑区是研究卒中后轴突芽生/再生和突触新生的重要区域。

Fig 2 Representative electron micrographs used to evaluate synapse(arrow)density within peri-infarct cortex
Tab 2 Comparison of synaptic number density and surface density within PIC region in each group(±s,n=3)
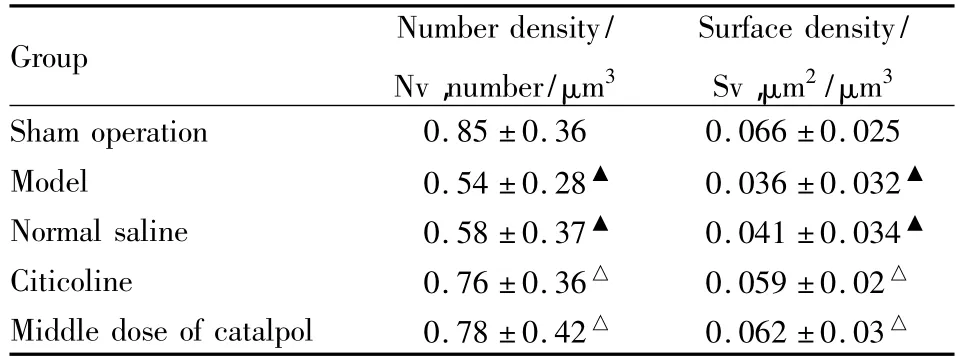
Tab 2 Comparison of synaptic number density and surface density within PIC region in each group(±s,n=3)
▲P <0.05 vs sham operation group;△P <0.05 vs model group.
Group Number density/Nv,number/μm3 Surface density/Sv,μm2/μm3 Sham operation 0.85 ±0.36 0.066 ±0.025 Model 0.54 ±0.28▲ 0.036 ±0.032▲Normal saline 0.58 ±0.37▲ 0.041 ±0.034▲Citicoline 0.76 ±0.36△ 0.059 ±0.02△Middle dose of catalpol 0.78 ±0.42△ 0.062 ±0.03△
神经元轴突芽生/再生和突触新生需要合成新的蛋白以调节生长锥的形成、维持和延伸,并使轴突芽生与突触新生同步化。其中,GAP-43是一种分子量为43 ku的神经特异性蛋白,富集于轴突生长锥质膜,参与轴突生长锥形成,引导轴突生长和延伸,调节轴突芽生与新突触形成同步化,是国际公认的轴突再生分子标志。突触素P38是突触前囊泡特有的钙结合糖蛋白,与神经递质释放、突触囊泡再循环和突触新生等都有密切关系,是突触前终末的特异性分子标记物,也是突触传递效能的反映。在脑损伤后轴突生长维持阶段,P38与GAP-43的比值可反映突触新生能力,但芽生轴突建立突触连接后,GAP-43的表达下调,趋于基线水平[9]。脑缺血损伤后,由于能量代谢障碍,蛋白表达谱调节异常以及中枢神经系统轴突生长限制性微环境等诸多因素影响,相当一部分芽生轴突不能形成功能性突触连接,即无效轴突芽生。成熟期线虫的运动神经元轴突切断后,大约70%的受损轴突末端形成了生长锥,但仅有不到10%的芽生/再生轴突与靶组织建立了连接[10]。因此,促进芽生轴突形成新的突触连接(即有效轴突芽生)成为重要的神经修复策略。
课题组前期研究观察到[3-4],梓醇可上调局灶脑缺血大鼠梗死灶周围区大脑皮质GAP-43表达,增加脑梗死灶周围区大脑皮质神经毡内突触数目,但梓醇能否诱导新生轴突形成突触尚未进行探讨。因此,本研究采用免疫荧光双标组织化学染色技术,用GAP-43标记芽生轴突,P38标记突触,GAP-43和P38共定位显示芽生轴突形成的新的突触终末,观察梓醇对新生轴突形成突触的影响。结果发现脑缺血后15 d,PIC区神经毡内可见大量GAP-43和P38共定位信号,呈黄色,密集分布在神经元周围,显示出神经元胞体和突起的外形特征。量化分析各组GAP-43和P38共定位信号,结果梓醇治疗组Pearson相关系数明显高于其他实验组(P<0.05),表明梓醇组有更多的芽生轴突形成了突触前末端,提示梓醇可促进芽生轴突形成新的突触连接。
既往研究证实,胞磷胆碱是磷脂生物合成过程中的一种关键物质,参与卒中后神经生成、轴突芽生/再生以及突触生成过程。外源性给予胞磷胆碱可加快磷脂合成和神经修复,目前广泛用于卒中后神经修复治疗[11]。近期研究发现,胞磷胆碱可促进卒中后神经再生[12],诱导树突芽生[13],上调突触素表达[14],与梓醇具有相似的神经药理作用机制,故课题组将其作为阳性药物对照。本研究结果显示,梓醇较胞磷胆碱更能诱导新生轴突形成新的突触,提示梓醇作为神经修复治疗药物极具临床转化潜能。
脑缺血后受累神经元突触数量减少,效能降低,神经环路信息传递障碍是脑缺血后出现神经功能障碍的重要因素。新突触形成、突触数密度增加、突触面密度增大以及突触传递效能增强是突触重构的主要体现。突触数密度是指一定参照空间内突触的数目,直接反映神经活动过程中神经元接点数目的多少;突触面密度是指一定参照空间内突触的总面积,直接反映神经活动中神经元接点面积的大小。本研究在证实梓醇可促进芽生轴突形成新的突触终末的基础上,进一步采用透射电镜结合体视学方法定量检测PIC区突触数密度和面密度,评价梓醇对突触重构的终末效应。结果发现中剂量梓醇治疗组PIC区突触的数密度和面密度均比模型组和生理盐水组明显增加,接近假手术组水平,提示梓醇可诱导突触重构,增加突触连接点数目及突触连接面。这有助于神经环路修复过程中功能性神经连接的重建。
综上,本研究结果表明,梓醇可促进缺血性脑卒中大鼠PIC区芽生轴突形成新的突触连接,增强突触新生能力,诱导突触重构,为合理阐释梓醇促卒中后神经修复作用及机制提供了较为直观的形态学依据,并为卒中后促神经修复药物研发提供了理想的候选。
[1] 万 东,祝慧凤,罗 勇,等.梓醇促大鼠大脑皮质神经元轴突生长的离体研究[J].中国中药杂志,2007,32(17):1771 -4.
[1] Wan D,Zhu H F,Luo Y,et al.Study of catalpol promoting axonal growth for cultured cortical neurons from rats[J].China J Chin Mater Med,2007,32(17):1771 -4.
[2] Yamazaki M,Chiba K,Mohri T.Neuritogenic effect of natural iridoid compounds on PC12h cells and its possible relation to signaling protein kinases[J].Biol Pharm Bull,1996,19(6):791 - 5.
[3] 祝慧凤,万 东,罗 勇,等.梓醇上调GAP-43表达伴随局灶脑缺血大鼠神经功能恢复[J].中国药理学通报,2007,23(9):1231-6.
[3] Zhu H F,Wan D,Luo Y,et al.Catalpol up-regulated GAP-43 protein expression and improved behavior outcome of focal cerebral ischemia rats[J].Chin Pharmacol Bull,2007,23(9):1231 -6.
[4] Wan D,Zhu H F,Luo Y,et al.Changes in synapse quantity and growth associated protein 43 expression in the motor cortex of focal cerebral ischemic rats following catalpol treatment[J].Neural Regenerat Res,2011,6(18):1380 -5.
[5] 杜亦旭,许能贵,易 玮,等.电针对不同时间段局灶性脑缺血大鼠缺血区突触数密度、面密度的影响[J].广州中医药大学学报,2008,25(3):224 -8.
[5] Du Y X,Xu N G,Yi W,et al.Effect of electroacupuncture on the synaptic number density and surface density in the cerebral ischemic areas of rats with focal cerebral ischemia at different time[J].J Guangzhou Univ Tradit Chin Med,2008,25(3):224 -8.
[6] Benowitz L I,Carmichael S T.Promoting axonal rewiring to improve outcome after stroke[J].Neurobiol Dis,2010,37(2):259-66.
[7] Carmichael S T,Archibeque I,Luke L,et al.Growth-associated gene expression after stroke:evidence for a growth-promoting region in peri-infarct cortex[J].Exp Neurol,2005,193(2):291 -311.
[8] Carmichael S T,Wei L,Rovainen C M,et al.New patterns of intracortical projections after focal cortical stroke[J].Neurobiol Dis,2001,8(5):910 -22.
[9] Thompson S N,Gibson T R,Thompson B M,et al.Relationship of calpain-mediated proteolysis to the expression of axonal and synaptic plasticity markers following traumatic brain injury in mice[J].Exp Neurol,2006,201(1):253 -65.
[10] Chen L,Chisholm A D.Axon regeneration mechanisms:insights from C.elegans[J].Trends Cell Biol,2011,21(10):577 - 84.
[11] Hurtado O,Lizasoain I, Moro M A.Neuroprotection and recovery:recent data at the bench on citicoline[J].Stroke,2011,42(1 Suppl):S33-5.
[12] Diederich K,Frauenknecht K,Minnerup J,et al.Citicoline enhances neuroregenerative processes after experimental stroke in rats[J].Stroke,2012,43(7):1931 -40.
[13] Hurtado O,Cardenas A,Pradillo J M,et al.A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke[J].Neurobiol Dis,2007,26(1):105-11.
[14] Gutierrez-Fernandez M,Rodriguez-Frutos B,Fuentes B,et al.CDP-choline treatment induces brain plasticity markers expression in experimental animal stroke[J].Neurochem Int,2012,60(3):310-7.
