衣霉素联合奥沙利铂对人口腔癌KB细胞增殖及凋亡的影响
2013-02-27徐锦程浦龙健黄莹莹张媛媛
徐锦程,夏 飞,张 配,浦龙健,黄莹莹,李 阳,张媛媛,刘 浩
(蚌埠医学院1.第一附属医院,安徽蚌埠 233004;2.药学系,安徽省生化药物工程技术研究中心,安徽蚌埠 233030)
口腔鳞癌(oral squamous carcinoma,OSCC)是常见的恶性肿瘤,占全身肿瘤的3%。每年全球有50万新发病例,患者的5年生存率仅50%[1]。化疗是口腔癌重要的辅助治疗方法之一,但是当前化疗面临的主要问题是癌细胞对化疗药物的敏感性下降,导致多药耐药(multidrug resistance,MDR)的产生,使癌细胞产生具有同时抵抗结构及功能作用各不相同的广谱化疗药物的能力[2]。因此,研究其耐药机制、克服化疗耐药,发现新的靶点是肿瘤研究的热点之一[3]。本文研究了糖基化抑制剂TM对人口腔癌KB细胞增殖及凋亡的影响,并联合常用治疗口腔癌药物奥沙利铂,检测TM增强奥沙利铂诱导口腔癌细胞的凋亡作用,并对其初步机制进行探讨,为口腔癌的临床治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞株 人口腔上皮癌细胞株KB细胞由中科院上海细胞库购得。
1.1.2 主要试剂 Minimum Essential Medium(MEM)培养基、胰蛋白酶、青链霉素:美国Invitrogen公司。胎牛血清:杭州四季青公司。奥沙利铂:批号:H20093167,齐鲁制药有限公司产品。噻唑蓝(methyl thiazolyl tetrazolium,MTT):Sigma进口分装。Caspase-3活性检测试剂盒:碧云天公司。兔抗人Glucose regulated protein 78抗体,鼠抗人 β-actin:Santa Cruz公司。兔抗人Caspase-3抗体:Abcam公司。兔抗人 Caspase-12抗体:碧云天公司。WBKLS0500底物显色试剂为Millipore产品。
1.2 方法
1.2.1 细胞培养 口腔上皮癌细胞KB采用MEM培养液,含10%灭活胎牛血清,2.0 g·L-1Hepes,2.0 g·L-1碳酸氢钠,1 × 105IU·L-1青霉素,100 mg·L-1链霉素,37℃、饱和湿度、5%CO2培养箱中培养。
1.2.2 MTT法检测细胞存活率 单层培养的KB细胞经胰蛋白酶消化后配成单细胞悬液,接种于96孔板,密度 7 ×104个/孔,每孔 100 μl,37℃、5%CO2培养箱中培养24 h,弃培养液,加入含10%胎牛血清新鲜培养液,实验设调零组,每组设3个复孔,继续培养24、48、72 h。结束培养4 h前,每孔加入15 μl MTT(5 mg·L-1溶液,孵育,终止培养后加入三联液100 μl过夜,振荡,酶标仪检测570 nm波长吸光度值A,按公式,存活率/%=(药物组A值-调零组A值)/(对照组A-调零组A值)×100%,计算癌细胞存活率。
1.2.3 集落克隆形成实验 接种细胞于6孔细胞培养板,密度1×104个/孔,24 h后吸弃培养液,分别加 0.25 μmol·L-1衣霉素、0.125 μmol·L-1奥沙利铂以及两者合用处理细胞,每孔加入含10%血清新鲜MEM培养液2 ml,于5%CO2、37℃培养箱中继续培养,5 d后终止培养,弃上清,预冷PBS洗涤1遍,体积分数为0.04的多聚甲醛 -20℃固定10 min,弃固定液,加结晶紫染色液室温染色10 min,去离子水缓慢洗去染色液,室温下干燥,拍照。
1.2.4 PI染色检测凋亡 将人口腔癌KB细胞接种于6孔培养板,密度1×105个/孔,分别加入衣霉素、奥沙利铂以及二者合用,同时设对照组,继续培养48 h后获取细胞,PBS洗涤2遍,加入体积分数为0.70的冷乙醇固定,4℃过夜,PBS洗去固定液,PI染液混匀后,避光2 h,用流式细胞仪作流式细胞分析,检测具有亚G1期DNA含量的细胞比例,代表凋亡细胞数。
1.2.5 Caspase-3活性检测 接种细胞于6孔细胞培养板,密度1×106个/孔,分别加入衣霉素、奥沙利铂以及二者合用,同时设对照组,继续培养24 h后获取细胞。将细胞重新悬浮于50 μl冷细胞裂解缓冲液中,冰上放置10 min。4℃下12 000 r·min-110 min以去除细胞碎片。将上清转移至另一微离心管中,置于冰上。向每组加入50 μl的2×反应缓冲液/DTT混合液。向每管加入5 μl的1 mmol·L-1Caspase-3底物。水浴37℃孵育1 h。在405 nm波长下读取OD值。根据试剂盒说明所得斜率值,按Caspase-3活性单位=(试验组OD-对照组OD)/斜率,计算Caspase-3活性单位。
1.2.6 Western blot检测蛋白 取对数生长期的人口腔癌KB细胞,按每孔8×105个细胞接种于6孔板上,培养24 h后加入药物。加药培养24 h后,收集各组细胞,细胞裂解液裂解细胞后提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定总蛋白浓度。用细胞裂解液将各组蛋白稀释至等浓度,与2×上样缓冲液1∶1混合,100℃煮沸5 min蛋白变性,每组各取30 μg总蛋白样品,采用10%SDS-PAGE凝胶电泳分离蛋白,电泳分离后的蛋白电转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,5% 脱脂牛奶封闭过夜,一抗(1∶500稀释)与转移膜反应2 h,TBST洗膜5 min×3次。二抗(1∶2 000)室温孵育2 h,TBST洗膜5 min×3次,PBS洗膜1次;Immobilon Western Chemiluminescent HRP Substrate试剂盒用Bio-Rad凝胶成像系统获取图像,实验重复3次。
2 结果
2.1 衣霉素增强奥沙利铂对人口腔癌KB细胞增殖的抑制作用实验中用不同浓度的衣霉素、奥沙利铂以及联合使用,能明显抑制口腔癌细胞KB生长。0.125 μmol·L-1衣霉素作用于人口腔癌 KB细胞 24、48、72 h存活率为 90.37%、89.44%、88.91%;1 μmol·L-1奥沙利铂作用于人口腔癌 KB细胞24、48、72 h存活率分别为62.36%、47.54%、40.47%。0.125 μmol·L-1衣霉素与 1 μmol·L-1奥沙利铂诱导人口腔癌KB细胞24、48、72 h的存活率为50.78%、37.77%、23.24%,结果差异有统计学意义(P<0.05),见Fig 1。
2.2 衣霉素增强奥沙利铂对人口腔癌KB细胞集落克隆形成的抑制作用根据MTT实验结果使用低于 IC50的 0.25 μmol·L-1衣霉素、0.125 μmol·L-1奥沙利铂以及二者联合刺激细胞,使用集落克隆形成实验检测药物对人口腔癌KB细胞增殖抑制作用的影响。结果表明,衣霉素在低浓度即可增强奥沙利铂对人口腔癌KB细胞的集落克隆形成的抑制(Fig 2)。

Fig 1 Effects of drugs on viability of KB cells

Fig 2 TM increased inhibitory effect of L-OPH on colony formation of KB cells
2.3 衣霉素增强奥沙利铂诱导人口腔癌KB细胞凋亡的作用不同药物对口腔癌KB细胞株作用48 h时的凋亡率比较:0.5 μmol·L-1衣霉素刺激 48 h,诱导人口腔癌 KB细胞的凋亡率为8.3%。1 μmol·L-1奥沙利铂诱导人口腔癌KB细胞48 h的凋亡率为 24.6%。0.5 μmol·L-1衣霉素对 1 μmol·L-1奥沙利铂诱导人口腔癌KB细胞48 h的凋亡率为50.3%,与阴性对照组比较差异有统计学意义(P<0.05,Fig 3)。上述结果表明,衣霉素可以增强奥沙利铂诱导的口腔癌细胞凋亡。
2.4 衣霉素增强奥沙利铂诱导口腔癌KB细胞的Caspase-3激活作用为观察衣霉素及其联合奥沙利铂作用下对人口腔癌KB细胞Caspase-3活性的影响,根据Caspase-3活性试剂盒检测药物处理前后Caspase-3活性的变化,实验结果表明:衣霉素刺激细胞后,并未出现Caspase-3的激活,但衣霉素对奥沙利铂诱导口腔癌KB细胞Caspase-3激活有明显的增强作用(P<0.01,Fig 4)。
2.5 衣霉素对奥沙利铂诱导的人口腔癌KB细胞的GRP-78、Caspase-12和Caspase-3蛋白表达的影响人口腔癌KB细胞给予不同的刺激后收集蛋白,Western blot检测GRP-78、Caspase-12 和Caspase-3蛋白的表达,从Fig5可以看出,衣霉素可诱导细胞GRP-78的表达,衣霉素联合奥沙利铂处理KB细胞后,可诱导更强烈的GRP-78的表达。同时可以看到特异性定位于内质网上的蛋白Caspase-12的表达,联合用药组高于单独用药组,蛋白Caspase-3的表达联合用药组高于单独用药组(Fig 5)。

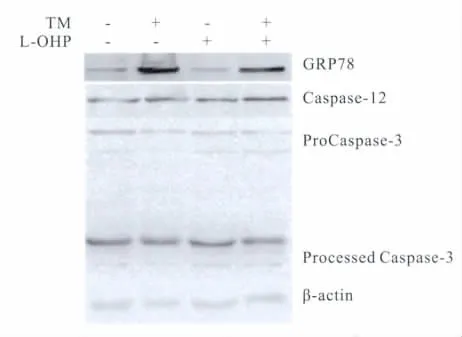
Fig 5 Expressions of GRP78 Caspase-12 and Caspase-3 in KB cells
3 讨论
肿瘤细胞的增殖和凋亡失衡是肿瘤发生、发展的重要原因,因此抑制肿瘤增殖和促进肿瘤凋亡是药物治疗肿瘤的关键。然而临床上出现对抗肿瘤药物耐受现象,常导致化疗失败[2,4-5]。因此寻求低剂量的药物以及降低药物对人体的副作用成为我们关注重点。糖基化抑制剂衣霉素的抗肿瘤作用被广泛关注,从培养细胞到实验动物,以及临床实验不断的开展,并针对单独抗肿瘤到与其他抗肿瘤药物联合应用方面进行探索[6-7]。本次研究观察了衣霉素增强奥沙利铂抗口腔癌的作用。从上述的结果可以看出,衣霉素可增加奥沙利铂对口腔癌细胞KB的增殖抑制作用,增强其诱导的肿瘤细胞凋亡;衣霉素还可增高奥沙利铂诱导口腔癌细胞KB的GRP-78表达,引起内质网应激反应,并增强Caspase-3蛋白的表达。
目前,越来越多的研究提示,细胞在内质网应激状态下(钙离子平衡失调、缺氧、营养缺乏等)激活未折叠蛋白反应,通过IRE1、ATF6、PERK起始的3条信号通路,使得多基因转录激活,翻译普遍减少而选择性翻译特性的蛋白质,促进蛋白的正确翻译和折叠,来适应内质网应激反应,因此未折叠蛋白反应被认为是细胞的一种保护机制[8-10]。但是有大量报道提示应激过强或持续时间过长内质网功能紊乱不能恢复反而可以通过激活COHP/CADD153路径、Caspase路径等促进细胞凋亡[11]。内质网分子伴侣GRP78是内质网功能的中心调节者,由于其在蛋白折叠、聚集、促进非折叠蛋白降解、内质网钙离子连接和控制内质网跨膜感受器激活等过程中具有重要的作用,因此GRP78的诱导被广泛用作内质网应激和UPR启动的生物标记[12]。无内质网应激时GRP78分别和内质网上的应激感受蛋白IRE1α、ATF6、PERK结合处于无活性状态。但当钙离子平衡失调、缺氧、营养缺乏时,触发内质网处于应激状态,未折叠蛋白堆积使得GRP78与应激感受蛋白分离,因此GRP78高表达是口腔癌细胞对内质网应激途径的化疗耐受的原因之一[12-13]。本研究中,口腔癌细胞GRP78表达量很少,然而在衣霉素刺激24 h后GRP78表达量增加。说明衣霉素上调内质网分子伴侣GRP78的表达,启动UPR反应。而当用衣霉素和奥沙利铂联合刺激24 h后GRP78表达量增加,这提示我们过强的应激有可能超过UPR对细胞保护作用的能力,从而激活了下游Caspase的活性,促进肿瘤细胞的凋亡。
Caspase-12定位于ER膜上,是内质网应激诱导凋亡的关键分子,以前体形式存在当没有发生内质网应激时,Caspase-12的表达量很少,仅在ERS刺激下活化,发生自内质网向胞质的移位,表达量增加,激活的Caspase-12可剪切细胞凋亡途径中公共下游效应分子 Caspase-3,并最终导致细胞凋亡[14-15]。本研究中口腔癌细胞中经衣霉素、奥沙利铂以及二者合用刺激24 h后Caspase-12的表达增加,并且剪切Pro-caspase-3,使得 Caspase-3的表达上调。同时,对于Caspase-3活性的检测也同样提示:合用组的Caspase-3活性明显高于单用组及对照组。这些结果都说明了过强的内质网应激反应促使UPR从细胞保护转变成促进细胞凋亡,而这一凋亡的机制是通过激活一系列Caspase。当然,关于ER应激的不同程度对肿瘤细胞存活的影响以及通过何种路径激发肿瘤细胞的凋亡尚需要更多的实验进行说明。这也是本研究需要进一步深入探讨的问题,而本次研究恰为深入认识ER应激提供一定的实验基础。
总之,本研究证实了糖基化抑制剂衣霉素对人口腔癌细胞的增殖具有抑制作用,并且可以明显增加临床常用治疗口腔癌细胞的药物诱导口腔癌细胞的凋亡作用。其机制可能是通过诱导细胞产生过多ER应激反应,增强Caspase-3活性而发挥作用。
[1] Magrath I,Litvak J.Cancer in developing countries:opportunity and challenge[J].J Natl Cancer Inst,1993,85(11):862 -74.
[2] Zhu H,Liu Z,Tang L,et al.Reversal of P-gp and MRP1-mediated multidrug resistance by H6,a gypenoside aglycon from Gynostemma pentaphyllum,in vincristine-resistant human oral cancer(KB/VCR)cells[J].Eur J Pharmacol,2012,696(1 - 3):43-53.
[3] Simons A L,Mattson D M,Dornfeld K,et al.Glucose deprivation- induced metabolic oxidative stress and cancer therapy[J].J Cancer Res Ther,2009,5:S2-6.
[4] Sarisozen C,Vural I,Levchenko T,et al.Long-circulating PEG-PE micelles co-loaded with paclitaxel and elacridar(GG918)overcome multidrug resistance[J].Drug Deliv,2012,19(8):363-70.
[5] Xu H B,Xu L Z,Li L,et al.Reversion of P-glycoprotein-mediated multidrug resistance by guggulsterone in multidrug-resistant human cancer cell lines[J].Eur J Pharmacol,2012,694(1 -3):39 -44.
[6] 程 秀,刘 浩,方 琳,等.2-DG增强乳腺癌细胞对阿霉素化疗敏感性的作用[J].中国药理学通报,2010,26(10):1371-6.
[6] Cheng X,Liu H,Fang L,et al.2-DG enhances chemosensitivity of breast cancer cells to adriamycin[J].Chin Pharmacol Bull,2010,26(10):1371-6.
[7] 李明勇,黄培春.芹菜素对人鼻咽癌CNE-2Z细胞化疗敏感性的增强作用[J].中国药理学通报,2012,28(1):88-92.
[7] Li M Y,Huang P C.Chemosensitization effects of apigenin on cisplatin in human nasopharyngeal carcinoma CNE-2Z cells[J].Chin Pharmacol Bull,2012,28(1):88 - 92.
[8] Li X K,Zhang Z,Li Z.Unfolded protein response in cancer:the physician's perspective[J].J Hematol Oncol,2011,4:8.
[9] Clarke R,Cook K L,Hu R,et al.Endoplasmic reticulum stress,the unfolded protein response,autophagy,and the integrated regulation of breast cancer cell fate[J].Cancer Res,2012,72(6):1321-31.
[10] Murai M,Inoue T,Suzuki-Karasaki M,et al.Diallyl trisulfide sensitizes human melanoma cells to TRAIL-induced cell death by promoting endoplasmic reticulum-mediated apoptosis[J].Int J Oncol,2012,41(6):2029-37.
[11] Quick Q A,Faison M O.CHOP and caspase-3 induction underlie glioblastoma cell death in response to endoplasmic reticulum stress[J].Exp Ther Med,2012,3(3):487 -92.
[12] Maddalo D,Neeb A,Jehle K,et al.A peptidic unconjugated GRP78/BiP ligand modulates the unfolded protein response and induces prostate cancer cell death[J].PLoS One,2012,7(10):e45690.
[13] Diehl J A,Fuchs S Y,Koumenis C,et al.The cell biology of the unfolded protein response[J].Gastroenterol,2011,141(1):38-41.
[14] Wang Z,Liu Z,Cao Z,et al.Allicin induces apoptosis in EL-4 cells in vitro by activation of expression of caspase-3 and-12 and up-regulation of the ratio of Bax/Bcl-2[J].Nat Prod Res,2012,26(11):1033-7.
[15] Ubol S,Kramyu J,Masrinoul P,et al.A novel cycloheptapeptide exerts strong anticancer activity via stimulation of multiple apoptotic pathways in caspase-3 deficient cancer cells[J].Anticancer Res,2007,27(4B):2473-9.