雷帕霉素对哮喘小鼠气道重塑的影响
2013-02-27延光海金光玉朴红梅郑明昱李良昌李光昭
延光海,金光玉,朴红梅,郑明昱,李良昌,李光昭
(延边大学1.医学院解剖学教研部、2.附属医院呼吸内科、3.中医学院内科学教研室,吉林 延吉 133002)
气道重塑(airway remodeling)是支气管哮喘的重要特征之一,表现为气道平滑肌增厚、杯状细胞增生、上皮下纤维化、肌成纤维细胞增生、炎症细胞浸润、细胞外基质沉积等[1]。mTOR属于磷酸肌醇激酶3相关激酶(PIKKs)家族的一员,是PI3K/Akt的下游底物,可通过改变翻译调节因子p70s6k和4E-BPI的磷酸化状态启动翻译过程。近年来研究表明mTOR与人体炎症、损伤、增生、组织修复、纤维化以及肿瘤发生发展等一系列重要的病理生理过程密切相关[2-3]。在本研究中,我们给予 mTOR抑制剂雷帕霉素(rapamycin)观察肺泡灌洗液和肺组织中各种炎性因子的变化,探讨雷帕霉素有无选择性抑制气道炎症,而进一步阐明其阻止气道重塑的发生机制。
1 材料
1.1 动物♂BALB/c小鼠30只,体质量(18±5)g,由延边大学医学部实验动物中心提供,合格证号,SCXK(吉)2011-0007。按随机数字表法分为3组,即正常对照组、哮喘模型组、雷帕霉素治疗组,每组10只。
1.2 药品与试剂卵蛋白(OVA,Sigma);氢氧化铝粉(分析纯,Sigma);细胞因子 IL-4、IL-5、IL-13 检测试剂盒(北京晶美生物工程有限公司)。mTOR抗体为美国Santa Cruz产品。
1.3 仪器设备雾化器(大连医疗器械厂U219,欧姆龙);酶联免疫检测仪(RT-2100C,美国);电泳仪及电泳槽(E-C Apparatus Corporation,美国);Western blot转膜仪(BioRad公司)。
2 方法
2.1 动物模型的复制模型制备参照延光海等[4]报道的方法:哮喘组和雷帕霉素治疗组均用0.5 ml致敏混悬液〔含OVA 8 μg和AL(OH)3干粉4 mg〕腹腔内共注射2次,注射间隔时间为5 d(d 1及d 6),对照组用生理盐水0.5 ml代替。自d 18开始激发,哮喘组和雷帕霉素治疗组予以1%OVA生理盐水5 ml雾化吸入,每日1次,每次30 min,分别持续7 d。对照组用生理盐水5 ml代替OVA处理。激发之前正常对照组和哮喘模型组气道内给予生理盐水0.5 ml;雷帕霉素治疗组分别在激发1 d前开始气道内给予稀释于生理盐水中的4 mg·kg-1的雷帕霉素,每天1次,给予4 d。末次激发24 h后处死小鼠,剪开颈部皮肤,并于气管正中处剪一小口,插入气管套管。以磷酸盐缓冲液1 ml行支气管肺泡灌洗,来回冲洗3次,收集BALF。混匀BALF,3 000 r·min-1离心10 min,取上清液,-80℃低温保存,待测细胞因子。
2.2 BALF 中细胞因子 IL-4、IL-5、IL-13 含量的检测采用酶联免疫吸附法(ELISA)测定,具体操作按试剂盒说明书进行,结果以ng·L-1表示。
2.3 组织学检查肺组织经甲醛固定后,常规脱水包埋,并做苏木精-伊红(HE)染色和PAS染色。每只小鼠随机选3张肺组织切片,每张切片以单盲法随机选取横断面较圆、直径100 μm的细支气管5支观察。
2.4 免疫组化流程及半定量测定使用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin perosidase,SP法)进行检测。组织切片脱蜡后置于0.01 mol·L-1柠檬酸缓冲液(pH值6.0)微波15 min抗原修复,冷却后用3 g·L-1H2O2处理30 min(37℃),灭活内源性过氧化物酶;1∶10正常马血清封闭30 min(37℃);弃上清液后直接加抗鼠mTOR(1∶400稀释)一抗,4℃过夜;依次加羊抗鼠抗体与辣根过氧化酶室温下各孵育30 min(37℃);滴加二氨基联苯胺(DAB),室温显色。结果判定为阳性细胞呈棕色,阳性信号为胞质/胞核内棕黄色颗粒。采用Image-pro Plus6.0图像分析软件测定mTOR含量,以校正后的平均光密度表示。平均光密度为累积光密度(IOD SUM)除以选定区域的面积(area SUM)。
2.5 肺组织mTOR蛋白表达检测取200 mg肺组织置入分别加入蛋白裂解液0.5 ml匀浆,4℃12 000×g离心2 min,取上清液测蛋白浓度。取25 g蛋白煮沸5 min后,经15%SDS-PAGE电泳,电转移至硝酸纤维素滤膜上,在5%脱脂奶粉-PBST溶液室温下封闭2 h,加入mTOR抗体4℃孵育过夜,洗膜后,加入辣根过氧化物酶标记的羊抗兔IgG,稀释度为1∶200,37℃,1 h。洗膜后在暗室中加 ECL发光试剂,X线胶片曝光1~2 min后显影、定影。杂交信号在图像分析系统中进行光密度扫描。应用β-actin作为蛋白上样量对照,其余组与其相比得到相对量,取均值。
2.6 气道高反应的检测所有动物于OVA吸入后24 h行支气管激发实验。给予4%戊巴比妥,按60 mg·kg-1BW剂量行腹腔注射麻醉,待其疼痛反射消失后,将小鼠仰卧位置于实验动物肺功能检测分析系统(AniRes2005,北京贝兰博科技有限公司)的体积描记箱内,切开皮肤分离皮下组织,暴露气管连接动物呼吸机,插入气管插管。游离颈外静脉并穿刺,固定针柄,封闭体描箱。按浓度倍增法依次静脉注射甲乙酰胆碱(methacholine 2.5、5.0、10、25、50 g·L-1),颈外静脉每次注射0.2 ml。待气道阻力降至正常后开始下一剂量,记录波形及数据。
2.7 统计学处理数值用±s表示,用SPSS 13.0统计软件,各组计量数据采用单因素方差分析(ANOVA),组间两两比较采用LSD法。
3 结果
3.1 BALF 中细胞因子 IL-4、IL-5、IL-3 的变化从Tab 1中可见,哮喘模型组小鼠BALF中IL-4、IL-5、IL-3水平升高,与正常对照组比较,差异有显著性(P<0.05);雷帕霉素干预组大鼠BALF中细胞因子IL-4、IL-5、IL-3水平降低,与哮喘模型组比较,差异有显著性(P<0.05)。
Tab 1 Changes of IL-4,IL-5,IL-3 level in BALF(±s,n=10)

Tab 1 Changes of IL-4,IL-5,IL-3 level in BALF(±s,n=10)
##P<0.01 vs saline group;*P<0.05 vs OVA group
Group IL-4/ng·L-1 IL-5/ng·L-1 IL-3/ng·L -1Saline 14.9 ±1.3 19.8 ±4.3 21.2 ±11.5 OVA 56.5 ±4.2## 62.7 ±8.6## 86.4 ±14.7##Rapamycin 47.9 ±3.4* 50.2 ±6.3* 60.1 ±11.3*
3.2 肺组织的病理学改变光镜下观察HE染色、PAS染色结果显示,Fig 1的A、D为正常对照组气道无明显改变。Fig 1的B、E为哮喘模型组气道壁及气道平滑肌明显增厚,杯状细胞化生,炎症细胞(尤其嗜酸性粒细胞)明显增多,黏膜下层增宽,黏膜上皮增生,管腔被黏液所堵塞与正常对照组比较差异有显著性(P<0.01):Fig 1的C、F雷帕霉素治疗组上述改变较哮喘组明显减轻,与模型组比较差异有显著性(P<0.01)。
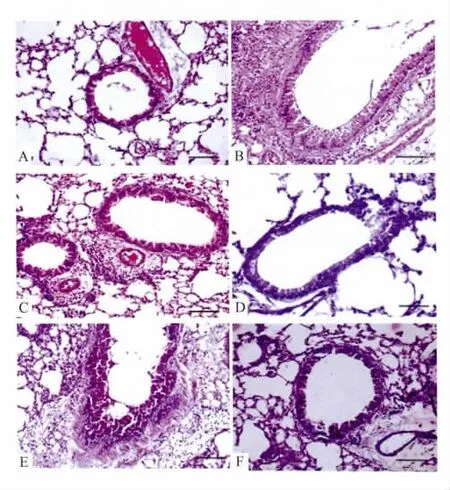
Fig 1 Effect of Rapamycin on infiltration of inflammatory cells(×200)
3.3 免疫组织化学染色检测肺组织mTOR蛋白表达免疫组织化学染色结果显示正常对照组(Fig 2A)小鼠支气管mTOR蛋白呈淡棕黄色弱免疫反应表达。哮喘模型组(Fig 2B)小鼠气道平滑肌、嗜酸性粒细胞,杯状细胞mTOR蛋白呈强棕黄色强免疫反应表达,与正常对照组比较差异有显著性(P<0.01)。雷帕霉素治疗组Fig 2C与哮喘模型组相比较,气道平滑肌、嗜酸性粒细胞,杯状细胞mTOR蛋白表达明显减弱,与模型组比较差异有显著性(P<0.01)。
3.4 肺组织mTOR蛋白表达水平哮喘模型组肺组织的mTOR蛋白表达明显高于对照组,差异有统计学意义(P<0.01);哮喘组肺组织的mTOR蛋白表达高于雷帕霉素治疗组,差异有统计学意义(P<0.01)。见Fig 3。
3.5 雷帕霉素对气道高反应的影响随着甲乙酰胆碱浓度的成倍递增,模型组与对照组的吸气阻力均有增加,当浓度到达10 g·L-1以上时,模型组与对照组比较差异有显著性(P<0.01),见Fig 4。
4 讨论
支气管哮喘是由多种炎症细胞和多种炎症介质参与的慢性气道炎症。Th2细胞亚群主要产生IL-4、IL-5、IL-3等细胞因子,可诱导嗜酸性粒细胞的产生、聚集、活化、脱颗粒,辅助B细胞产生IgE等,介导体液免疫应答及Ⅰ型变态反应[5]。在本实验中我们发现雷帕霉素干预组与哮喘模型组比较BALF中炎症细胞总数和嗜酸性粒细胞计数以及IL-4、IL-5、IL-3水平降低。
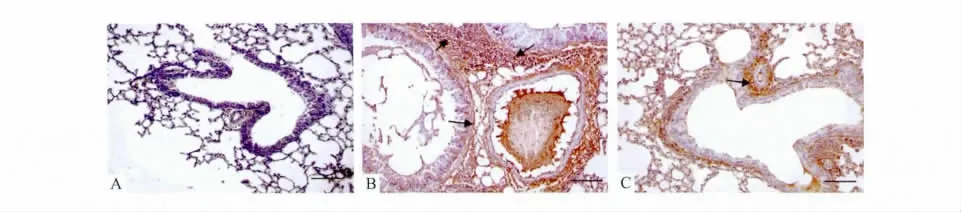
Fig 2 Immunohistochemistry staining of mTOR protein in lung(×200)
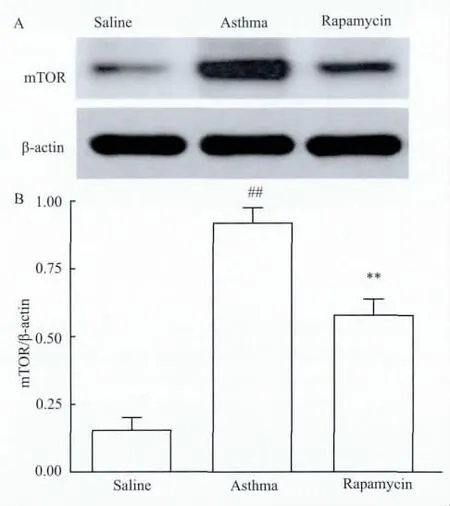
Fig 3 Effect of mTOR protein expression in lung tissues and of OVA-sensitized and-challenged mice

Fig 4 Effect of Rapamycin on airway hyperresponsivness(AHR)to methacholine
雷帕霉素属于大环内酯类抗生素,能抑制许多细胞的增生,包括T细胞分化、气道平滑肌细胞、血管内皮细胞等[6]。雷帕霉素在哺乳动物细胞内的靶点是mTOR,进入细胞与FKBP12形成RPM/FKBP12复合物,复合物结合mTOR并以灭其功能,从而阻断了mTOR介导的信号通路。近期研究表明,T细胞缺乏mTOR时不能转变为Th1、Th2或Th17效应细胞[7]。这些研究指出mTOR在T细胞分化过程中扮演着极其重要的角色。本实验中我们发现在哮喘模型组嗜酸性粒细胞过度表达mTOR蛋白,说明嗜酸性粒细胞的活化、聚集与mTOR蛋白的激活密切相关。IL-4是诱导Th2淋巴细胞分化的关键细胞因子,IL-4诱导B细胞分化为浆细胞,进而产生IgE,最终形成以IgE依赖为特征的速发型变态反应及以嗜酸性粒细胞浸润为主的慢性气道炎症[8];IL-5通过调节嗜酸性粒细胞的活化、聚集、脱颗粒等参与哮喘的发生和发展[9];研究表明IL-3产于Th2细胞、嗜酸性粒细胞,是支气管哮喘的中枢调点,气道内IL-3水平增加、其表达与气道内嗜酸性粒细胞增加数量产生有关[10]。以上研究表明mTOR的激活可促进嗜酸性粒细胞活化与聚集,并进一步诱导释放和激活 IL-4、IL-5、IL-3等炎症细胞因子的释放。
研究证明mTOR/p70S6K信号通路在气道平滑肌的生长和增殖中起着关键作用,可能是防止哮喘中平滑肌重塑的选择性靶点[11]。本实验中我们研究发现哮喘模型组增生的气道平滑肌过度表达mTOR蛋白,说明mTOR激活可诱导气道平滑肌增生、肥大。气道高反应性(AHR)是哮喘的特征性表现之一,它的出现表示气道平滑肌收缩阈值降低。研究证实AHR和气道平滑肌增生、肥大密切相关[12],而气道炎症可诱导气道平滑肌增生与肥大[13]。通过实验我们发现雷帕霉素通过抑制mTOR信号通路降低Th2类细胞因子的产生,近而减轻了气道炎症,同时减轻了由于炎症本身引起的气道阻力增加。对于雷帕霉素如何调节平滑肌细胞的收缩有待进一步探讨。
综上所述,我们推测雷帕霉素对气道平滑肌增殖和气道杯状细胞过度活化的抑制作用是通过阻断mTOR信号途径而实现的。
[1] Manetsch M,Che W,Seidel P,et al.MKP-1:A negative feedback effector that represses MAPK-mediated pro-inflammatory signaling pathways and cytokine secretion in human airway smooth muscle cells[J].Cell Signal,2012,24(4):907 -13.
[2] 吴苗苗,苑玉和,陈乃宏.mTOR信号通路与神经退行性疾病研究进展[J].中国药理学通报,2011,27(11):1481-3.
[2] Wu M M,Yuan Y H,Chen N H.Research progress on the mTOR signaling pathway and neurodegenerative disease[J].Chin Pharmacol Bull,2011,27(11):1481 -3.
[3] 于春艳,李洪岩,钟加滕,等.维生素K3通过下调mTOR信号途径而诱导HeLa细胞自噬[J].中国药理学通报,2011,25(9):1173-6.
[3] Yu C Y,Li H Y,Zhong J T,et al.Vitamin K3induces autophagy in HeLa cells through downregulating themammalian target of rapamycin(mTOR)pathway[J].Chin Pharmacol Bull,2011,25(9):1173-6.
[4] 延光海,朴红梅,安昌善,等.Pyrin重组蛋白对支气管哮喘小鼠气道炎症的影响[J].中华微生物学和免疫学杂志,2012,32(2):102-7.
[4] Yan G H,Piao H M,An C S,et al.The inhibitory effects and mechanism of Pyrin recombination protein on airway intlamation in mouSe with bronchial asthma[J].Chin Microbiol Immunol,2012,32(2):102-7.
[5] Choi Y H,Jin G Y,Guo H S,et al.Silibinin attenuates allergic airway inflammation in mice[J].Biochem Biophys Res Commun,2012,427(3):450-5.
[6] Goncharova E A,Lim P N,Chisolm A,et al.Interferons modulate mitogen-induced protein synthesis in airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2010,299(1):L25 -35.
[7] Delgoffe G M,Kole T P,Zheng Y,et al.The mTOR kinase differentially regulates effector and regulatory T cell lineage commitment[J].Immunity,2009,30(6):832 - 44.
[8] Keskin O,Keskin M,Kucukosmanoglu E,et al.Exhaled RANTES and interleukin 4 levels after exercise challenge in children with asthma[J].Ann Allergy Asthma Immunol,2012,109(5):303-8.
[9] Jakiela B,Szczeklik W,Plutecka H,et al.Increased production of IL-5 and dominant Th2-type response in airways of Churg-Strauss syndrome patients[J].Rheumatol(Oxford),2012,51(10):1887-93.
[10] Zhu Z,Zheng T,Homer R J,et al.Acidic mammalian chitinase inasthmatic Th2 inflammation and IL-3 pathway activation[J].Science,2004,304(5677):1678 -82.
[11] Krymskaya V P.Targeting the phosphatidylinositol 3-kinase pathway in airway smooth muscle[J].Bio Drugs,2007,21(2):85-95.
[12] Possa S S,Charafeddine H T,Righetti R F,et al.Rho-kinase inhibition attenuates airway responsiveness,inflammation,matrix remodeling,and oxidative stress activation induced by chronic inflammation[J].Am J Physiol Lung Cell Mol Physiol,2012,303(11):L939-52.
[13] Singh S P,Mishra N C,Rir-Sima-Ah J,et al.Maternal exposure to secondhand cigarette smoke primes the lung for induction of phosphodiesterase-4D5 isozyme and exacerbated Th2 responses:rolipram attenuates the airway hyperreactivity and muscarinic receptor expression but not lung inflammation and atopy[J].J Immunol,2009,183(3):2115 -21.
