蜂毒素对人胚肺成纤维细胞生长的抑制作用及其机制探讨
2013-02-27于明哲吴小琴李小枫
于明哲,李 俊,黄 成,徐 涛,吴小琴,李小枫
(安徽医科大学药学院,安徽合肥 230032)
蜂毒素(mellitin)是蜂毒的主要活性成分,具有广泛的生物学及药理学作用。目前研究发现蜂毒素具有抗炎镇痛、抗病毒、抗肿瘤等生物学效应[1-2]。细胞周期蛋白D1(cell cycle protein D1,Cyclin D1)近年来在细胞增殖中的作用引起人们的广泛注意,细胞在从G1期进入S期的过程中,Cyclin D1与细胞周期蛋白依赖激酶4(cyclin-dependent kinase 4,CDK4)起着非常重要的作用[3-4],而进入 S期所必需的一些基因的表达又受到转录因子(E2F)家族的调控[5]。Cyclin D1/CDK4-E2F通路在蜂毒素引起的细胞周期改变中的作用研究较少。本实验采用蜂毒素体外干预MRC-5,观察药物对MRC-5体外增殖的抑制作用及其Cyclin D1/E2F信号通路的关系,拟为临床肺纤维化的治疗提供试验依据。
1 材料
1.1 实验细胞株人胚肺成纤维细胞株(MRC-5),购自中国科学院上海细胞库。
1.2 试剂蜂毒素由安徽省百春制药厂提供(批号:20091022);胎牛血清,杭州四季青公司;DMEM高糖培养基,Hyclone;TRIzol,美国 Sigma;Reverse Transcription System逆转录试剂盒,Ferments公司;细胞周期与细胞凋亡检测试剂盒,碧云天;小鼠抗β-actin抗体,Santan Cruz公司;兔抗p21及E2F-1,武汉博士德公司;兔抗Cyclin D1及CDK4,HRP标记的辣根过氧化物酶二抗,北京中杉金桥公司;PCR引物由上海生工生物公司合成。
1.3 实验器材MK3型酶标仪,荷兰雷勃公司产品;SW-CJ-IF型超净工作台,江苏苏净集团苏州安泰空气技术有限公司产品;NAPCO-6100型细胞培养箱,美国SHELLAB公司产品;PCR扩增仪,德国Eppedorf公司产品;Bio-rad电泳仪,美国伯乐公司产品;COULTZER EPICS XL-MCL流式细胞仪,美国Beckman Counter公司产品。
2 方法
2.1 MRC-5细胞的培养采用含10%胎牛血清的DMEM培养液,在37℃、5%、CO2及饱和湿度条件下培养,待细胞生长至70% ~80%密度时进行传代。
2.2 细胞增殖试验
2.2.1 实验分组 正常组:作为各处理组的共同对照;蜂毒素处理组:设 0.5、1、2、4、8 mg·L-1浓度组。每组5个复孔,实验重复3次。
2.2.2 细胞培养 取对数生长期的MRC-5细胞制成单细胞悬液,以1×108·L-1的细胞密度接种于96孔板,每孔约100 μl,37℃过夜。待细胞完全贴壁后加入蜂毒素,分别作用12、24、48 h后,弃去培养基,换无血清培养液,然后每孔加MTT(5 g·L-1)20 μl,37℃继续孵育 4 h 后,弃上清并每孔加150 μl二甲基亚砜溶解细胞内结晶,室温振荡溶解10 min后,于490 nm波长处测吸光度(A值)。
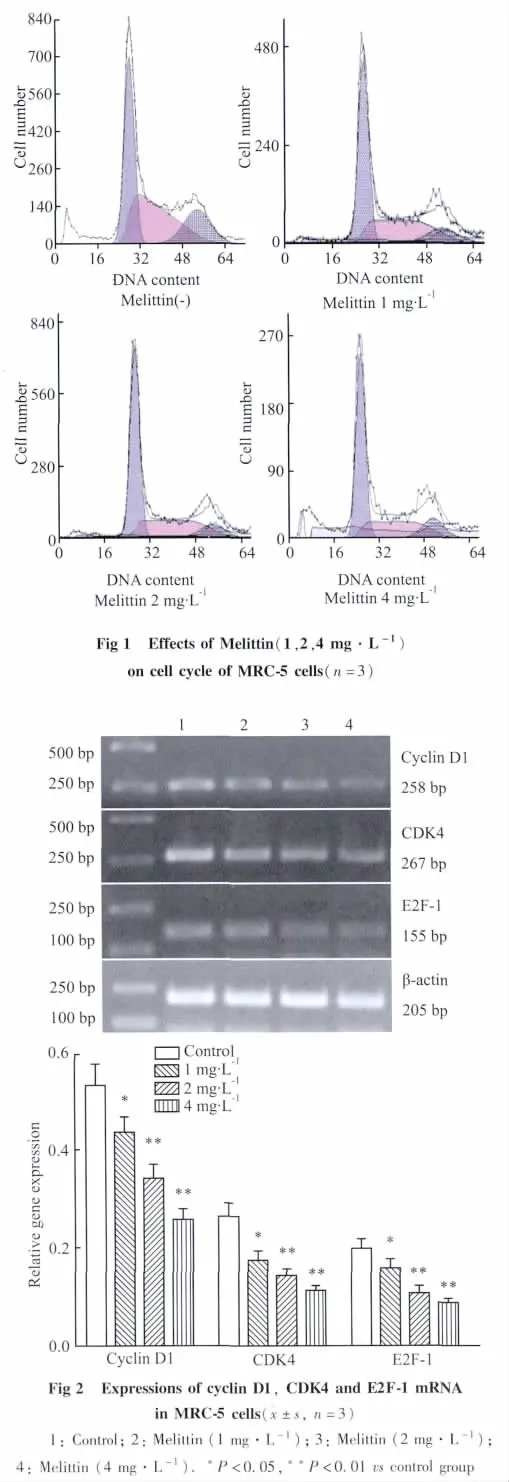
2.3 流式细胞术检测细胞周期取对数生长期MRC-5细胞,用含10%FBS的DMEM培养液调整细胞浓度为1×109·L-1,接种于25 cm2培养瓶中,37℃、5%、CO2培养箱中培养12 h至贴壁。加入浓度分别为1、2、4 mg·L-1的蜂毒素(用 PBS 稀释),对照组加入等体积培养液,作用24 h后,PBS洗细胞3 次,胰蛋白酶消化,1 500 r·min-1离心 5 min,重复以上操作3次,收集细胞沉淀。70%冷乙醇固定过夜,24 h后离心去上清,加入PI染液,室温下进行脱氧核糖核酸(DNA)染色30 min,样品4℃避光保存。应用Beckman流式细胞仪进行检测。计算细胞周期各时相DNA的百分含量。
2.4 RT-PCR 检测MRC-5中Cyclin D1、CDK4 及E2F-1mRNA的表达采用TRIzol法提取MRC-5总RNA,用AMV逆转录酶逆转录得到cDNA。下列PCR引物(Tab 1)均由上海生工生物工程技术服务有限公司合成。PCR扩增反应条件为:Cyclin D1,94℃变性40 s,58℃复性40 s,72℃延伸1 min,35 个循环,CDK4,94℃变性 40 s,61℃复性 40 s,72℃延伸1 min,35 个循环;E2F-1,94℃变性 40 s,53℃复性40 s,72℃延伸1 min,35个循环。PCR产物在琼脂糖凝胶上电泳,凝胶图像分析系统检测光密度。采用β-actin为内参照,分别以相应基因与β-actin光密度比值表示该基因相对表达水平。

Tab 1 PCR primers and length of amplification
2.5 Western blot检测 Cyclin D1、CDK4、p21 及E2F-1的蛋白表达取经处理24 h后的细胞,加500 μl RIPA 细胞裂解液,20 μl蛋白酶抑制剂,5 μl PMSF于冰上裂解25 min后置于4℃离心机上12 000 r·min-1,离心 30 min。取上清,用 BCA 法进行蛋白定量。加入SDS上样缓冲液,100℃,加热10 min使蛋白变性。样品经SDS-聚丙烯酰胺凝胶电泳分离,通过电转移法将蛋白转移至PVDF滤膜上。室温下用5%的脱脂奶粉封闭3 h,膜清洗后加入一抗,一抗的稀释浓度为:Cyclin D1(1∶500稀释)、CDK4(1∶500稀释)、p21(1∶200稀释)及E2F-1(1∶200稀释),4℃过夜。再分别加入与一抗相匹配的二抗(1∶8 000稀释),室温放置1 h,ECL发光试剂盒显影,以β-actin为内参照,分别以相应蛋白与β-actin光密度比值表示该蛋白相对表达水平。
2.6 统计学分析实验数据采用SPSS 17.0软件进行统计学处理,所有数据结果均以±s表示,组间比较采用One-Way ANOVA检验。
3 结果
3.1 蜂毒素对MRC-5细胞增殖的抑制作用MTT结果显示(Tab 2),与空白对照组相比,蜂毒素各浓度组(0.5、1、2、4、8 mg·L-1)对 MRC-5 细胞增殖具有明显抑制作用,且随着药物作用时间延长及药物浓度的增加而增强。
Tab 2 Effects of Melittin on proliferation of MRC-5 cells(±s,n=3)

Tab 2 Effects of Melittin on proliferation of MRC-5 cells(±s,n=3)
*P<0.05,**P<0.01 vs control group
Group Dose/mg·L-1 12 h/A490 24 h/A490 48 h/A 490 Control - 0.337 ±0.039 0.453±0.051 0.568 ±0.084 Melittin 0.5 0.328 ±0.032 0.433±0.046 0.500 ±0.089*1 0.311 ±0.035 0.361±0.050** 0.429 ±0.053**2 0.296 ±0.028 0.335±0.045** 0.406 ±0.062**4 0.273 ±0.030* 0.291±0.024** 0.313 ±0.036**8 0.249 ±0.021** 0.288±0.036** 0.289 ±0.047**
3.2 蜂毒素对MRC-5细胞周期的影响流式细胞仪检测,MRC-5细胞的细胞周期均受到不同程度的影响,与空白对照组相比,在蜂毒素(1、2、4 mg·L-1)作用细胞24 h后,G0/G1期 DNA相对增多。对照组G0/G1期DNA比例为40.4% ±3.76%,蜂毒素(1、2、4 mg·L-1)作用 24 h 后,G0/G1期 DNA的含量升高到 50.67% ±4.82%(P<0.05)、57.12% ±6.01%(P <0.01)、56.00% ±5.81%(P<0.01),且4 mg·L-1的蜂毒素处理组有部分凋亡。见Fig 1。
3.3 蜂毒素对 MRC-5细胞中 Cyclin D1、CDK4、E2F-1的mRNA表达的影响MRC-5细胞经不同浓度蜂毒素(1、2、4 mg·L-1)处理 24 h 后,Cyclin D1、CDK4、E2F-1 mRNA的表达下降,且具有浓度依赖性(P <0.05;P<0.01),见 Fig 2。
3.4 蜂毒素对 MRC-5细胞中 Cyclin D1、CDK4、E2F-1的蛋白表达的影响MRC-5细胞经不同浓度蜂毒素(1、2、4 mg·L-1)处理 24 h 后,p21 蛋白表达升高,Cyclin D1、CDK4、E2F-1蛋白的表达下降,且具有浓度依赖性(P<0.05;P<0.01),见Fig 3。
4 讨论
肺纤维化是多种原因引起的慢性肺疾病发展到晚期的共同病理变化,其集中表现为成纤维细胞的异常增殖和细胞外基质的过度沉积[6-7]。因此,寻找有效药物抑制肺成纤维细胞的过度增殖是防治肺纤维化的一种有效手段。蜂毒素是蜂毒的主要组成及活性成分,具有高度的药理作用和生物学活性,可以通过多种途径影响细胞的信号传导系统。近年来研究发现尚有抗肝纤维化作用[8],但其对肺纤维化的作用尚未见文献报道。本实验研究发现:蜂毒素对人胚肺成纤维细胞生长的抑制效应随着药物作用时间的延长及浓度的升高而逐渐增强。
肺成纤维细胞的过度增生和分泌胶原在肺纤维化形成过程中扮演了重要的角色[9]。细胞增殖与细胞周期蛋白(cyclins)表达有密切关系。细胞周期主要由细胞周期蛋白(cyclin)、细胞周期蛋白依赖激酶(cyclin-dependent kinase,CDK)以及细胞周期蛋白依赖激酶抑制蛋白(cyclin-dependent kinase inhibitors,CKI)所构成的网络系统调节。本实验结果显示蜂毒素可以影响人胚肺成纤维细胞周期的正常移行,阻止G1期细胞向S期的转变,使细胞停滞于G0/G1期,减少了DNA合成和有丝分裂,从而发挥抑制细胞增殖的作用。因此推测蜂毒素很可能是通过影响G1期周期调节因子的活性而发挥周期调控作用。
Cyclin D1为细胞周期G1期的正性调控蛋白,Cyclin D1与CDK4形成复合物,驱使细胞通过R点(restriction point)由G1期进入S期而发挥促增殖作用[10]。本实验结果显示蜂毒素(1、2、4 mg·L-1)下调Cyclin D1及CDK4的表达,使细胞不能通过R点。
哺乳动物细胞周期限制点主要存在于G1/S期,当细胞通过该限制点,细胞周期进程向下进行将不可避免。调控G1/S期以及DNA合成的相关基因的表达主要受E2F家族转录因子的调节[11-12]。转录因子E2F-1是E2F家族中的成员之一,是细胞周期G1期向S期过渡的重要调控因子,在调节细胞周期进程和细胞增殖过程中起着关键作用。本研究中蜂毒素(1、2、4 mg·L-1)下调 MRC-5 中 E2F-1 的表达,使细胞生长停滞在G0/G1期。
p21,是一种广泛的细胞周期依赖性蛋白激酶(CDKS)抑制物,其通过与Cyclin竞争性结合CDK以及抑制Cyclin D/CDK复合物的活性而发挥限制细胞周期进程的作用[13]。本实验研究发现蜂毒素抑制细胞生长,并且下调Cyclin D1和CDK4表达,上调p21表达。

Fig 3 Protein expressions of Cyclin D1,CDK4,p21 and E2F-1 in MRC-5 cells(±s,n=3)
综上所述,本研究结果证实了蜂毒素能有效抑制MRC-5细胞增殖,可阻滞MRC-5细胞于G0/G1期,该作用可能与蜂毒素抑制Cyclin D1、CDK4及E2F-1的表达,上调p21的表达有关,提示蜂毒素可能通过抑制Cyclin D1/E2F信号转导通路发挥抗纤维化作用。
[1] Wang C,Chen T,Zhang N,et al.Melittin,a major component of bee venom,sensitizes human hepatocellular carcinoma cells to tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)-induced apoptosis by activating CaMKII-TAK1-JNK/p38 and inhibiting IkappaBalpha kinase-NFkappaB[J].J Biol Chem,2009,284(6):3804-13.
[2] Park H J,Son D J,Lee C W,et al.Melittin inhibits inflammatory target gene expression and mediator generation via interaction with IkappaB kinase[J].Biochem Pharmacol,2007,73(2):237 -47.
[3] Alt J R,Cleveland J L,Hannink M,Diehl J A.Phosphorylationdependent regulation of cyclin D1 nuclear export and cyclin D1-dependent cellular transformation[J].Genes Dev,2000,14(24):3102-14.
[4] Scime A,Li L,Ciavarra G,Whyte P.Cyclin D1/cdk4 can interact with E2F4/DP1 and disrupts its DNA-binding capacity[J].J Cell Physiol,2008,214(3):568 -81.
[5] Trimarchi J M,Lees J A.Sibling rivalry in the E2F family[J].Nat Rev Mol Cell Biol,2002,3(1):11 -20.
[6] Datta A,Scotton C J,Chambers R C.Novel therapeutic approaches for pulmonary fibrosis[J].Br J Pharmacol,2011,163(1):141-72.
[7] 杨雅茹,黄 艳,李 俊,等.枇杷叶三萜酸对TGF-β1刺激的人胚肺成纤维细胞转分化及ERK通路的影响[J].中国药理学通报,2011,27(3):341-6.
[7] Yang Y R,Huang Y,Li J,et al.The mechanism of Triterpene acids of loquat on transforming growth factor-β1(TGF-β1)induced lung fibroblast-myofibroblast transdiferentiation and ERK1/2 signaling way[J].Chin Pharmacol Bull,2011,27(3):341 - 6.
[8] Park J H,Kum Y S,Lee T I,et al.Melittin attenuates liver injury in thioacetamide-treated mice through modulating inflammation and fibrogenesis[J].Exp Biol Med(Maywood),2011,236(11):1306-13.
[9] Willis B C,duBois R M,Borok Z.Epithelial origin of myofibroblasts during fibrosis in the lung[J].Proc Am Thorac Soc,2006,3(4):377-82.
[10] Engebretsen B J,Irwin D,Valdez M E,et al.Acute hypobaric hypoxia(5486 m)induces greater pulmonary HIF-1 activation in hilltop compared to madison rats[J].High Alt Med Biol,2007,8(4):312-21.
[11] Tashiro E,Tsuchiya A,Imoto M.Functions of cyclin D1 as an oncogene and regulation of cyclin D1 expression[J].Cancer Sci,2007,98(5):629-35.
[12] Cobrinik D.Pocket proteins and cell cycle control[J].Oncogene,2005,24(17):2796-809.
[13] Stivala L A,Cazzalini O,Prosperi E.The cyclin-dependent kinase inhibitor p21CDKN1A as a target of anti-cancer drugs[J].Curr Cancer Drug Targets,2012,12(2):85 -96.
