地塞米松的诱导效应对异烟肼大鼠肝毒性的影响
2013-02-27王来友陈玲燕毕惠嫦胡因铭
王来友,陈玲燕,程 宝,毕惠嫦,胡因铭
(1.广东药学院中医药研究院,广东广州 510006;2.中山大学临床药理研究所,广东 广州 510006)
利福平(rifampicin,RIF)与异烟肼(isoniazid,INH)均是临床上预防和治疗结核的一线药物,通常需联合应用,但也引起诸多不良反应,其中肝毒性最为严重。INH在与RIF合用的情况下,其肝损伤发生率明显增加,部分调查显示可达28%[1]。INH所引起的肝损伤为细胞毒性,其发生原因复杂,迄今对其确切的发生机制尚无明确认识[2]。最近,研究者们发现人肝脏药物代谢酶CYP3A4与INH导致的肝细胞毒性有关 。在过表达CYP3A4的HepG2细胞体系中,用 0.1 - 100 μmol·L-1INH 处理后,相对于对照组,细胞存活率明显下降,但加入CYP3A4抑制剂酮康唑后,细胞存活率又恢复至空白对照组水平[3]。Yoshikawa 等[4]的实验也进一步证实了CYP3A4可以明显介导INH产生的细胞毒性。另有报道RIF可以增加INH对人肝细胞的毒性,但是不能增加对大鼠肝细胞的毒性[5]。迄今国内外尚未获得CYP3A参与INH肝毒性的体内证据。
RIF是肝微粒体代谢酶的诱导剂,可强烈的激活人孕烷X受体(human pregnane X receptor,hPXR)。但PXR有很强的种族特异性,RIF对hPXR有特异性激活作用,对啮齿类动物PXR的激活作用相当弱或无[6]。因而本实验用大鼠的特异性PXR激活剂地塞米松(dexamethasone,DEX)代替hPXR激活剂RIF,为临床上抗结核药物RIF-INH联合应用所导致的肝损伤提供动物模型,并探讨CYP3A在其中的意义,为进一步的深入机制研究和防治策略提供依据。
1 材料
1.1 药物及试剂DEX购自美国Alfa Aesar(天津)化学有限公司,INH、咪达唑仑购自美国Sigma-Aldrich公司,丙氨酸氨基转移酶(ALT)、天门冬氨酸转移酶(AST)和碱性磷酸酶(ALP)测定试剂盒购自北京利德曼生化股份有限公司,总胆固醇(TC)和总甘油三酯(TG)测定试剂盒购自中生北控生物科技股份有限公司;大鼠肝微粒体蛋白酶抑制剂购自Thermo Scientific公司,氯化钠、无水乙醇、甲醛、K2HPO4、KH2PO4等购自广州化工试剂厂,为分析纯。
1.2 实验仪器切片机(浙江宝华无线电厂);YD-bL智能型生物细胞包埋机冷冻台、KD-BMⅡ电脑生物细胞包埋机、KD-TS1生物细胞自动脱水机(浙江省宝华市科迪仪器设备有限公司);奥林巴斯IX71倒置显微镜(日本Olympus公司),TSQ-Quantum型液相色谱-质谱仪(美国Finnigan公司)。
1.3 实验动物与饲料SPF级 Sprague-Dawley(SD)♂大鼠,270~300 g,广东省医学实验动物中心提供〔SCXK(粤)2008-0002〕。含DEX饲料由广东省医学实验动物中心提供并加工:将160 mg DEX均匀地混合在8 kg大鼠饲料中,加工至每公斤大鼠饲料含DEX 20 mg,钴辐照灭菌,SPF级包装。1 000 mg·L-1INH溶液的配制:用电子分析天平精确称取1g INH,用1 000 ml高压灭菌水配制成1 000 mg·L-1INH溶液。分装于500 ml饮用水瓶中,备用。
2 方法
2.1 实验分组、给药剂量及给药途径24只♂SD大鼠按体重随机分成4组,每组6只,单笼喂养。分别按每日 0.5 mg·kg-1和 50 mg·kg-1灌胃给药剂量配备相应的DEX饲料和INH饮用水。具体给药方式及途径如下:(1)空白对照组:给予普通饲料和空白饮用水;(2)DEX对照组:给予含DEX的饲料和空白饮用水;(3)INH组:给予普通饲料和含INH的饮用水;(4)DEX-INH组:给予含DEX的饲料和含INH的饮用水。于SPF级环境饲养28 d,动物室内温度20℃ ~25℃、相对湿度40% ~70%,换气次数10~15次/h,保持12 h光照循环。
2.2 肝组织病理形态学检查实验前禁食12 h,可自由饮用不含INH的普通水。颈椎脱臼处死大鼠后立即开腹,取出肝脏,用刀片在肝脏最大叶距离边缘1/5处取出宽约3 mm,长约2 cm的肝脏组织,立即放入10%中性福尔马林中。10 d后取出肝脏组织,经取材、固定、组织脱水、透明、浸腊、包埋、切片、裱片及烤片、HE染色、封片等程序后,对各组大鼠的肝脏组织切片进行图像采集,并用Image-Pro Plus 6.0软件对组织中的特征病变区域面积进行统计,采用按点计数方式评估肝损伤的严重程度[7]。
2.3 CYP3A活性测定采用差速超速离心法制备肝微粒体。取实验后冷冻保存的肝样品称重后,用冰冷的蔗糖溶液洗涤后,转移至塑料管中。每100 mg肝加入含蛋白酶抑制剂的匀浆缓冲液(320 mmol·L-1蔗糖,50 mmol·L-1KH2PO4,1 mmol·L-1EDTA)600 μl,上下均匀移动塑料管20 s,避免泡沫产生,制备匀浆,4℃下9 000×g离心20 min,取上清液,100 000 ×g,4℃下离心 60 min,弃上清。下层沉淀润洗后,重新混悬于含冰冻缓溶液(100 mmol·L-1K2HPO4/KH2PO4,20%(V/V)甘油,1 mmol·L-1EDTA)中,混匀,分装成两份,-80℃ 冻存备用,分别用于总蛋白含量测定和CYP3A1/2活性检测。BCA法测定肝微粒体蛋白质浓度。参考实验室已经建立的方法,咪达唑仑用作测定CYP3A活性的探针药物[8]。即分别用制备的不同组的含0.25 g·L-1大鼠肝微粒体在200 μl体系中于37℃体外预孵育 5 min 后,加入 20 mmol·L-1NADPH 10 μl启动反应,轻摇30 min后加入冰冷的乙腈200 μl终止反应。旋涡振荡2 min,静置10 min,20 000 × g离心10 min,取上清液进样10 μl,LC-MS检测咪达唑仑代谢产物1’-羟基咪达唑仑的含量。
2.4 血清中各种生化指标的检测在从大鼠取肝组织前,眼眶静脉丛采血约2 ml,1 000×g离心5 min。实验时,取出200 μl血清,采用日立7020全自动生化分析仪按照试剂盒测定血清中ALT、AST和ALP水平以及TC和TG的浓度。
2.5 统计学处理实验数据用±s表示,应用SPSS 17.0软件包进行方差分析,组间比较采用Dunett t检验方法进行显著性检验。
3 结果
3.1 肝组织病理形态学检查如代表性肝组织切片Fig 1所示,6只对照组大鼠肝脏结构正常,肝小叶清晰可见,肝细胞排列较整齐,汇管区未见胆管增生,未见炎细胞浸润;INH组(5/6)大鼠肝部分区域(25.6% ±4.2%)区域发生轻微水肿(黑色箭头所示),其余结构未见异常;DEX组大鼠汇管区胆管轻微增生(3.2% ±1.5%),均出现局灶性肝细胞梗死(7.4% ±2.3%),如Fig 1 DEX中黑色五角星所示。INH-DEX合并给药后,1只大鼠在d 20出现死亡,其余5只大鼠均出现大片状程度不一的肝细胞(71.2% ±13.6%)梗死(如五角星所示),梗死区周围较多肝细胞(40.1% ±11.8%)水肿(如箭头所示),肝脏损伤程度明显加剧,肝损伤分值明显高于对照组和INH组(P<0.01),提示肝脏损伤程度明显加剧。
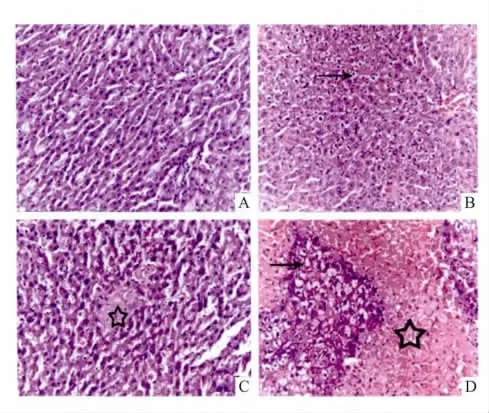
Fig 1 Representative liver section of rats treated with DEX-containing diet(20 mg·kg-1,W/W)and INH-containing water(1000 mg·L-1,W/V)for 28 days(HE ×200)
3.2 肝指数与CYP3A活性如Tab 1所示,服用INH后,大鼠肝脏指数与CYP3A活性与对照组相比无明显变化。但服用DEX后,与对照组相比其肝指数明显增加,CYP3A活性增加了2.58倍(P<0.01)。而 DEX与 INH合用组,其肝脏指数与CYP3A活性与 DEX组差别不明显(P>0.05),CYP3A活性与对照组相比增加了近3倍(P<0.01)。因此可以看出,与对照组相比,DEX与INH合用后其增加的肝脏指数与CYP3A活性主要来自于DEX。
Tab 1 Liver index and relative hepatic CYP3A activity in rats treated with DEX-containing diet(20 mg·kg-1,W/W)and INH-containing water(1 000 mg·L-1,W/V)for 28 days( ± s,n=5 ~ 6)

Tab 1 Liver index and relative hepatic CYP3A activity in rats treated with DEX-containing diet(20 mg·kg-1,W/W)and INH-containing water(1 000 mg·L-1,W/V)for 28 days( ± s,n=5 ~ 6)
**P<0.01 vs control group
Group Liver index CYP3A relative activity Control 3.84 ±0.06 1.00 ±0.15 INH 3.95 ±0.07 1.19 ±0.18 DEX 5.26 ±0.09** 2.58 ±0.42**DEX+INH 5.65 ±0.23** 2.99 ±0.45**
3.3 血清生化检测结果如Tab 2所示,饮用含1 000 mg·L-1INH的水28 d,大鼠血清中 AST和ALP水平均无明显变化(P>0.05),ALT略有升高,但TC和TG均明显升高(P<0.05),表明长期单用INH能增加大鼠的脂质水平。服用DEX后,其ALT和TC均有升高(P<0.05),而AST、ALP和TG水平明显增加(P<0.01)。DEX-INH两药合用后,血清中所检测的ALT、AST、ALT、TC和TG五项指标均明显上升(P<0.01),与对照组相比,其肝细胞损伤指标ALT上升了3.7倍,AST上升了2.7倍,与肝组织切片观察的结果相一致。而与INH组相比,除TG水平有上升外(P<0.05),其它4项指标差异均有显著性(P<0.01)。
4 讨论
抗结核药物所导致的肝损伤一直是临床上结核患者依从性较差的主要原因。到目前为止,尚没有能完全模拟临床实际情况的整体动物模型,其主要原因还是在于种属差异性,也给进一步的机制和防治策略研究带来障碍。一些学者认为INH的肝毒性与N-乙酰基转移酶(NAT)和CYP2E1介导产生的毒性中间产物有关。其毒性代谢产物推测为肼(hydrazine)和乙酰肼(acetylhydrazine)[9]。然而分别用这两种代谢产物100 mg·kg-1的剂量处理C57BL/6小鼠时,却并不发生明显的药物性肝损伤[10]。而本实验中,用大鼠的特异性PXR激活剂DEX后,CYP3A的活性明显增加,同时也明显增强了INH的肝毒性,表明 CYP3A可能与临床上RIFINH合用所导致的肝毒性有关。张志华等[11]利用人肝细胞模型发现,葡萄柚汁中的CYP3A4抑制剂柑桔素能明显减轻INH和RIF合用的肝细胞毒性,进一步提示对CYP3A活性进行调节可能对防治RIF-INH所导致的肝损伤具有重要意义,但仍需更直接的体内证据进一步提供支持。
本实验利用含DEX的饲料和含INH的水自然给药的方式。预实验结果表明,一只280 g左右的SD大鼠大约日消耗15 g左右的饲料和30 ml左右的饮用水,利用率均为50%左右。因而我们用的含20 mg·kg-1DEX的饲料近似于灌胃给药的等效剂量为 0.5 mg·kg-1,含 1 000 mg·L-1INH 的水近似于灌胃给药的等效剂量为50 mg·kg-1。
在我们检测的血清学指标中,DEX的使用均导致AST/ALT>1,提示肝细胞线粒体损伤严重。然而,有研究提示DEX能通过抑制氧化应激对非甾体抗炎药双氯芬酸钠的肝损伤有保护作用[12],造成这种相反结果的原因可能与DEX应用的时程和DEX能同时激活糖皮质激素受体等其它靶点相关。另外,在我们复制的DEX-INH导致的大鼠慢性肝毒性模型中,除观察到肝损伤的指标ALT、AST和ALP在DEX于INH合并后明显提高外,其脂质水平TC和TG也有明显提高。已有研究报道RIF会导致临床上的高脂血症[13],最新的研究也表明INH能使小鼠血清脂质水平升高[14]。有报道RIF-INH的合用产生的肝损伤可能与其升高的脂质导致脂质过氧化物的增加有关[15]。结合上述研究结果,“降脂调肝”策略可能是防治抗结核药物性肝损伤的一个新的选择。
Tab 2 Effect of INH,DEX and INH-DEX treatment on serum ALT,AST,ALP,TC and TG level in rats(±s,n=5-6)
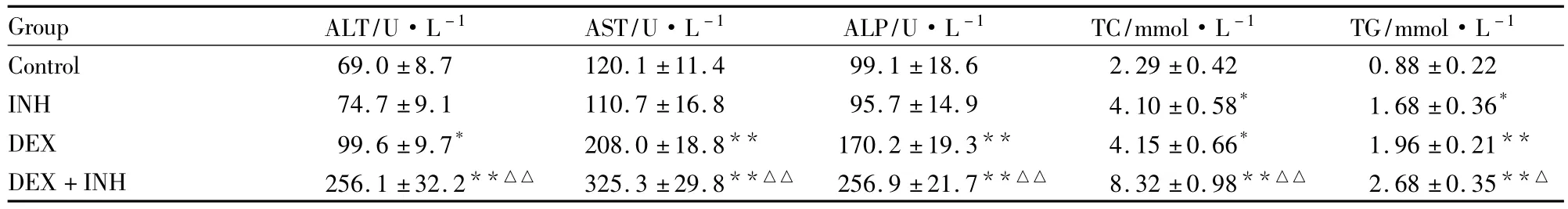
Tab 2 Effect of INH,DEX and INH-DEX treatment on serum ALT,AST,ALP,TC and TG level in rats(±s,n=5-6)
*P<0.05,**P<0.01 vs control group;△P<0.05,△△P<0.01 vs INH group
Group ALT/U·L-1 AST/U·L-1 ALP/U·L-1 TC/mmol·L-1 TG/mmol·L -1 Control 69.0 ±8.7 120.1 ±11.4 99.1 ±18.6 2.29 ±0.42 0.88 ±0.22 INH 74.7 ±9.1 110.7 ±16.8 95.7 ±14.9 4.10 ±0.58* 1.68 ±0.36*DEX 99.6 ±9.7* 208.0 ±18.8** 170.2 ±19.3** 4.15 ±0.66* 1.96 ±0.21**DEX+INH 256.1 ±32.2**△△ 325.3 ±29.8**△△ 256.9 ±21.7**△△ 8.32 ±0.98**△△ 2.68 ±0.35**△
综上所述,含 DEX 20 mg·kg-1的饲料和含1 000 mg·L-1INH的水喂养28 d后的大鼠能明显地出现肝损伤,其机制可能与DEX上调CYP3A活性或增加的脂质过氧化物有关。因而,选择性的CYP3A抑制剂柑桔素或抗氧化类的降脂药物如普罗布考或许对其有保护作用,但尚需进一步的体内实验证据支持,以带给临床上RIF-INH所致肝损伤结核患者直接的临床获益。
[1] Tostmann A,Boeree M J,Aarnoutse R E,et al.Antituberculosis drug-induced hepatotoxicity:concise up-to-date review[J].J Gastroenterol Hepatol,2008,23(2):192 -202.
[2] Senousy B E,Belal S I,Draganov P V.Hepatotoxic effects of therapies for tuberculosis [J].World J Gastroenterol,2010,7(10):543-56.
[3] Vignati L,Turlizzi E,Monaci S,et al.An in vitro approach to detect metabolite toxicity due to CYP3A4-dependent bioactivation of xenobiotics[J].Toxicology,2005,216(2 -3):154 -67.
[4] Yoshikawa Y,Hosomi H,Fukami T,et al.Establishment of knockdown of superoxide dismutase 2 and expression of CYP3A4 cell system to evaluate drug-induced cytotoxicity[J].Toxicol In Vitro,2009,23(6):1179-87.
[5] Shen C,Meng Q,Zhang G,Hu W.Rifampicin exacerbates isoniazid-induced toxicity in human but not in rat hepatocytes in tissuelike cultures[J].Br J Pharmacol,2008,153(4):784 -91.
[6] Lau A J,Yang G,Rajaraman G,et al.Species-dependent and receptor-selective action of bilobalide on the function of constitutive androstane receptor and pregnane X receptor[J].Drug Metab Dispos,2012,40(1):178 -86.
[7] Gedik E,Girgin S,Ozturk H,et al.Resveratrol attenuates oxidative stress and histological alterations induced by liver ischemia/reperfusion in rats[J].World J Gastroenterol,2008,14(46):7101-6.
[8] Yuan F,Chen J, Wu W J, et al. Effects of matrine and oxymatrine on catalytic activity of cytochrome p450s in rats[J].Basic Clin Pharmacol Toxicol,2010,107(5):906 -13.
[9] Lee S W,Chung L S,Huang H H,et al.NAT2 and CYP2E1 polymorphisms and susceptibility to first-line anti-tuberculosis drug-induced hepatitis[J].Int J Tuberc Lung Dis,2010,14(5):622-26.
[10] Richards V E,Chau B,White M R,et al.Hepatic gene expression and lipid homeostasis in C57BL/6 mice exposed to hydrazine or acetylhydrazine[J].Toxicol Sci,2004,82(1):318 -32.
[11]张志华,吴红海,薛 改,等.柑桔素抑制CYP450 3A4活性并减轻异烟肼和利福平合用的肝细胞毒性[J].中国药理学通报,2009,25(12):1619-22.
[11] Zhang Z H,Wu H H,Xue G,et al.Naringenin inhibits the upregulation of CYP 3A4 and attenuates the cellular toxicity induced by rifampicin and isoniazid in hepatocytes[J].Chin Pharmacol Bull,2009,25(12):1619 -22.
[12]赵莉萍,梅 俏,许建明,等.地塞米松对双氯芬酸钠肝损伤的保护作用[J].中国药理学通报,2011,27(2):270-4.
[12] Zhao L P,Mei Q,Xu J M,et al.Protective effects of dexamethasone on acute liver injury induced by diclofenac[J].Chin Pharmacol Bull,2011,27(2):270 -4.
[13] Zhou C,King N,Chen K Y,Breslow J L.Activation of PXR induces hypercholesterolemia in wild-type and accelerates atherosclerosis in apoE deficient mice[J].J Lipid Res,2009,50(10):2004-13.
[14] Cheng J,Krausz K W,Li F,et al.CYP2E1-dependent elevation of serum cholesterol,triglycerides,and hepatic bile acids by isoniazid[J].Toxicol Appl Pharmacol,2013,266(2):245 - 53.
[15] Pal R,Rana S V,Vaiphei K,Singh K.Isoniazid-rifampicin induced lipid changes in rats[J].Clin Chim Acta,2008,389(1 -2):55-60.
