生物吸附剂壳聚糖对刚果红的吸附
2013-02-19贾海红周洪英王学松
贾海红, 周洪英, 王学松
(淮海工学院 化学工程学院,江苏 连云港,222005)
壳聚糖是自然界中唯一带正电荷、阳离子的膳食纤维,被称为挽救人类健康的神奇“电粉”,具有抗菌性、保湿性、生物可降解性、无毒性以及极好的螯合能力[1]。壳聚糖不仅在食品、饲料及医药等行业领域有广泛应用,作为一种来源丰富的天然可再生资源,其分子结构中含有大量的自由氨基和羟基,同时,骨架链间的氢键形成了二级结构,这种结构上的特殊性以及高分子化合物的物理特性,使得壳聚糖对许多离子、有机物、生物分子等具有离子交换、螯合、吸附等作用[2]。因此,壳聚糖还可作为一类重要的生物吸附剂应用于环境保护领域。国内关于壳聚糖吸附富集染料的研究较少,国外学者做了较多的相关研究工作,但壳聚糖吸附富集刚果红的研究未见报道。作者尝试用壳聚糖吸附刚果红,研究酸度、温度、吸附时间及初始浓度等因素对吸附的影响,并对吸附的平衡和动力学特征进行讨论,旨在为印染废水的处理及工艺设计提供新的理论依据和生物吸附处理方法。
1 材料与方法
1.1 实验材料
壳聚糖:上海伯奥生物科技有限公司,脱乙酰度≥90.0%,粘度<100 cps;刚果红:简称 CR,分析纯;clark-lubs:简称C-L;缓冲溶液等。
SHA-C水浴恒温振荡器:江苏金坛市金城国胜实验仪器厂;UNICO 2000型分光光度计:尤尼克仪器有限公司;TDL-40台式离心机:上海安亭科学仪器厂;BS224S电子天平:北京赛多利斯仪器系统有限公司等。
对壳聚糖的微粒形态特征作了扫描电镜观察,见图1。从图中可以看出壳聚糖为不规则的颗粒状,表面不光滑,其上纵横分布着很多凹槽和坑洞。


图1 壳聚糖的扫描电镜图Fig.1 SEM photographs of chitosan
1.2 实验方法
采用分光光度法测定吸附质浓度;在pH 2.4~7的范围内,调整吸附质溶液的初始pH以确定吸附体系的最佳pH条件;在最佳pH和不同温度条件下定时移取吸附质溶液分析其质量浓度,考察吸附动力学特征;在不同温度和不同初始质量浓度条件下,考查温度对吸附平衡的影响。
2 结果与讨论
2.1 溶液pH值对吸附的影响
pH值是影响生物吸附的最重要的因素,不仅影响吸附剂的表面电荷、溶液中物质的电离程度及吸附剂活性位点官能团的解离,而且直接决定着染料在溶液中存在的形体结构[3-4]。pH值对CR吸附的影响见图2。

图2 pH值对壳聚糖吸附CR的影响Fig.2 Effect of pH on biosorption of CR
由图2可知,壳聚糖对CR的吸附容量随着pH值的升高而增加,至pH值4.0趋于稳定。这可能是因为当溶液的pH值较低时,吸附位点周围被大量的H+占据,阻碍了染料的靠近;另外,CR结构中的氨基在较低的pH值时质子化,与壳聚糖分子链上质子化的氨基和羟基产生静电斥力,随着pH值的增大,这种排斥力减小,从而导致吸附容量的增加;当pH值继续增加,壳聚糖与染料间的静电引力也随之减小,吸附容量趋于稳定。
2.2 吸附动力学
不同温度下MR在壳聚糖上的单位吸附量qt随时间t变化的过程见图3。由图3可知,在三种温度下,壳聚糖对CR的吸附量均随时间呈现上升趋势,并且在前10分钟吸附速度较快,83%以上的染料分子在接触的2 min之内完成吸附,接触10 min时,去除效率均达到80%左右,此后至60 min达到吸附平衡,吸附量增幅较为平缓。60 min的振荡时间足够完成吸附。
在相同的时间间隔内,壳聚糖对CR的吸附随温度升高吸附量略有下降,如在10、30、50℃条件下,2 min时壳聚糖对CR的吸附量分别为16.533、15.039、13.073 mg/g。
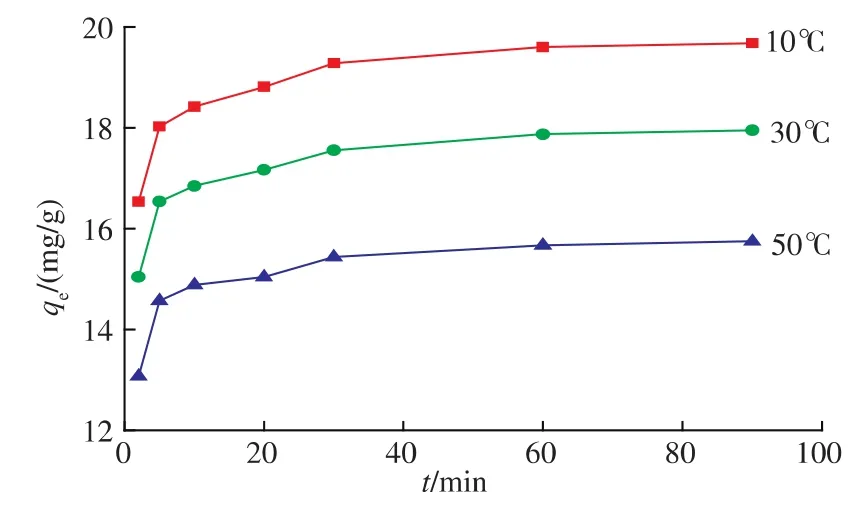
图3 不同温度下壳聚糖吸附CR的动力学Fig.3 Kinetics of CR biosorption at different temperatures
准二级动力学方程(Ho)常用于描述生物吸附过程的动力学数据,其线性形式为:

式中:k2为准二级动力学速率常数 [g/(mg·min)];k2qe2表示初始吸附速率[g/(mg·min)],利用 t/qt对 t作图可求得k2。图4为壳聚糖吸附CR的准二级动力学模型。
根据拟合数据可知,各直线相关系数R值均在0.999 9以上,这说明准二级动力学模型能够很好地拟合实验数据,由直线斜率和截距可求得10、30、50℃下准二级动力学速率常数k2分别为:0.075 01、0.082 95、0.097 42 g/(mg·min),平衡吸附量 qe分别为:19.80、18.05、15.85 mg/g,随温度升高,平衡吸附量逐渐减小。

图4 壳聚糖吸附CR的准二级动力学模型Fig.4 Pseudo-second order models of biosorption of CR
利用k2来计算该吸附过程的表观活化能。

式中:k2为准二级动力学速率常数;A0为指前因子,单位与 k2相同;Ea为活化能(kJ/mol);以 lnk2对1/T作图,应成一直线,由直线的斜率即可求得活化能 Ea=4.941 kJ/mol。
2.3 吸附平衡研究
常用来描述固-液系统等温吸附过程的吸附等温方程有Langmuir吸附等温方程和Freundlich吸附等温方程,其线性方程分别见式(3)、式(4)所示[5]。

式中:ce为吸附平衡时溶液质量浓度(mg/L);qm为最大吸附容量 (mg/g);qe为平衡时被吸附染料量(mg/g);b 为与吸附能力有关的常数(L/mg)。 这些参数可以由不同温度壳聚糖吸附染料的ce/qe对ce作图的斜率和截距得到。

式中:Kf表示吸附能力[6][(mg·g-1)(mg-1)1/n];n 为与温度有关的常数。它们的值通过以lnqe对lnce作图的斜率和截距得到。
壳聚糖对CR的吸附等温实验数据见表1。分析表明,壳聚糖对CR的吸附符合Freundlich方程,而与Langmuir方程存在偏差。Freundlich参数Kf值随温度的降低而增大,表明在低温条件下壳聚糖具有较高的吸附容量。
2.4 吸附热力学
吉布斯自由能变△Go是判断吸附过程能否自发进行的基本条件,在实验温度范围内吸附过程的热力学参数 △Go、焓变 △Ho以及熵变 △Go用公式(5~7)进行计算[7]:

式中 R 为摩尔气体常数 (J·mol-1·K-1);T 为绝对温度(K);焓变△Ho以及熵变△So由lnK-1/T曲线的斜率和截距求得。

表1 刚果红的等温吸附常数Table 1 Adsorption isotherm parameters of CR
吸附过程的平衡常数由拟合效果最好的Freundlich模型中的Kf确定。3个温度下的△Go及计算得到的焓变△Ho和熵变△So见表2。
由表2可知,△Go为负,保证了各温度下吸附过程的自发性。△Ho值为负说明壳聚糖对CR的吸附是一个放热过程,温度的升高不利于吸附过程的进行。

表2 壳聚糖吸附刚果红过程ΔGo、ΔHo和ΔSo的值Table 2 ΔGo、ΔHoand ΔSovalue for adsorption of CR on chitosan
2.5 吸附机理
为了进一步探讨壳聚糖吸附CR的吸附机理,对吸附前后的壳聚糖进行了红外光谱分析,见图5。
由图5可知,吸附了CR以后,3 400、1 424、1 030 cm-1附近的羟基的伸缩振动和弯曲振动峰均出现减弱,说明吸附剂上羟基数量减少。其中,1 424 cm-1附近的O-H面内弯曲振动吸收峰减弱后被1 380 cm-1附近为C-N伸缩振动峰覆盖,形成一个宽峰。3 400 cm-1和1 630 cm-1附近的氨基的伸缩振动和弯曲振动峰也出现减弱,说明吸附剂上氨基数量也下降。
另外,690 cm-1至890 cm-1附近的指纹区也发生了明显改变,这是因为壳聚糖吸附了CR以后引入了新的基团而产生的影响。
由此推测,壳聚糖分子中存在的大量羟基和氨基在吸附CR过程中发挥了主要作用。

图5 壳聚糖吸附刚果红前后的红外谱图Fig.5 FTIR of chitosan before and after biosorption of CR
3 结语
1)生物吸附剂壳聚糖吸附CR最佳pH值范围为 4~7。
2)不同温度下壳聚糖吸附CR反应动力学过程均很好地符合Lagergren准二级反应动力学模型,活化能 Ea=4.941 kJ/mol。
3)不同温度下壳聚糖对AF的吸附过程较好地符合Freundlich吸附等温方程。热力学研究表明,△Go为负保证了吸附过程的自发性。焓变△Ho为-87.36 kJ/mol,说明吸附是放热过程。
4)通过红外光谱分析得到,壳聚糖吸附CR的过程中,壳聚糖分子中存在的大量羟基和氨基发挥了主要作用。
[1]廖晓珊,钟晓红,孟娟,等.壳聚糖竹醋液复合膜抗菌活性及其应用[J].食品与生物技术学报,2010,29(3):395-400.LIAO Xiao-shan,ZHONG Xiao-hong,MENG Juan,et al.Antimicrobial properties and application of composite film from chitosan and bamboo vinegar[J].Journal of Food Science and Biotechnology,2010,29(3):395-400.(in Chinese)
[2]G Crini,P M Badot.Application of chitosan,a natural amino polysaccharide,for dye removal from aqueous solutions by adsorption processes using batch studies:A review of recent literature[J].Progress in Polymer Science,2008,33(4):399-447.
[3]T K Saha,S Karmaker,H Ichikawa.Mechanisms and kinetics of trisodium 2-hydroxy-1,1’-azonaphthalene-3,4’,6-trisulfonate adsorption onto chitosan[J].J Colloid Int Sci,2005,286:433-439.
[4]M S Chiou,P Y Ho,H Y Li.Adsorption of anionic dye in acid solutions using chemically cross-linked chitosan beads[J].Dyes Pigm,2004,60:69-84.
[5]Indra D Mall,Vimal C Srivastava,Nitin K Agarwal.Removal of orange-G and methyl violet dyes by adsorption onto bagasse fly ash-kinetic study and equilibrium isotherm analyses[J].Dyes and Pigments,2006,69(3):210-223.
[6]Aksu Z.Determination of the equilibrium,kinetic and thermodynamic parameters of the batch biosorption of nickel(II) ions onto Chlorella vulgaris[J].Process Biochem,2002,38(1):89-99.
[7]Kumar Y P,King P,Prasad V S R K.Zinc biosorption on Tectona grandis L f leaves biomass:equilibrium and kinetic studies[J].Chemical Engineering Journal,2006,124(1):1211-1217.
[8]张桂玲,谢宝东.大孔树脂吸附分离藿香蓟花蓝色素的研究[J].食品与生物技术学报,2011,30(6):852-856.ZHANG Gui-ling,XIE Bao-dong.The study on adsorption and separation of ageratum conyzoides blue pigment by macroporous resin[J].Journal of Food Science and Biotechnology,2011,30(6):852-856.(in Chinese)
