血红密孔菌Pycnoporus sanguineusSYBC-L12固态发酵水稻秸秆产漆酶及其对染料的脱色作用
2013-02-19蔡宇杰廖祥儒刘家扬袁小曼马德丽席艳茹
孙 啸, 蔡宇杰, 廖祥儒, 张 峰, 刘家扬, 袁小曼, 马德丽, 席艳茹
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
漆酶 (p-苯二醇:氧化还原酶,EC 1.10.3.2)是一种含铜的多酚氧化酶,为单电子氧化还原酶,具有特殊的催化性能和广泛的作用底物[1]。近年,漆酶作为绿色生物催化剂,在环境保护与修复方面倍受关注,尤其在纸浆生物漂白[2]、废纸脱墨[3]、土壤修复[4]、染料脱色[5-7]环境污染物质的去毒与降解[8]等方面显示出较大研究价值和应用潜力,成为环境保护用酶研究的热点。
漆酶广泛存在于多种植物、真菌体内,以及少数昆虫、细菌中。目前的研究报道主要集中于分泌漆酶能力较强的白腐真菌,如彩绒革盖菌 (Coriolus hisutus),变色栓菌 (Trametes versicolor),糙皮侧耳(Pleurotus ostreatus)等。漆酶在自然界分布广泛,但真正在自然条件下生长具有较强木质素降解能力和较高漆酶生产的菌株并不多,因此筛选漆酶高产菌株具有重要现实意义。
近年来,漆酶的发酵逐渐趋向于廉价易得的工农业副产物或废弃物,如用栗子壳,用大麦麸[9],用椰肉[10],用葡萄籽[11]作为固态支撑物和底物对漆酶进行发酵生产均被国外学者报道过。可见利用一些来源广泛、廉价的基质发酵漆酶具有较大的研究价值。
水稻秸秆作为重要的农业废弃物每年在全世界范围内的产量相当可观。传统的处理方法是掩埋和焚烧,不仅浪费生物质的潜在应用价值,而且对环境大气造成污染。用水稻秸秆进行固态发酵产漆酶不仅模拟了白腐菌生长的自然条件,使其更易生长,而且相对于液态发酵具有耗能少、污染小、操作方便等优点,发酵处理后的水稻秸秆由于其木质素部分被降解以及附加营养物质亦可用做造纸原料、燃料乙醇的生产原料和动物饲料等。因此,作者考虑应用水稻秸秆进行漆酶固态发酵,不仅可以对水稻秸秆进行综合利用,而且还可以带来更高的经济价值。
合成染料由于其具有制造成本低、使用方便、颜色多样性及稳定不易被分解而被广泛应用于纺织、造纸、服装、医药以及食品工业等,其种类多达10 000多种,并且全世界每年可生产70万吨的合成染料[12]。在合成染料的使用过程中,多达15%未被充分使用而随着污水排放出来。这些合成染料根据其化学成分多分为蒽醌类、偶氮类、杂环类、三苯甲烷类、酞菁类[13],对环境具有严重的污染,同时具有毒性、诱变和致癌的作用,严重威胁人类健康、动植物生长。传统处理合成染料废水的方法多为凝固、絮凝、吸附、膜过滤、光照射法等,尽管效率较高,但处理成本高昂,且处理后的固型废弃物还要进行后处理,比如填埋。而漆酶作为一种天然的氧化还原催化剂,可将部分合成染料降解成小分子或合成更大分子的化合物,从而消除或降低其毒性和污染程度。
作者从江苏无锡惠山的朽木上筛选出一株具有较好漆酶分泌能力的菌株——Pycnoporus sanguineus SYBC-L12,并对该菌株进行了18S rRNA基因序列分析,同时初步研究了其利用水稻秸秆固态发酵产漆酶的条件,以及对合成染料的降解作用,以期为今后的研究和工业应用提供一定的理论依据。
1 材料与方法
1.1 菌种
菌株Pycnoporus sanguineus SYBC-L12,由本实验室筛选自江苏无锡惠山,并于4℃保藏。
1.2 主要材料及试剂
水稻秸秆取自无锡市郊,烘干后切碎;豆粕、玉米浆、麸皮、花生饼粉、餐厨粉为市售;2,6-二甲氧基酚 (DMP,2,6-Dimethoxyphenol)、愈创木酚、染料Remazol Brilliant Blue R、Acid Blue 129、Reactive Blue 4、Methyl Blue、Toluidine Blue、Acid Red 1、Ractive Black 5,均购自Sigma公司;其它试剂均为国产分析纯。
1.3 培养基
1.3.1 显色培养基 PDA琼脂培养基,添加愈创木酚,终浓度为0.5 mmol/L。
1.3.2 种子培养基 PDA液体培养基。
1.3.3 固态发酵基础培养基 水稻秸秆 (粒度10~15 mm)25 g/dL,含水量 75%,pH 自然。
1.4 菌株生长特性研究
菌株SYBC-L12点接于PDA显色培养基平板,30℃恒温培养,观察菌落形态。
菌株SYBC-L12接种到固态发酵基础培养基中,30℃恒温培养,观察菌体生长状态。
1.5 菌株分子生物学鉴定
1.5.1 18S rRNA序列测定 参照 Lomascolo等的酚-氯仿法提取SYBC-L12基因组总RNA。以基因组RNA为模板 ,利用真菌通用引物来扩增 18S r RNA。扩增程序:首先 94℃预变性 2 min,94℃ 变性 1 min;54 ℃ 退火 45 s,72 ℃延伸 115 min,34个循环;最后 72℃充分延伸 10 min。序列测定由上海生工完成。
1.5.2 18S rRNA基因进化树的构建 通过BLAST(http://www.ncbi.n.m.nih.gov/BLAST)对菌株的 18S r RNA基因序列进行同源分析。多序列比对采用ClustalW 1183,用BioEdit 7.01进行序列调整。利用Mega3.1软件采用邻位相连法(neighbor-joining,NJ)构建进化树,进行1 000次bootstrap检验。
1.6 漆酶酶活的测定
反应体系3 mL,包括0.5 mL DMP、2.4 mL磷酸-柠檬酸缓冲溶液 (20 mmol/L,pH=3)0.1 mL 酶液,在470 nm处测定OD吸收值。以1 min氧化1 μmol的 DMP 生成 3,5,3’,5’2 四甲氧基二苯醌(ε470mm=49.6 L/(mmol·cm)) 所需要的酶量定义为 1个酶活力单位 (U)。
1.7 水稻秸秆固态发酵产漆酶条件的优化
1.7.1 水稻秸秆固态发酵产漆酶曲线的测定及所得漆酶的最适温度和pH 从实验室筛选出一株利用水稻秸秆产漆酶活性相对较高的白腐菌Pycnoporus sanguineus SYBC-L12,在固态发酵基础培养基中培养22 d,测定其发酵产酶曲线。将所得酶液在不同的反应温度(30~90 ℃)和反应 pH(2~7)下测定其酶活力。
1.7.2 种龄及培养温度对Pycnoporus sanguineus SYBC-L12产漆酶的影响 在培养7 d的菌落平板上挑5片菌落(直径0.8 cm)于50 mL的种子培养基中,30 ℃,200 r/min,分别培养 1~5 d,接入固态发酵培养基中,其它条件不变,培养一定时间,测定漆酶活力。 将培养箱温度分别调整为 23、27、30、35、37℃,其它条件不变,培养一定时间,测定漆酶活力。
1.7.3 秸秆粒度和起始含水量对Pycnoporus sanguineus SYBC-L12产漆酶的影响 将秸秆分别粉碎成粒度为 (mm)0~5、5~10、10~15、15~20、20~25,其它条件不变,培养一定时间,测定漆酶活力。固态培养基的含水量分别调整为料水比 1∶1、1∶2、1∶3、1∶4、1∶5,其它条件不变,培养一定时间,测定漆酶活力。
1.7.4 碳源及氮源的种类及添加量对Pycnoporus sanguineus SYBC-L12产漆酶的影响 在固态发酵培养基中分别用不同的碳源 (葡萄糖、柠檬酸、蔗糖、麦芽糖、淀粉、果糖、乳糖),初始添加量为20 g/L,及氮源(豆粕,玉米浆,麸皮,花生饼粉,餐厨粉,酵母膏,蛋白胨,牛肉膏,干酪素,尿素,硫酸铵,磷酸二氢铵,酒石酸铵,硝酸钠,硝酸铵,乙酸铵),初始添加量为15 g/L,以及对照(不加碳氮源),其它条件不变,30℃下静置培养一定时间,测定漆酶活力。对其中能使酶活力或产量显著提高的因素在其对应的不同的添加量下进行优化,选择最适添加量。
1.7.5 铜离子浓度及添加时间对Pycnoporus sanguineus SYBC-L12产漆酶的影响 铜离子对白腐菌产漆酶具有较强的诱导作用,不同的浓度及不同的添加时间均对其影响不同。本实验在固态发酵培养基中分别添加不同浓度的CuSO4·5H2O (0~5.0 mmol/L水溶液)以及分别在发酵培养的第1、4天加入CuSO4·5H2O水溶液,30℃静置培养一定时间,测定漆酶活力。
1.8 粗酶液的制备
将发酵后的酶曲加入去离子水,搅拌将其打散,在30℃,200 r/min条件下摇床振荡6 h,将混合物用真空泵抽滤后用冷冻离心机以转速10 000 r/min离心10 min,得到的上清液即为粗酶液,测定漆酶活力,进行后续工作。
1.9 漆酶对合成染料的脱色降解作用
1.9.1 合成染料脱色率的计算 使用Mapada TM UV-1600型可见光分光光度计,通过记录一定时间内染料在最大吸收波长处的OD值变化,根据公式计算:脱色率=((A0-A)/A0)×100%,式中,A0为染料的初始吸收OD值,A为染料的终止吸收OD值。
1.9.2 漆酶常温下和60℃下对蒽醌、偶氮、三苯甲烷、亚胺醌类染料的脱色作用 选取蒽醌类染料AB129(200 mg/L)、RBBR(150 mg/L)、RB4(200 mg/L),偶氮类染料 AR1(20 mg/L)、RB5(50 mg/L),三苯甲烷类染料MB(20 mg/L),亚胺醌类染料TB(10 mg/L)。反应体系为3 mL,包括0.5 mL粗酶液、1.0 mL合成染料,1.5 mL的20 mmol/L pH 3的磷酸-柠檬酸缓冲液。在常温下反应24 h,分时间段进行最大吸收波长下的OD值测量,根据公式计算得出脱色率。将反应体系置于60℃水浴锅,重复以上步骤得出60℃下漆酶对染料的脱色作用。将染料AB129、RBBR、RB4、MB 和 TB 按一定比例混合,在3 mL体系下进行酶的脱色作用,反应120 min,定时全波长扫描。
1.9.3 金属离子对漆酶降解染料的作用 在实验室选取工业染料废水中常见金属离子Zn2+、Cu2+、Fe3+、Ca2+、Mn2+、Pb2+、Ba2+、Al3+和 Co2+, 分别配制成浓度为10 mmol/L的盐溶液。同样在以上5种染料脱色反应体系中加入等体积的盐溶液和对照(不加)。常温下反应30 min,记录其OD值。
2 结果与讨论
2.1 SYBC-L12生长特性的研究
将选用的白腐菌SYBC-L12接种到愈创木酚平板,结果如图1(a)所示,SYBC-L12菌丝为洁白绒毛状,菌落四周及底部均有红色变色圈产生,表明漆酶氧化特征底物,产生显色的氧化反应,从而可以初步判断其在生长过程中分泌了胞外漆酶。
对SYBC-L12进行固态发酵,发酵10 d,结果如图1(b)所示,固态培养基上长满了SYBC-L12菌丝,表明此菌株对秸秆具有良好的适应性。
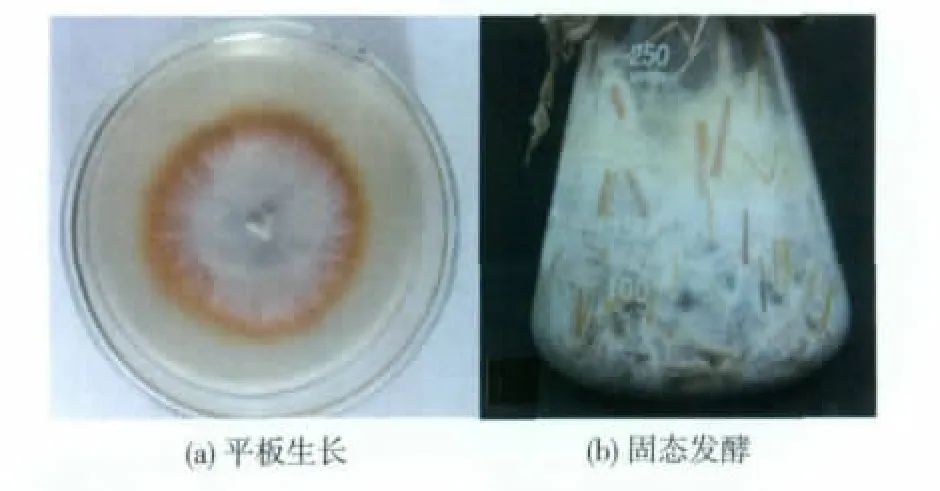
图1 SYBC-L12平板生长特征和固态发酵生长特征Fig.1 Morphological character of SYBC-L12 on PDA plateandundersolid-statefermentationofricestraw
2.2 SYBC-L12的18S rRNA进化树分析
经扩增,得全长为639 bp的18S rRNA序列,提交GenBank,其登录号为HQ891296。根据BLAST结果,取相似度较高的序列构建N-J树,如图2所示。 通过N-J树分析发现,SYBC-L12与Pycnoporus sanguineus FCL229(JF308952)同源性较高,为99%,说明与其亲缘关系比较接近,二者可以聚为一枝。此外,该枝与Pycnoporus sp.aff4(EU863192.2)的相似度为99%,三者均属于密孔菌属 (genus Pycnoporus)。 该 菌 定 名 为 Pycnoporus sanguineus SYBC-L12,属于担子菌亚门,多孔菌科,密孔菌属。
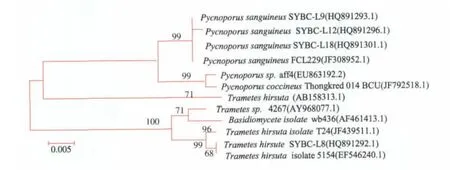
图2 Pycnoporus sanguineus SYBC-L12 N-J树图Fig.2 N-J Evolution tree of Pycnoporus sanguineus SYBC-L12
2.3 水稻秸秆固态发酵产漆酶条件优化
2.3.1 Pycnoporus sanguineus SYBC-L12的产酶曲线及酶的最适温度和pH 采用水稻秸秆固态发酵基本培养基,30℃恒温静置培养,测定漆酶产量随时间的变化趋势。如图3(a)所示,随着培养时间的延长,漆酶产量不断上升,第6天以后基本达到稳定,第8天最高,20 d后有所下降。从图中看出,第8天和第16天的酶活相对较高,这两个相对较高的点很可能是漆酶的两个同工酶,它们在形成的时间上存在较大差异。作者选取8 d作为Pycnoporus sanguineus SYBC-L12的固态发酵周期,这样可以缩短时间同时获得较高的漆酶产量,这个发酵周期与相关文献[14-16]所报道的漆酶发酵周期相比,所用时间较短。
通过对漆酶催化条件的研究,得出漆酶催化的最适温度为60℃,且在60~80℃其催化能力较稳定,因此属于偏高温酶,在较高温条件下具有较好的催化能力。漆酶催化的最适pH为3,而且当反应体系pH接近中性时,其催化能力大幅下降,pH为7时降为最适的10%,因此,此漆酶在酸性条件下具有较好的催化能力。 见图 3(b),(c)。
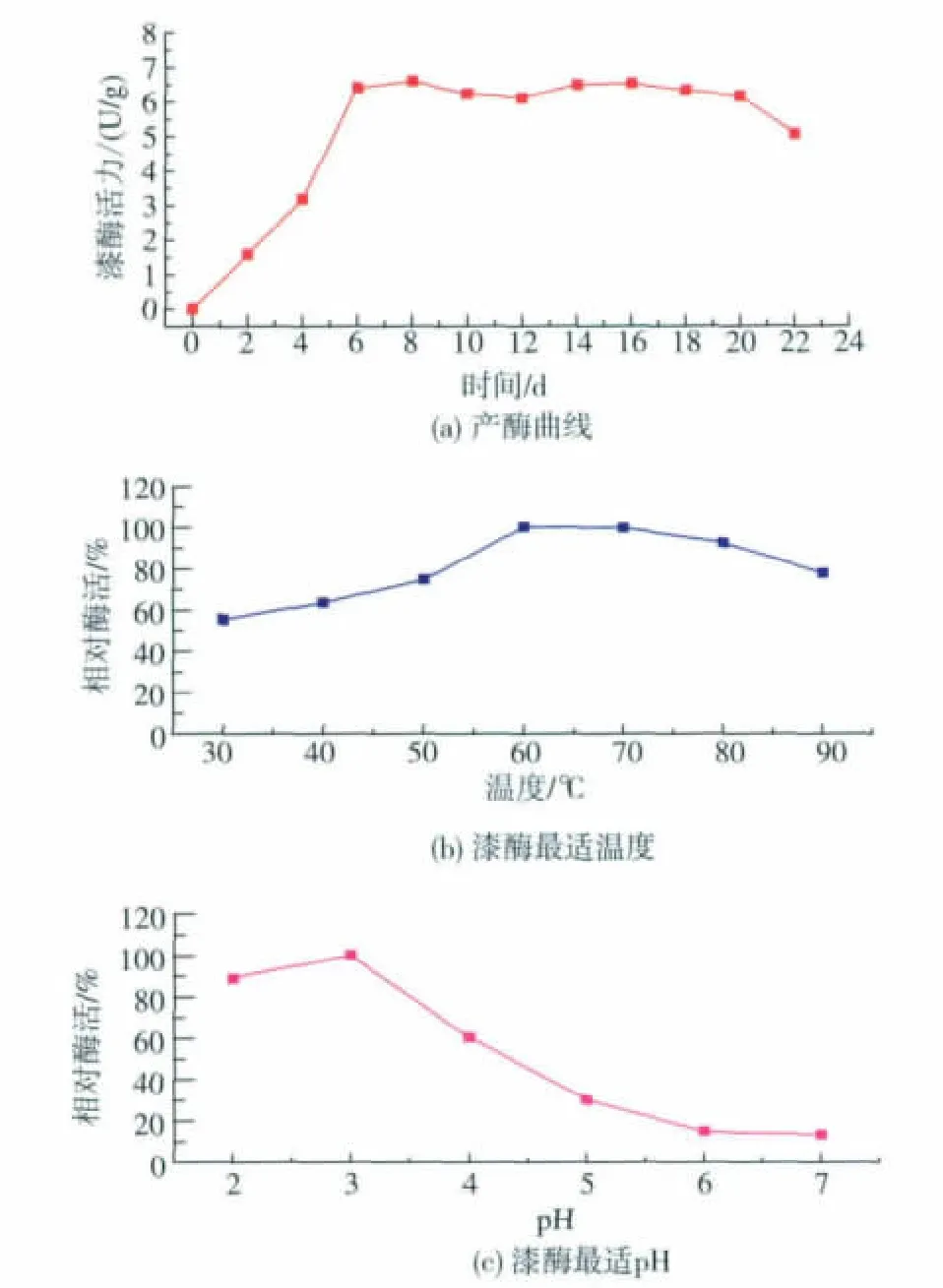
图3 Pycnoporus sanguineus SYBC-L12发酵产漆酶曲线及漆酶催化最适温度和pHFig.3 Curveoflaccaseproduction by Pycnoporus sanguineus SYBC-L12 under fermentation and the best suitable temperature and pH for laccase catalysis
2.3.2 种龄及培养温度对Pycnoporus sanguineus SYBC-L12产漆酶的影响 接种到固态发酵培养基中的种子液的生长状态对固态发酵影响较大。一般认为处于对数生长期菌龄的种子具有较快的生长速度,利于菌种在固态培养基上生长产酶。因此对不同生长期的种子进行接种,如图4(a)所示,生长2 d的菌种能有效的提高产酶。
白腐菌因种类不同,生长温度对白腐菌产漆酶也具有一定的影响。因此调整温度(23、25、30、35、37℃)找到其最适温度。结果如图4(b)所示,30℃为Pycnoporus sanguineus SYBC-L12的最适产酶温度,而且30℃和35℃对酶活没有大的改变。
2.3.3 秸秆粒度和起始含水量对Pycnoporus sanguineus SYBC-L12产漆酶的影响 秸秆粒度在固态发酵过程中对菌体的影响较大,在培养基量相同的情况下,秸秆粒度的大小直接决定了白腐菌能有效利用的秸秆表面积的大小。粒度越小,表面积越大,但同时秸秆之间的空隙变小,影响培养基的透气性。如图4(c)所示,秸秆粒度在5~10 mm之间漆酶产量最高。固态发酵过程中需要适宜的水分含量,但是含水量过高或过低都不能满足菌体的生长代谢。如图4(d)所示,漆酶的产量随培养基含水量的增加而提高,当含水量达到50%时,漆酶活力达到最大,进一步增加含水量,产酶反而下降。
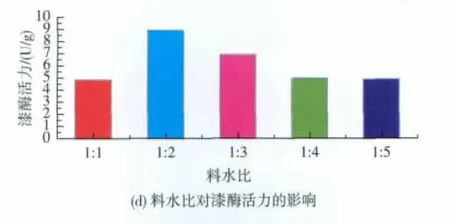
图4 物理条件对漆酶活力的影响Fig.4 Effects of physical conditions on laccase activity
2.3.4 碳源、氮源对Pycnoporus sanguineus SYBCL12产漆酶的影响 对于产酶培养基,碳源和氮源为必不可少的组成部分。本研究中,秸秆作为支撑物同时也作为提供少量碳源的底物,在此基础上添加其它碳源和氮源,考察其对漆酶产量的影响。此外,对廉价的工农业副产品对漆酶生产的影响也进行了考察。从图5(a)中看出,除乳糖可以少量提高漆酶的产量,额外添加的其它碳源在短时间内基本不会增加漆酶的产量,因此表明碳源不是促进白腐菌漆酶合成的主要因素。工农业副产品因其成分复杂、营养丰富,在作为产漆酶的培养基上具有优越的应用前景。因其氮源丰富,将其和有机氮源、无机氮源一并对白腐菌P.sanguineus SYBC-L12进行研究。 从图 5(b)、(c)、(d)中可以看出,工农业副产品对漆酶的产量均有显著提高,豆粕使其提高了70.8%,水稻麸皮提高了60.8%,玉米浆提高了90.2%,花生饼粉提高了150.6%、餐厨垃圾提高了65.4%。有机氮源和无机氮源除了尿素和乙酸铵对漆酶的合成具有完全抑制作用外,对漆酶的产量也均有促进提高,其中有机氮源蛋白胨提高了128%,干酪素提高了297%,酵母膏提高了108%,牛肉膏提高了109.8%,无机氮源酒石酸铵提高了77.8%,磷酸二氢铵提高了56.6%,硫酸铵提高了55.4%,硝酸铵提高了210.6%,硝酸钠提高了10.6%。从而可得出,氮源是促进漆酶合成的主要因素,且对漆酶产量影响较大的依次是干酪素、硝酸铵和花生饼粉。
对干酪素、硝酸铵和花生饼粉的添加量进行优化。 其添加量的选择为(g/L):干酪素 5~40,硝酸铵5~35,花生饼粉 5~75。 所得结果分别如表 1、2、3 所示。表1所示,干酪素的最适添加量为25 g/L,其酶活较原添加量提高了12.08%;表2所示,硝酸铵的最适添加量为25 g/L,其酶活较原添加量提高了45.37%;表3所示,花生饼粉的最适添加量为45 g/L,其酶活较原添加量提高了35.7%。

图5 碳源,农业废弃物,无机氮源和有机氮源对P.sanguineus SYBC-L12漆酶活力的影响Fig.5 Impacts of carbon sources,agro residues,inorganic nitrogen sources and organic nitrogen sources on laccase activity of P.sanguineus SYBC-L12

表1 干酪素添加量对产漆酶的影响Table 1 Effects of carbon sources on laccase activity

表2 硝酸铵的添加量对漆酶活力的影响Table 2 Effect of ammonium nitrate content on laccase activity
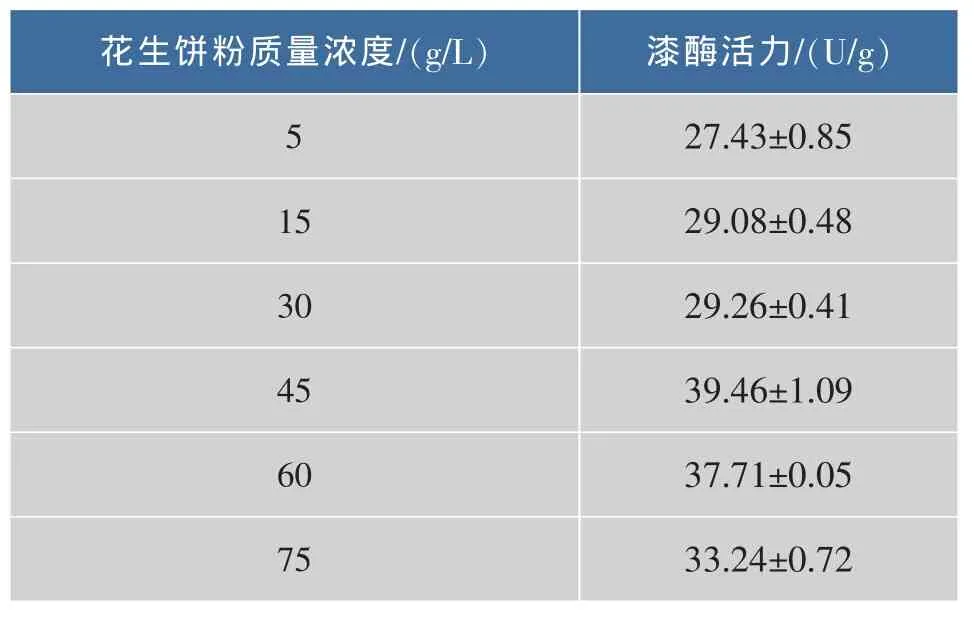
表3 花生饼粉的添加量对漆酶活力的影响Table 3 Effect of peanut cake powder content on laccase activity
2.3.5 铜离子浓度及添加时间对Pycnoporus sanguineus SYBC-L12产漆酶的影响 铜离子是构成漆酶活性中心的必要成分,因此为了提高漆酶的产量,添加一定量的铜离子对漆酶的分泌具有一定的刺激作用。由于铜离子有可能会对白腐菌的生长产生抑制作用,导致漆酶的产量减少,因此对不同时间添加硫酸铜和添加硫酸铜的量进行研究。由其产酶曲线得出,第4天开始出现漆酶分泌的对数期,因此选取第1天和第4天分别添加铜离子。得出结果如图6所示,第1天添加硫酸铜的产酶最大值出现在铜离子浓度为4 mmol/L的情况下,此时的漆酶产量比未添加铜离子的提高了26.3%。而第4天添加硫酸铜的产酶最大值为浓度2 mmol/L时,此时的漆酶产量比未添加铜离子的提高了36.8%。因此在发酵第4天添加2 mmol/L的铜离子浓度可有效地提高漆酶产量。
经过一系列优化得到漆酶的终产量约是优化前的10倍。
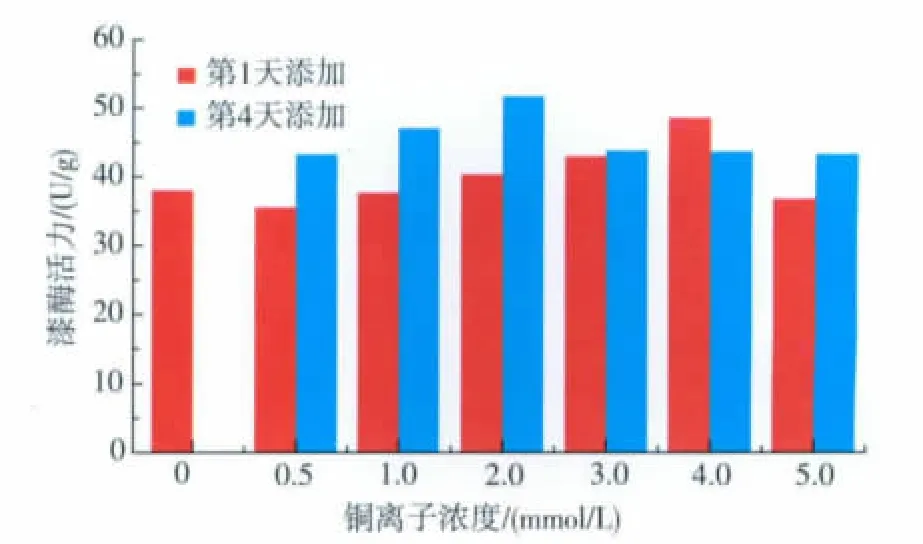
图6 Cu2+量及添加时间对漆酶酶活力的影响Fig.6 Effects of Cu2+content and its adding time on laccase activity
2.4 漆酶对合成染料的脱色降解作用
漆酶属于多酚氧化酶,其活性中心通过一系列的电子传递将底物氧化成不稳定的中间体,从而自行分解成更小的分子或聚合形成更大的分子,同时将水中的O2还原成H2O。其底物多为酚类、芳香类、多环类化合物及其衍生物。实验中所用的合成染料(Remazol Brilliant Blue R,Acid Blue 129,Reactive Blue 4,Methyl Blue,Toluidine Blue,Acid Red 1,Ractive Black 5)都具有复杂的多环结构,且在工业中应用广泛,同时也是工业废水中的常见污染物。用漆酶对其进行降解具有诱人的应用前景。实验利用秸秆固态发酵所得的漆酶分别在常温和60℃下,对其进行了脱色降解。
2.4.1 漆酶对染料的脱色降解作用 利用漆酶在常温下对蒽醌、偶氮、三苯甲烷、亚胺醌类染料进行脱色,如图 7(a)所示,在180 min内可将 AB129脱去 83.6%、RBBR脱去72.2%、RB4脱去77.7%,在6 h内可将MB脱去79.4%、TB脱去57.9%。而对偶氮类染料RB5和AR1,在24 h内只能将其分别脱去12.6%和8.9%。在60℃下对其进行脱色试验时,如图7(b)所示,在360 min内可将AB129脱去83.2%、RBBR脱去 67%、RB4脱去 71%、MB脱去79.5%、TB脱去51.2%,同时在24 h内可将常温下不易脱色的偶氮染料RB5和AR1分别脱去43.1%和28.2%。因此可得此漆酶对蒽醌、三苯甲烷和亚胺醌类的染料具有高效的脱色作用且在常温下就可进行;而对偶氮类染料常温下脱色较困难,当温度适当升高时,可部分脱色。
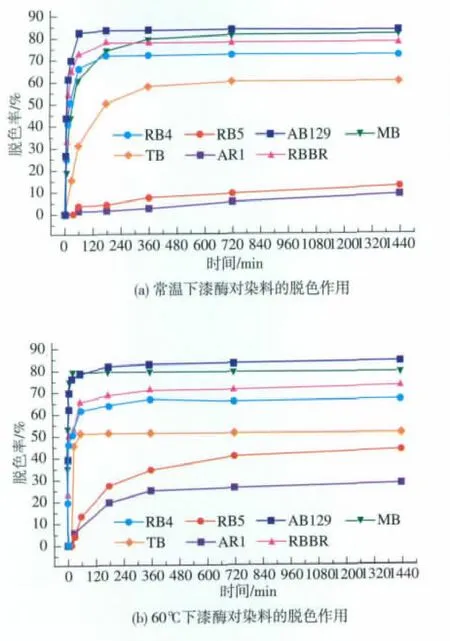
图7 漆酶对合成染料的脱色降解作用Fig.7 Laccase-catalyzed decolorization of synthetic dyes
2.4.2 漆酶对混合染料的脱色降解作用 一种工业废水中一般含多种染料,因此将蒽醌、三苯甲烷和亚胺醌类染料混合,考察漆酶对其的脱色作用。混合染料的每个成分配制为适当的浓度使其总的吸光值OD不超过1.0,如图8(a)。在常温下加入酶液进行反应,通过定时全波长扫描得出结果如图8(b)所示,在120 min内,其总吸收峰逐渐降低。可观察到在120 min内,所有的染料可以大部分被降解。因此,能被漆酶脱色降解的不同结构的染料同时存在时均可被漆酶脱色降解。

图8 漆酶对混合染料的脱色作用Fig.8 Laccase-catalyzed decolorization of the mixed dyes
2.4.3 金属离子对漆酶催化染料降解的作用 因工业染料废水中经常存在各种金属离子,且大多数属于重金属离子,对生物酶等具有蛋白质结构的生物大分子具有抑制作用。重金属离子一般会通过化学反应或交联反应不可逆地改变酶的活性中心结构,从而导致酶的活性降低甚至失去活性。因此要使漆酶可以有效应用于工业废水中染料的脱色降解,金属离子对其因没有抑制作用,否则漆酶无法直接使用。本实验选取废水中常见的金属离子Zn2+、Cu2+、Fe3+、Ca2+、Mn2+、Pb2+、Ba2+、Al3+和 Co2+,考察其对漆酶催化的染料脱色的影响。染料选取较易被漆酶脱色的AB129,所得结果如表4所示,相对于没有金属离子而言,Ca2+对其脱色的抑制作用较强,30 min 内脱色率减少了 42.5%, 此外 Fe3+、Mn2+、Ba2+、Co2+对其具有较弱的抑制作用,其余的Zn2+、Cu2+、Pb2+、Al3+几乎没有抑制作用。
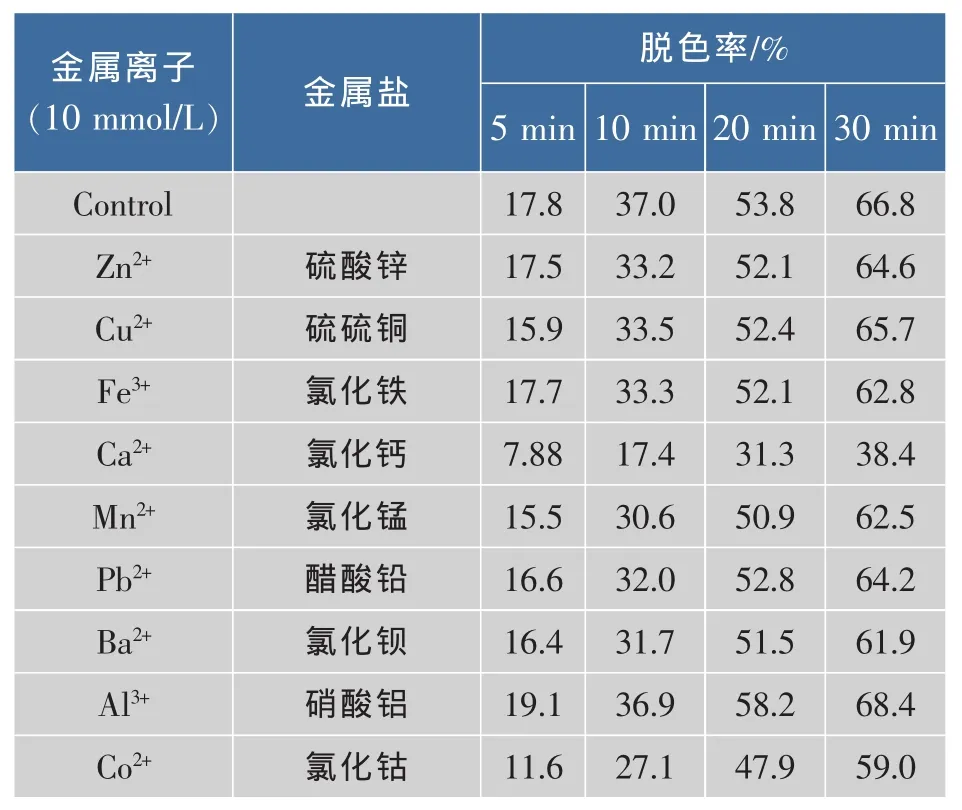
表4 金属离子对AB129脱色的影响Table 4 Effects of metal ions on the laccase-catalyzed decolorization of AB129
3 结语
环境污染的生物治理已经成为人类治理环境的主要手段和发展趋势。利用自然界所产生的生物大分子对环境的治理有着诱人的前景。
本实验通过在自然界筛选的白腐真菌,利用农作物水稻秸秆固态发酵产漆酶,并对其条件进行优化,所得漆酶对蒽醌、偶氮、三苯甲烷、亚胺醌类稳定不易分解,但对环境和生物有害的染料进行脱色降解效果良好。一些工业废水常见的金属离子对脱色没有影响或有微弱的抑制作用。
本研究旨在对之后的研究和应用奠定必要的理论基础和作可行性探讨。
[1]王志新,蔡宇杰,李颜颜,等.培养基及培养条件对Pycnoporus sp.SYBC-L1分泌漆酶的影响[J].食品与生物技术学报,2009,28:832-839.WANG Zhi-xin,CAI Yu-jie,LI Yan-yan,et al.Effect of fermentation medium and conditions on laccase production by Pycnoporus sp.SYBC-L1[J].Journal of Food Science and Biotechnology,2009,28:832-839.(in Chinese)
[2]王燕蓬,秦梦华,徐清华.浅谈漆酶在制浆造纸中的应用研究[J].造纸化学品,2008,20:20-23.WANG Yan-peng,QIN Meng-hua,XU Qing-hua.Application of laccase in pulp and paper industry[J].Paper Chemicals,2008,20:20-23.(in Chinese)
[3]王燕蓬,徐清华,苗庆显,等.漆酶用于废纸脱墨的研究[J].造纸科学与技术,2008,27:13-16.WANG Yan-peng,XU Qing-hua,MIAO Qing-xian,et al.Application of laccase in waste paper deinking[J].Paper Science and Technology,2008,27:13-16.(in Chinese)
[4]赵月春,付 蓉,莫测辉,等.漆酶不同施用方法对土壤 DDT污染修复的研究[J].农业工程学报,2008,24(2):107-110.ZHAO Yue-chun,FU Rong,MO Ce-hui,et al.Remediation of DDT contaminated soil by using laccase in different application ways[J].Transactions of the CSAE,2008,24:107-110.(in Chinese)
[5]姬广磊.漆酶在染料脱色和疏水性芳香化合物降解转化中的应用研究[D].济南:山东大学,2009.
[6]ZENG Xiang-kang,CAI Ju-jie,LIAO Xiang-ru,et al.Decolorization of synthetic dyes by crude laccase from a newly isolated Trametes trogii strain cultivated on solid agro-industrial residue[J].Journal of Hazardous Materials,2011,187:517-525.
[7]ZENG Xiang-kang,CAI Ju-jie,LIAO Xiang-ru,et al.Anthraquinone dye assisted the decolorization of azo dyes by a novel Trametes trogii laccase[J].Process Biochemistry,2012,47:160-163.
[8]Rim K,Lassad B,Steve W,et al.Decolorization and detoxification of textile industry wastewater by the laccase-mediator system[J].Journal of Hazardous Materials,2011,175:802-808.
[9]José G,Marta P,Susana R,et al.Chestnut shell and barley bran as potential substrates for laccase production by Coriolopsis rigida under solid-state conditions[J].Journal of Food Engineering,2005,68:315-319.
[10]Susana R,Angeles M.Coconut flesh:a novel raw material for laccase production by Trametes hirsuta under solid-state conditions:Application to lissamine green B decolourization[J].Journal of Food Engineering,2005,71:208-213.
[11]Susana R,Elena L,Angeles M.Utilisation of grape seeds for laccase production in solid-state fermentors[J].Journal of Food Engineering,2006(74):263-267.
[12]Diorio L A,Mercuri A A,Nahabedian D E,et al.Development of a bioreactor system for the decolorization of dyes by Coriolus versicolor f.antarcticus[J].Chemosphere,2008(72):150-156.
[13]Koichi H,Kazunori N.Decolorization of mixtures of dierent reactive textile dyes by the white-rot basidiomycete phanerochaete sordida and inhibitory eect of polyvinyl alcohol[J].Chemosphere,2005(59):63-68.
[14]Téllez-Téllez M,Fernández F J,Montiel-González A M,et al.Growth and laccase production by Pleurotus ostreatus in submerged and solid-state fermentation[J].Appl Microbiol Biotechnol,2008(81):675-679.
[15]Galhaup C,Wagner H,Hinterstoisser B,et al.Increased production of laccase by the wood-degrading basidiomycete Trametes pubescens[J].Enzyme and Microbial Technology,2002,30:529-536.
[16]Arora D S,Gill P K.Laccase production by some white rot fungi under different nutritional conditions[J].Bioresource Technology,2000,73:283-285.
