食用鼠曲草黄酮的提取及体外抗氧化性研究
2013-02-19石青浩姜子涛
石青浩, 李 荣, 姜子涛
(天津商业大学 生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
鼠曲草(Gnaphlium affine)俗称清明菜、追骨风、佛耳草,为菊科植物鼠曲草的全草,主要分布于我国华东、华中、华南、西南、西北、华北及台湾,以野生为主,可药用也可食用。全草含钙、钾、镁等微量元素,还含有氨基酸、黄酮类化合物、挥发油、豆甾醇、生物碱等[1-4]。具有降血脂、降血糖、降血压、抗衰老、消炎抑菌、增强免疫力等多种功效[5]。
文中探讨了微波提取鼠曲草黄酮的条件,并对微波提取的鼠曲草黄酮与抗氧化剂VC进行了体外抗氧化性能和清除自由基性能的比较研究,为鼠曲草资源在食品、保健品等领域的进一步开发利用奠定了理论基础。
1 材料与方法
1.1 材料与试剂
鼠曲草,安徽诚信药家有限公司提供;S-8大孔吸附树脂,购于南开大学化工厂;水(娃哈哈饮用纯净水),杭州娃哈哈集团有限公司出品;芦丁标准品(分析纯),北京化学试剂公司产品;DPPH:美国Sigma公司产品;抗坏血酸(VC)、结晶紫、磷酸钠、钼酸铵等均为分析纯,所用水为除氧蒸馏水。其余试剂均为分析纯。
1.2 主要仪器
MAS-Ⅰ型微波快速制样系统,上海新仪微波化学科技有限公司制造;U-3900 UV-Vis紫外可见分光光度计,日本日立公司制造;LGJ-10型冷冻干燥机,北京松源华兴科技发展有限公司制造;KQ2200B型超声波清洗器,昆山市超声仪器有限公司制造;FA1104N型电子天平,上海精密仪器有限公司制造;RE 52-86A型旋转蒸发仪,上海亚荣生化仪器厂制造;80-1型离心机,上海手术器械厂制造;电热恒温水浴锅,北京市长风仪器仪表公司制造;970CRT荧光分光光度计,上海精密科学仪器有限公司制造;LRH-150S恒温恒湿培养箱,广东省医疗器械厂制造。
2 试验方法
2.1 鼠曲草总黄酮的微波提取工艺
称取2.0 g鼠曲草粉末,固定微波功率500 W,以体积分数60%乙醇溶液为溶剂,放入微波玻璃反应器中,按 1∶60(g/mL)的料液比在 60℃下萃取 5 min,待提取液稍冷后进行过滤,滤液经石油醚萃取,去掉石油醚层,得鼠曲草黄酮的提取液,再经旋蒸后冷冻干燥,得到鼠曲草黄酮粉末。
试验以黄酮得率为指标,通过单因素试验来确定在固定微波功率为500 W下的乙醇体积分数、料液比、提取时间和温度等因素的试验范围,以得到微波辅助提取鼠曲草黄酮的最佳工艺参数。
2.2 黄酮含量的测定
首先以芦丁为标准品,采用比色法[6],确定芦丁浓度c与吸光度A之间的标准工作曲线,A=13.09c+0.003,相关系数R2=0.999 8。然后,取2.0 mL黄酮提取液,同样按照文献[6]的方法进行显色后,以试剂空白作参比测定吸光度值,利用标准工作曲线计算出鼠曲草黄酮的得率(为从鼠曲草粉末中所提取的黄酮的质量与鼠曲草粉末质量之比)。
2.3 总抗氧化活性的测定-磷钼络合物法
取0.1 g鼠曲草黄酮粉末,用体积分数30%乙醇溶解定容到100 mL容量瓶中,配制成质量浓度为1.0 mg/mL的鼠曲草黄酮储备液,用时用体积分数30%乙醇溶液稀释到所需浓度,配制VC溶液质量浓度为1.0 mg/mL作储备液。将储备液分别稀释成质量浓度为 0.10、0.15、0.20、0.25、0.30 mg/mL 的黄酮溶液和VC溶液的样品液。由终浓度为0.6 mol/L硫酸、4.0 mmol/L钼酸铵和28.0 mmol/L磷酸钠的溶液配制成磷钼试剂。取4.0 mL磷钼试剂液和0.4 mL样品溶液于一系列10 mL的比色管中,迅速摇匀后在95℃水浴中恒温90 min。在695 nm波长下测定不同浓度样品溶液的吸光度A。平行测定3次,取平均值。方法详见文献[7-8]。
2.4 清除羟基自由基能力的测定-结晶紫法
将储备液稀释成质量浓度为0.05 mg/mL的鼠曲草黄酮溶液和VC溶液为样品液。取0.5 mL结晶紫 (0.4 mmol/L)、0.7 mL H2O2溶液 (5.0 mmol/L)和0.7 mL FeSO4溶液 (10.0 mmol/L)于一系列10 mL的比色管中。用磷酸氢二钠-柠檬酸溶液的缓冲溶液(pH 4.0)定容至 10.0 mL,摇匀并放置 30 min,在580 nm波长下测其吸光度Ab,同时测定不加双氧水时580 nm波长处的吸光度A0。羟自由基的产生量可以用△A=A0-Ab表示。方法详见文献[9]。
样品液对羟自由基清除率的测定:按照上述步骤在加 H2O2之前分别加入 0.1、0.2、0.3、0.4、0.5 mL的样品液,测定其吸光度As,平行测定3次,取平均值。则样品溶液对羟自由基的清除率S为
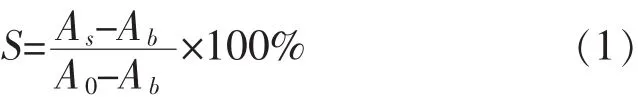
2.5 清除超氧阴离子自由基能力的测定-邻苯三酚自氧化荧光动力学法
将储备液配制成质量浓度分别为0.3、0.5、1.0 mg/mL的黄酮溶液和VC溶液为样品液。方法详见文献[10]。
2.5.1 光谱条件的选择 向1 cm的石英比色皿中加入 2.2 mL Tris-HCl缓冲溶液(pH 8.2)、0.1 mL 水和0.3 mL邻苯三酚(0.01 mol/L),混匀后立即扫描。设定灵敏度为2,Ex、Em缝宽为20,固定发射波长Em=508 nm,每隔两分钟在Ex=250~500范围内快速扫描,得到邻苯三酚随时间变化而变化的激发光谱。重新取液,固定激发波长Ex=444 nm,在Em=450~700 nm范围内每隔2 min扫描,得到邻苯三酚随时间变化的发射光谱。
2.5.2 邻苯三酚自氧化反应速率的测定 向1 cm的石英比色皿中加入2.2 mL Tris-HCl缓冲溶液(pH 8.2)、0.1 mL 样品液和 0.3 mL 邻苯三酚(0.01 mol/L),混匀后在激发Ex=444 nm和发射Em=508 nm的波长条件下测定。利用3~7 min(每隔1 min测定值)以时间为横坐标、相对荧光强度为纵坐标作图,斜率为Vs(以0.10 mL水代替样品溶液得到V0),即邻苯三酚自氧化的反映速率。按下式计算抑制剂对O2-·的抑制率V为

2.6 清除DPPH自由基的测定
将储备液稀释成质量浓度分别为0.02、0.04、0.06、0.08、0.10 mg/mL的鼠曲草黄酮溶液和VC溶液为样品液。取3.5 mL浓度为1×10-4mol/L的DPPH溶液和0.5 mL样品液于10 mL的比色管中,摇匀并放置30 min,倒入1 cm的石英比色皿,测定517 nm下的吸光度A。以3.5 mL DPPH溶液和0.5 mL体积分数30%乙醇溶液的混合液为参比,测定517 nm下的吸光度A1。同样方法测定3.5 mL无水乙醇和0.5 mL样品液混合后在517 nm下的吸光度A0,平行测定3次,取平均值。则样品液对DPPH自由基的清除率为
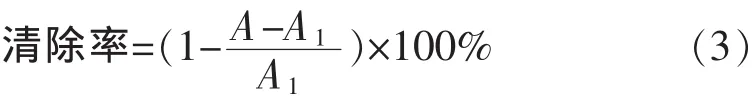
方法详见文献[11]。
2.7 Fe2+诱发卵黄脂蛋白过不饱和脂肪酸(PUFA)过氧化体系中抗氧化活性(AOA)的测定
将储备液稀释成质量浓度分别为0.1、0.2和0.3 mg/mL的鼠曲草黄酮溶液和VC溶液为样品液。卵黄悬浊液用卵黄和等体积的pH=7.45、浓度为0.1 mol/L的磷酸盐缓冲液(PB)配成体积比1∶1的悬浊液,磁力搅拌10 min,再用PB稀释成体积比1∶25的悬液置于冰箱中备用。取0.2 mL体积比1∶25的卵黄悬浊液、0.2 mL的25.0 mmol/L FeSO4溶液和0.2 mL样品液于一系列10 mL离心管中,用PB补充至2.0 mL,37℃培养24 h,取出后加入0.5 mL质量分数20%的三氯乙酸溶液(TCA)摇匀,10 min后再加入1.0 mL质量分数0.8%的硫代巴比妥酸溶液(TBA),置于沸水浴15 min,冷却后以3 500 r/min的转速离心10 min,取上清液,在532 nm波长下测定吸光度值A;对照管除不加样品液外,其它试剂同前,所测吸光值为A0,平行测定3次,取平均值。空白管以2.0 mL PB代替,则样品溶液对卵黄脂蛋白脂质过氧化的抑制率为

方法详见文献[12]。
3 结果与讨论
3.1 鼠曲草黄酮微波提取条件的优化
按方法2.1进行提取,固定其他条件,分别测定在不同料液比、提取时间、提取温度和乙醇体积分数下的鼠曲草黄酮得率,结果如图1所示。

图1 料液比、提取时间、提取温度、乙醇体积分数对黄酮得率的影响Fig.1 Effect of the ratio of material to liquid,time,temperature and ethanol concentration on flavones extraction
由图1可以看出,随着提取液比例的增大,黄酮提取量不断升高,当料液比达到1∶60时达到最高,之后黄酮得率有所下降。这是由于鼠曲草全株密被白绵毛的特点,随着提取液比例的增大,浸润程度增大,同时根据分散剂由高浓度向低浓度扩散原理,增大提取液比例也会增进黄酮的析出。但液料比过大的时候,会影响到物料对微波能的吸收,导致黄酮得率下降,故选择提取鼠曲草黄酮的料液比为1∶60。提取时间的延长促使黄酮提取量逐渐增加,在6 min处达到最大,之后保持稳定,因此选择6 min为鼠曲草黄酮提取的最优时间。在微波处理温度小于60℃时,随着温度的增加,总黄酮提取得率也随着增加,并在60℃时达到最大值;在微波处理温度大于60℃以后,过高的温度会使提取物部分分解或变性,同时杂质溶出量增加,提取率会明显减小[13-14]。故微波处理温度以60℃为宜。黄酮甙是由黄酮甙元与糖基构成,黄酮甙元极性较小,糖基极性较大,故黄酮甙是中等极性的物质。根据“相似相溶”原则,黄酮甙易溶于中等或中等偏上极性的溶剂中。乙醇体积分数超过50%时,极性相对偏低,黄酮甙的溶解度也降低。并且乙醇体积分数较高会使细胞蛋白质很快就凝固,不利于乙醇向细胞内渗透[15]。因此,本实验中选50%体积分数的乙醇作为提取溶剂。
3.2 总抗氧化活性
根据实验方法2.3,测定样品和VC不同质量浓度下的吸光度,得到其抗氧化活性强弱,结果见图2。
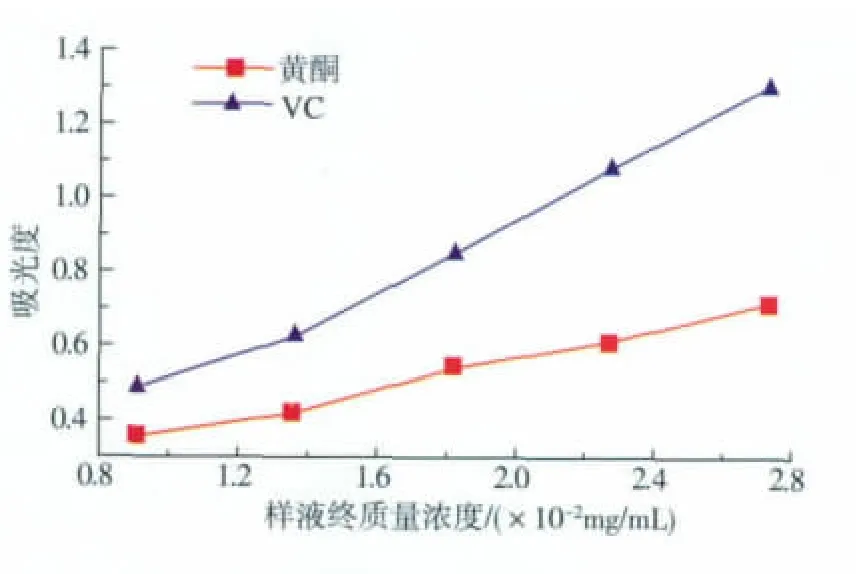
图2 样品液终质量浓度与吸光度的关系Fig.2 Relationship of final concentrations of samples and absorbance
由图2可以看出,样品的吸光度随质量浓度的增加而增加,说明质量浓度越大,其抗氧化性就越强。与抗氧化剂VC相比,两倍量的鼠曲草黄酮的总抗氧化能力约等于一倍量VC的总抗氧化能力。
3.3 清除羟自由基的能力
根据实验方法2.4,得到样品和VC在不同质量浓度下的吸光度,根据公式(1)计算对羟自由基的清除率,结果见图3。
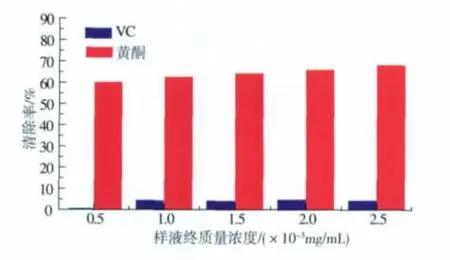
图3 样品液终质量浓度与羟自由基清除率的关系Fig.3 Relationship between sample concentration and hydroxyl radical scavenging
从图3可以看出,样品液对羟自由基的清除率随质量浓度的升高而变大,同质量浓度下,鼠曲草黄酮对羟自由基的清除能力远远大于VC。
3.4 清除超氧阴离子自由基的能力
参照试验方法2.5.1,扫描邻苯三酚自氧化随时间变化的激发与发射光谱,结果见图4。
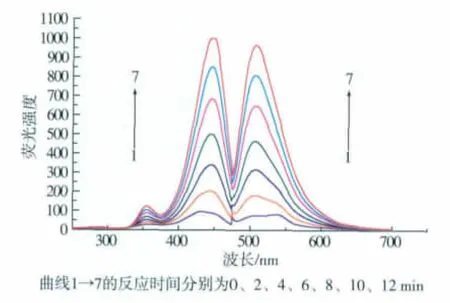
图4 邻苯三酚的激发光谱(左)和发射光谱(右)Fig.4 Excitation spectra (left) and emission spectra(right) of pyrogallol
实验表明,邻苯三酚自氧化产物的荧光强度随时间逐渐增大,从而得到荧光强度与时间的线性关系,直线的斜率为邻苯三酚自氧化速率V0。邻苯三酚自氧化产物的最佳激发波长和发射波长分别为444 nm和509 nm。
参照试验方法2.5.2进行测定,得出样品液对邻苯三酚自氧化产物的影响结果,见图5。
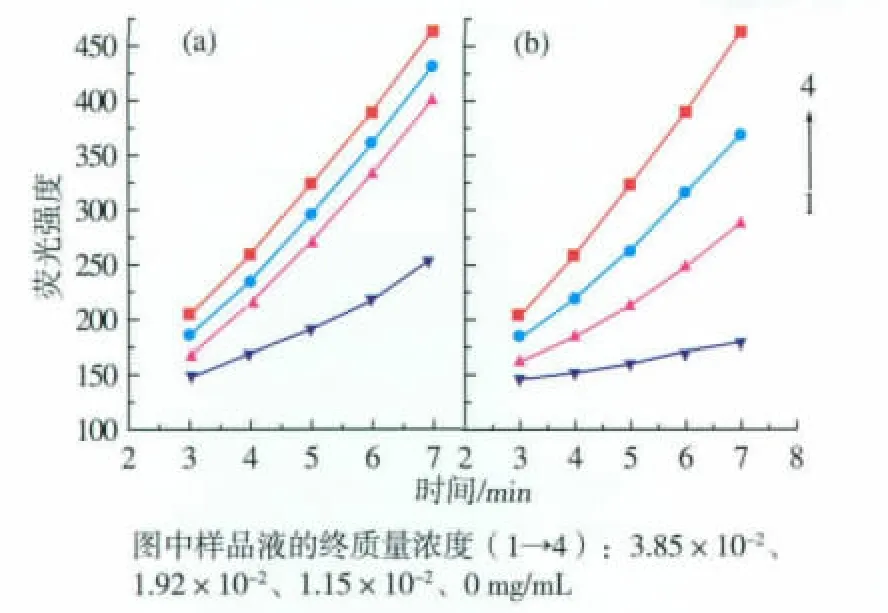
图5 黄酮(a)和Vc(b)荧光动力学曲线Fig.5 Curve of fluorescent kinetic of flavones(a) and Vc(b)
从图5可以看出,样品液的质量浓度越大则曲线斜率越小,表明样品液对邻苯三酚自氧化的抑制作用越强。按公式(2)计算得到样品液在不同质量浓度下对超氧自由基(O2-·)的抑制率,见表1。
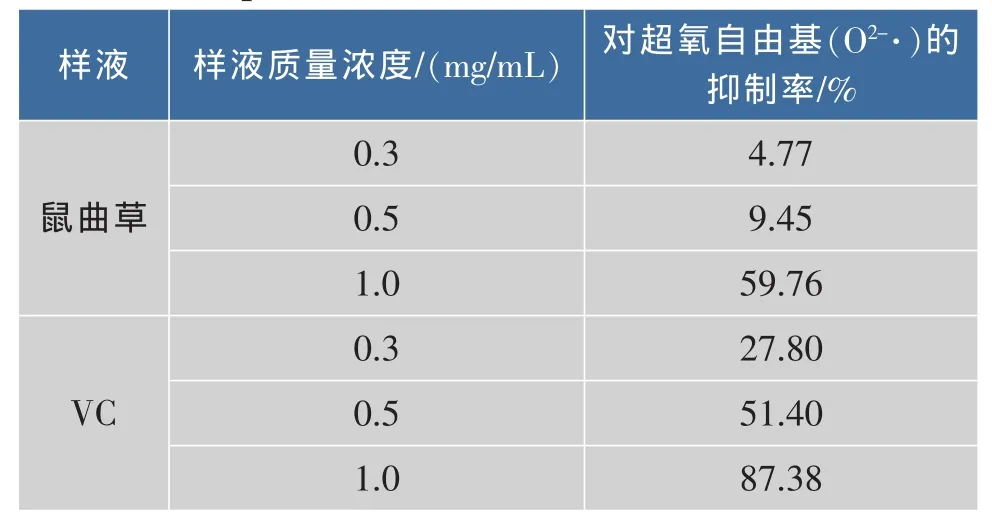
表1 样液对超氧自由基(O2-·)的抑制率Table 1 Inhibitory rate of sample concentration on superoxidic radicals
实验表明,鼠曲草黄酮在低质量浓度时对超氧自由基(O2-·)的作用不明显,但当升高其质量浓度时,其抑制力明显增强。
3.5 对DPPH自由基的清除能力
根据方法2.6,按照公式 (3)计算样品液对DPPH自由基的清除率,结果见图6。
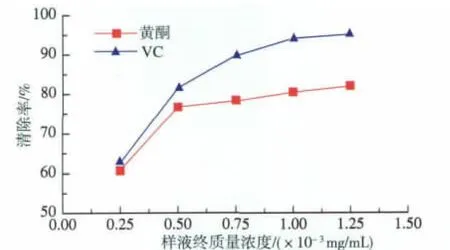
图6 样品液终质量浓度和DPPH自由基清除率的关系Fig.6 Relationship between sample concentration and DPPH radical scavenging
由图6可以看出,随着样液质量浓度的增大清除率也随之增大,当鼠曲草黄酮样液终质量浓度达到1.25×10-3mg/mL时,对DPPH自由基的清除率达到81.77%,略低于同质量浓度的VC。
3.6 对Fe2+诱发卵黄脂蛋白过氧化的抑制作用
按照实验方法2.7,得到黄酮溶液和VC溶液在不同质量浓度下的吸光度,根据公式(4),计算出样品液对Fe2+诱发卵黄脂蛋白过氧化的抑制率,结果见图7。
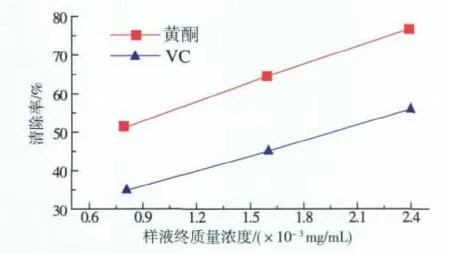
图7 样品液终质量浓度对Fe2+诱发卵黄脂蛋白过氧化的抑制率的影响Fig.7 Inhibition effect of sample concentration on the peroxidation of yolk lipoprotein induced by Fe2+
由图7可以看出,随着样液质量浓度的增加,对于Fe2+诱发卵黄脂蛋白过氧化的抑制率逐渐增强,当黄酮溶液终质量浓度达到2.4×10-2mg/mL时清除率达到76.80%,高于同质量浓度的VC。
4 结语
通过实验得出微波功率固定为500 W时,微波提取的最佳工艺为:乙醇体积分数50%,料液比1∶60,温度60℃,时间6 min,在此条件下得到的最高黄酮得率为4.63%。鼠曲草黄酮在总抗氧化能力、清除超氧阴离子自由基的能力、清除DPPH自由基的能力略低于抗氧化剂VC,但在清除羟自由基的能力和抑制Fe2+诱发卵黄脂蛋白过氧化的能力上鼠曲草黄酮强于VC。结果表明,鼠曲草黄酮是一种很好的天然抗氧化剂,本实验结果为鼠曲草植物的开发利用提供了理论依据。
[1]史虞花,司民真.鼠曲草的红外光谱分析[J].光散射学报,2009,21(4):366-370.SHI Yu-hua,SI Min-zhen.Comparison of FT-IR spectra of cudweed herb[J].The Journal of Light scattering,2009,21(4):366-370.(in Chinese)
[2]吕晴,秦军,陈桐,等.气相色谱-质谱法分析鼠曲草挥发油化学成分[J].贵州工业大学学报,2008,37(5):1-3,10.LV Qin,QIN Jun,CHEN Tong,et al.GC-MS analysis of chemical components in volatile oil from the gnaphlium affine D.Don[J].Journal of Gui Zhou University of Technology,2008,37(5):1-3,10.(in Chinese)
[3]潘明,王世宽,郭脉玺,等.鼠曲草黄酮类物质微胶囊化研究[J].食品科学,2009,30(12):94-97.PAN Ming,WANG Shi-kuan,GUO Mai-xi,et al.Microencapsulation of flavonoids from chaphalium affine D.Don[J].Food Science,2009,30(12):94-97.(in Chinese)
[4]王世宽,潘明,任路瑶.大有开发前景的野生蔬菜——鼠曲草[J].食品研究与开发,2005,26(4):95-97.WANG Shi-kuan,PAN Ming,LU Lu-yao.Great prospects for development of wild Vegetable-Gnaphlium affine D.Don[J].Food Research and Development,2005,26(4):95-97.(in Chinese)
[5]江苏新医学院.中药大词典:下册[M].上海:上海人民出版社,1979:2501-2502.
[6]毕洁,杨庆利,于丽娜,等.花生壳黄酮乙醇提取工艺探讨[J].现代化工,2008,28(2):316-319.BI Jie,YANG Qing-li,YU Li-na,et al.Ethanol extraction technology of flavonoids from peanut hull[J].Modern Chemical Industry,2008,28(2):316-319.(in Chinese)
[7]Ozkan G,Simsek B,Kuleasan H.Antioxidant activities of Satureja cilicica essential oil in butter and in vitro[J].J Food Eng,2007,79:1391-1396.
[8]Kumaran A,Karunakaran R J.In vitro antioxidant activities of methanol extracts of five Phyllanthus species from India[J].LWTFood Sci Technol,2007,40:344-352.
[9]刘骏.结晶紫分光光度法测定Fenton反应产生的羟自由基[J].武汉工业学院学报,2005,24(2):53-55.LIU Jun.Research on a new method of determination and elimination of free radical[J].Joumal of Wuhan Polytechnic University,2005,24(2):53-55.(in Chinese)
[10]赫春香,卢丽男,曹璨.荧光动力学分析新方法测定超氧自由基抑制剂的抗氧活性 [J].辽宁师范大学学报:自然科学版,2005,28(1):73-75.HE Chun-xiang,LU Li-nan,CAO Can,et al.A new method of determination on antioxidant activity of scavening on superoxide radicals by fluorescent kinetic analysis[J].Journal of Liaoning Normal University:Natural Science Edition,2005,28(1):73-75.(in Chinese)
[11]陆占国,郭红转,封丹.芫荽茎叶精油成分及清除DPPH自由基能力研究[J].食品与发酵工业,2006,32(8):24-27.LU Zhan-guo,GUO Hong-zhuan,FENG Dan.Study on chemical constituents of coriander leaf essential oil and scavenging capacity against the DPPH radical[J].Food and Fermentation Industries,2006,32(8):24-27.(in Chinese)
[12]张尔贤,俞丽君,周意琳.Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价[J].生物化学与生物物理学报,1996,28(2):218-222.ZHANG Er-xian,YU Li-jun,ZHOU Yi-lin.Studies on the peroxidation of polyunsaturated fatty acid from lipoprotein induced by iron and the evaluation of the anti-oxidative activity of some natural products[J].Acta Biochimica et Biophysica Sinica,1996,28(2):218-222.(in Chinese)
[13]乔良博,林华卫,马雄,等.微波辅助提取花生壳中总黄酮的提取工艺研究[J].食品与发酵科技,2011,47(4):34-37.QIAO Liang-bo,LIN Hua-wei,MA Xiong,et al.Study on microwave-assisted extraction technology of the flavonoids from peanut hull[J].Food and Fermentation Technology,2011,47(4):34-37.(in Chinese)
[14]李云志,曾凡骏,李帆.元宝枫叶总黄酮的提取研究[J].食品与生物技术学报,2006,25(1):27-31.LI Yun-zhi,ZENG Fan-jun,LI Fan.The extraction of flavonoids from the leaves of acer truncatum bunge[J].Journal of Food Science and Biotechnology,2006,25(1):27-31.(in Chinese)
[15]刘俊,黄少伟,张越非,等.微波辅助提取土茯苓总黄酮[J].中药材,2007,30(12):1591-1595.LIU Jun,HUANG Shao-wei,ZHANG Yue-fei.Extracting flavonoids from smilax glabra by microwave-assisted method[J].Journal of Chinese Medicinal Materials,2007,30(12):1591-1595.(in Chinese)
