磁分离结合CdTe发光量子点标记黄曲霉毒素B1免疫检测新方法
2013-02-19李向丽谭贵良吴世嘉王周平
李 响, 李向丽, 谭贵良, 吴世嘉, 王周平*
(1.江南大学 食品学院,江苏 无锡 214122;2.中山火炬职业技术学院,广东 中山528436;3.中山市质量计量监督检测所,广东 中山523290)
黄曲霉广泛存在于土壤、灰尘、植物及其果实上,食品原材料特别容易受黄曲霉毒素污染。各类黄曲霉毒素中,以黄曲霉毒素B1的毒性最大,且有致癌性,许多国家规定了黄曲霉毒素在食品中的极限值,因此对黄曲霉毒素的检测也成为食品安全领域的研究重点之一。传统的黄曲霉毒素检测方法,如薄层层析法、高效液相色谱法、微柱法、酶联免疫吸附法等各有其优缺点,因此有必要发展更简便灵敏的新型检测方法。利用半导体纳米晶体进行荧光生物标记是近年来的研究热点之一[1]。半导体量子点通常是由两种或两种以上的Ⅰ~Ⅶ、Ⅱ~Ⅵ或Ⅲ~Ⅴ族元素组成,而目前较成熟的量子点是由Ⅱ~Ⅵ或Ⅲ~Ⅴ族元素组成,如 CdSe、CdS、ZnS[2-3]等,它们简便易得,分析稳定性高[4]。量子点在生物、医药、食品等方面的应用主要是对细胞标记[5-6]以及基于DNA的标记检测,其突出特点是灵敏度高[7]。
本研究中采用水相合成法制备巯基丙酸包裹的CdTe量子点,将量子点标记在免疫抗体上,基于竞争免疫反应并结合磁性纳米材料的磁分离富集作用,有效地提高了检测灵敏度,开发了一种黄曲霉毒素B1的新型高灵敏检测方法。实验将AFB1人工抗原(AFB1-BSA)与氨基化Fe3O4磁性纳米粒子结合,制备AFB1人工抗原功能化Fe3O4磁性纳米粒子作为捕获探针 (AFB1-BSA-Fe3O4NPs)。同时将CdTe量子点与羊抗兔-IgG(二抗)结合,构建荧光信号探针(IgG-CdTe QDs)。竞争免疫反应中,标准黄曲霉毒素B1或样品中的黄曲霉毒素B1与AFB1-BSA-Fe3O4NPs竞争性结合AFB1单克隆抗体 (一抗);随后施加外源磁场分离富集形成的一抗与捕获探针的免疫复合物,再加入荧光信号探针,通过一抗与二抗的免疫亲和,形成捕获探针-一抗-显示探针的免疫复合物,磁分离富集纯化后测定荧光强度,以此来定量目标物质AFB1含量。新方法将发光量子点标记技术、荧光分析技术、磁分离富集技术与竞争免疫分析技术有机结合,具有特异性强、灵敏度高、分析时间短、操作简便等特点。
1 材料与方法
1.1 材料与试剂
巯基丙酸、对乙基-N,N-二甲基丙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、黄曲霉毒素B1单克隆抗体、羧甲基羟胺半盐酸盐,购于Sigma Aldrich公司;黄曲霉毒素B1,购于北京泰勒奇科技有限公司;碲粉,购于Alfa Aesar公司;羊抗兔IgG、SP132582透析袋,购于上海生工生物工程技术服务有限公司;SDS-PAGE凝胶配制试剂盒,购于碧云天生物技术研究所;薄层层析硅胶板,购于上海上邦实业有限公司;氯仿、甲醇、N,N-二甲基甲酰胺、吡啶、四氢呋喃、水合氯化镉、硼氢化钠、质量分数25%的戊二醛,以及无水乙醇、丙酮、氯化钠、氯化钾、十二水合磷酸氢二钠、磷酸二氢钾等,购自国药集团上海化学试剂有限公司。
1.2 主要仪器
UV2300型双光束紫外可见分光光度计,上海天美科学仪器有限公司制;F-7000型荧光分光光度计,日本岛津制;Zenyth3100型荧光/化学发光分析仪,奥地利Anthos制;5430R台式高速冷冻离心机,德国Ceppendorf制;Biorad电泳仪,美国Bio-Rad伯乐公司制;Biorad凝胶成像仪,美国Bio-Rad伯乐公司制;DF-101s集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司制;HYG-Ⅱa回转式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司制;DF-101S型集热式磁力加速搅拌器,江苏省金坛市通济仪器厂制;KJ-300型超声波清洗器,无锡科杰电子仪器公司制;荧光倒置显微镜,日本Olympus制;JEM2100型透射电镜,日本JEOL公司制;傅里叶红外光谱仪,美国 Bio-Rad公司制;Waters Platform ZMD 4000 ESI质谱仪,美国 Waters公司制;另有Dmax-IIIB X-射线衍射仪等。
2 试验步骤
2.1 材料准备
2.1.1 CdTe量子点的合成与表征 借鉴Zhang,李太山等的方法[8-9]并加以改进,制备CdTe发光量子点,具体步骤如下。
1)碲氢化钠的合成:在50 mL的圆底烧瓶中一次加入 0.031 9 g 碲粉(0.025 mmol)、0.038 0 g 硼氢化钠(1 mmol)、5 mL 超纯水,通入氮气,磁力搅拌至变成淡紫色溶液待用。
2)巯基丙酸-镉配合物的制备:在250 mL的三口烧瓶中一次加入200 mL超纯水,0.114 2 g水合氯化镉(0.5 mmol)、0.109 2 g 巯基丙酸(1.2 mmol),充分溶解后,用1 mol/L NaOH调节溶液的pH值至11.2,之后通氮气约30 min。
3)碲化镉量子点的制备:将已经制备的碲氢化钠溶液加入至巯基丙酸-镉配合物溶液中,通氮气,120℃恒温搅拌回流计时,取12 h后的样品,利用透射电镜表征其形貌,通过荧光分光光度计、紫外可见分光光度计对CdTe发光量子点光谱性质进行表征。
2.1.2 CdTe量子点与羊抗兔IgG的结合 借鉴Clapp,So等的方法[10-13]并加以改进,制备CdTe量子点与羊抗兔IgG复合物,具体方法为:取200 μL CdTe量子点加入2 mg/mL的EDC 50 μL,室温下混合5 min,37℃振荡反应15~20 min,再加入2 mg/mL的 NHS 25 μL,室温下振荡反应 15 min,再加入2 mg/mL的羊抗兔 IgG 200 μL,37℃振荡反应 2 h,6 000 r/min离心15 min,弃去上清液。用PBS清洗一次,同样条件再次离心去上清液,重悬于100 μL超纯水中,以除去未反应的羊抗兔IgG,4℃保存。
2.1.3 氨基化磁性纳米粒子的制备 实验中采用了水热溶剂法[14-15]制备氨基化Fe3O4磁性纳米粒子,以六合水氯化高铁为铁源,1,6-己二胺作为氨基功能化试剂,无水醋酸钠为碱,乙二醇为溶剂和还原剂,通过198℃反应成功制备了氨基化磁性纳米粒子,并利用TEM和Dmax-IIIB X-射线衍射仪(XRD)对其形貌和组成进行了表征。
2.1.4 磁性纳米粒子与人工抗原AFB1-BSA的结合与表征 10 mg的MNPs(Fe3O4磁性纳米颗粒)分散在5 mL的0.01 mol/L的PBS溶液中超声20 min,加入1.25 mL质量分数25%的戊二醛和100 mg的硼氢化钠,在室温下振荡1 h,通过外部磁场将Fe3O4富集,用PBS缓冲液冲洗除去未完全吸附的戊二醛,溶于5 mL PBS。取2 mg/mL磁性纳米粒子 150 μL,加入 50 μL 1.4 mg/mL 的 AFB1-BSA,在室温下振荡6 h,通过磁力收集产物,并用PBS清洗3次。用2 mg/mL的BSA溶液200 μL重悬产物,室温下保存6 h,封闭没有结合人工抗原的结合位点。磁力收集产物,产物重悬于200 μL超纯水中并保存于4℃待用,用荧光倒置显微镜和UV2300紫外可见分光光度计对其进行表征。
2.2 实验条件优化
2.2.1 磁性纳米粒子与人工抗原(AFB1-BSA)结合的浓度优化 磁性纳米粒子Fe3O4溶液浓度较大时颜色黑,容易遮蔽荧光强度从而影响测量。将人工抗原分别与质量浓度为1、2、5、10 mg/mL的磁性纳米粒子结合。取200 μL结合浓度不同的MNPs-AFB1-BSA,加入200 μL稀释200倍的AFB1单克隆抗体,37℃下反应2 h,清洗后在体系中加入作者制备的二抗量子点复合物原液200 μL,37℃下反应2 h,清洗后重悬于100 μL超纯水中,测定荧光强度并作图。
2.2.2 羊抗兔IgG与量子点结合浓度的优化 在本实验中发现碲化镉量子点纳米粒子表面所连接的羊抗兔-IgG的浓度对测定时的荧光强度影响较大。为了研究此影响因素,将荧光纳米粒子与不同浓度的羊抗兔-IgG结合,选取质量浓度分别为0.1、0.5、1.0、1.5、2.0、5.0 mg/mL 的羊抗兔-IgG 溶液 200 μL,分别加入至1.5 mL的离心管中,用2.1.2节所述方法将量子点与羊抗兔IgG结合,并加入后续的反应步骤中,测定最终荧光强度并作图。
2.2.3 AFB1单克隆抗体的结合浓度优化 本实验中所建立的免疫竞争反应模式是通过结合磁性纳米材料上的人工抗原和标准黄曲霉毒素B1竞争结合AFB1单克隆抗体而实现的,因此适宜的AFB1单克隆抗体溶液浓度是本实验检测的关键。因此对AFB1单克隆抗体的包被液浓度进行了优化。分别取相对于 AFB1单克隆抗体原液稀释了 200、500、1 000、2 000、5 000、10 000 倍的溶液 200 μL,加入到200 μL Fe3O4磁性纳米粒子与人工抗原复合物体系中,37℃反应2 h,加入作者制备的二抗量子点复合物原液,37℃下反应2 h,清洗重悬于100 μL超纯水中测定荧光强度并作图。
2.2.3 QDs-羊抗兔IgG复合物浓度的优化 加入AFB1人工抗原功能化磁性纳米粒子溶液200 μL至1.5 mL的离心管中,共8管,后加入200 μL稀释1 000倍的AFB1单克隆抗体,37℃摇床2 h,外加磁力富集,弃去上清液,并用0.01 mol/L的PBS溶液清洗3次,得到沉淀物,取不同稀释倍数的二抗复合物溶液各200 μL,稀释倍数分别为原液、2倍、5倍、10倍、50倍、100倍,分别加入上述离心管摇床内37℃反应2 h。使用外加磁力富集,弃去上清液,沉淀物重悬于100 μL超纯水中,测定重悬液的荧光强度并作图。
2.3 黄曲霉毒素B1的检测
2.3.1 免疫反应 取磁性纳米粒子与AFB1人工抗原复合物 (MNPs-AFB1-BSA)溶液200 μL置于1.5 mL的离心管中,加入标准黄曲霉毒素B1100 μL(空白组中加入 100 μL 超纯水),再加入 200 μL稀释1 000倍的AFB1单克隆抗体,用0.01 mol/L的PBS溶液定容至1.0 mL,37℃恒温2 h,外加磁力使磁性纳米粒子富集,弃去上清液,并用PBS缓冲液冲洗3次,磁富集得到沉淀物,用质量分数2%的BSA溶液孵育以封闭人工抗原剩余结合位点。加入作者中制备的CdTe发光量子点与羊抗兔IgG的结合物,稀释2倍后置200 μL的离心管中,用0.01 mol/L的PBS溶液定容至1.0 mL,超声处理10 min增大磁性纳米粒子分散度,3 7℃恒温静置2 h。利用外加磁力使纳米粒子富集,弃去上清液,沉淀物用100 μL超纯水重悬,测定重悬液的荧光强度。
2.3.2 标准曲线 对标准黄曲霉毒素B1进行梯度稀释,根据2.3.1的实验步骤,测定最终的荧光强度,作出标准曲线,得出黄曲霉毒素B1与所测荧光强度的线性关系以及最低检测限。
2.3.3 检测方法的应用 取市售玉米粉,加入不同浓度的黄曲霉毒素B1,用甲醇水法提取玉米粉中的黄曲霉毒素B1,采用本文方法测定荧光强度。将检测到的荧光强度代入建立好的线性方程,计算黄曲霉毒素B1含量,和之前加入的量进行比较,计算回收率以评价该方法的准确性。
3 结果与讨论
3.1 CdTe量子点的制备与表征
按照实验方法制备了CdTe发光量子点,并采用TEM和荧光光谱对其进行表征。由图1可知,CdTe量子点的粒径为5 nm左右,呈球形,分散性良好。图2为反应12 h的CdTe量子点荧光光谱,在360 nm的激发光下,CdTe量子点的最大发射波长为560 nm。

图1 CdTe量子点的透射电镜图Fig.1 TEM image of CdTe QDs
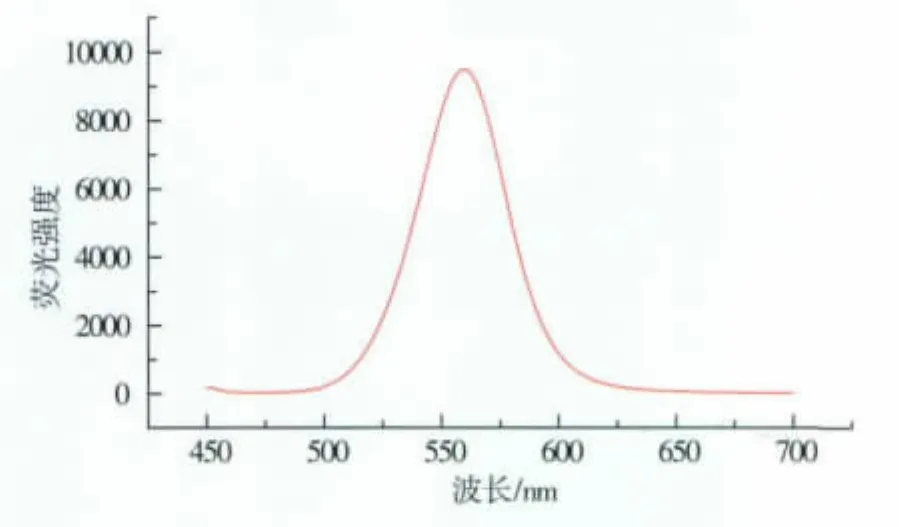
图2 CdTe量子点的荧光光谱Fig.2 Fluorescence spectrum of CdTe QDs
3.2 氨基化磁性纳米颗粒的表征
由TEM(图3)可知,实验所制备的氨基化磁性纳米颗粒粒径在35~55 nm,由X-衍射(图4)可知,制备出来的是尖晶石型Fe3O4磁性纳米颗粒,峰形符合JCPDS卡82-1533,其窄而强的衍射峰充分说明了磁性纳米颗粒具有良好的结晶性[16]。
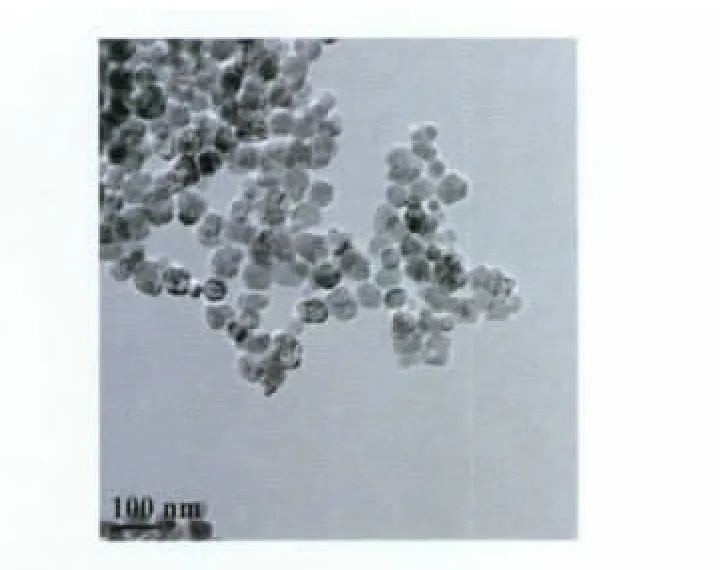
图3 Fe3O4纳米颗粒的TEM图Fig.3 TEM image of the prepared Fe3O4nanoparticles
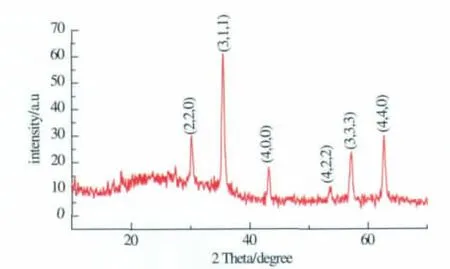
图4 Fe3O4纳米颗粒的XRD图Fig.4 XRD patterns of the prepared Fe3O4nanoparticles and the standard data for Fe3O4
3.3 磁性纳米粒子和人工抗原AFB1-BSA的结合与表征
黄曲霉毒素B1在紫外线照射下产生荧光,与磁性纳米粒子相连的AFB1-BSA经过清洗与磁富集,磁珠溶液在荧光显微镜下有荧光显示,如图5所示。表明磁性纳米粒子与AFB1-BSA成功偶联。

图5 MNPs-AFB1-BSA复合物荧光显微镜图(40*100)Fig.5 Fluorescence microscope of MNPs-AFB1-BSA
由图6所示,在波长280 nm和360 nm处,200 μL人工抗原AFB1-BSA原液紫外吸收和与磁性纳米材料结合富集后上清液紫外吸收相比较有一定差值,表明有部分AFB1-BSA已经成功连接到了磁性纳米粒子上。
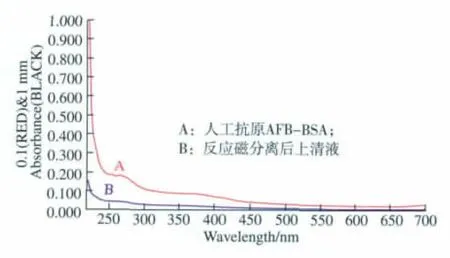
图6 紫外可见吸收图谱Fig.6 Ultra-visible(UV)absorption spectrum
3.4 实验条件优化
3.4.1 磁性纳米粒子与人工抗原结合的浓度优化实验考察了不同浓度磁性纳米粒子Fe3O4溶液与人工抗原结合时系统荧光强度的变化情况。结果发现(图 7), 磁性纳米粒子质量浓度为 1、5、10 mg/mL时,荧光强度均低于2 mg/mL的,分析原因可能是磁珠浓度过高时,磁珠的黑色对荧光造成了遮蔽效应。故实验中选择2 mg/mL的磁性纳米粒子溶液。
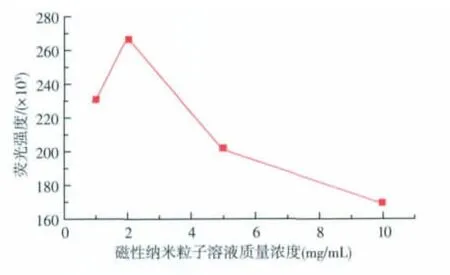
图7 不同质量浓度磁性纳米粒子溶液与人工抗原结合荧光强度的关系曲线Fig.7 Fluorescence intensity of different concentration Fe3O4combined with AFB1-BSA
3.4.2 羊抗兔IgG与量子点结合浓度的优化 实验考察了不同浓度羊抗兔IgG与量子点结合时系统荧光强度的变化情况。结果发现(图8),羊抗兔IgG 的质量浓度为 0.1、0.5、1、1.5、2、5 mg/mL,测定的荧光强度随羊抗兔IgG的量的增大而增大;当羊抗兔IgG的质量浓度超过1 mg/mL时,最终荧光强度升高并趋于稳定。故实验选用1 mg/mL的羊抗兔IgG溶液与量子点结合。
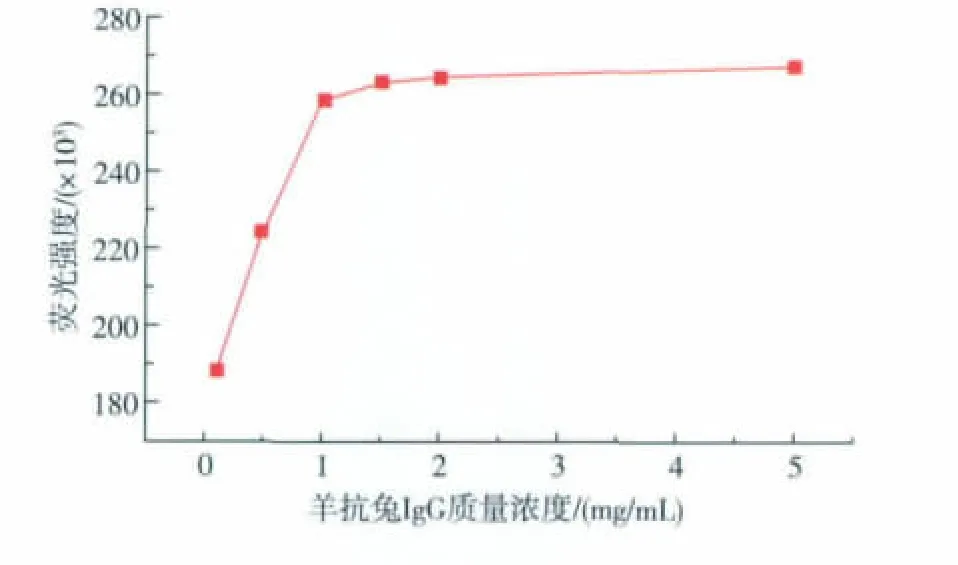
图8 不同质量浓度羊抗兔IgG与量子点结合荧光强度的关系曲线Fig.8 Fluorescence intensity of different concentration goat anti-rabbit IgG coated with QDs
3.4.3 AFB1单克隆抗体的结合浓度优化 实验也考察了AFB1单克隆抗体的结合浓度对系统荧光强度的影响。由图9可知,AFB1单克隆抗体稀释10 000、5 000、1 000倍时,荧光强度上升,稀释倍数小于1 000时荧光强度趋于稳定,此时AFB1单克隆抗体趋于饱和,故选择AFB1稀释1 000倍作为最佳反应浓度。
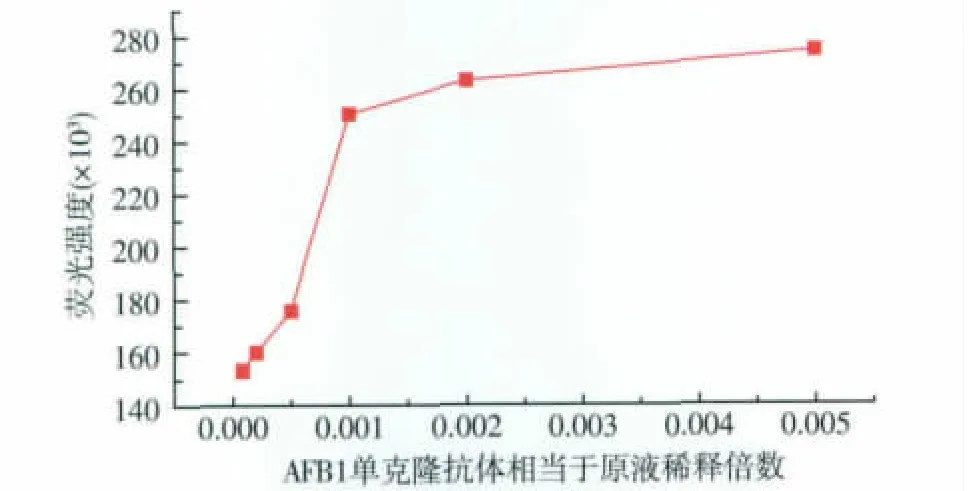
图9 不同质量浓度的AFB1单克隆抗体孵育前后荧光强度差值的关系曲线Fig.9 Fluorescence intensity of monoclonal antibodies incubation of AFB1of different concentration
3.4.4 QDs-羊抗兔IgG浓度的优化
实验进一步考察了QDs-羊抗兔IgG复合物浓度对系统荧光强度的影响。CdTe发光量子点与1 mg/mL羊抗兔IgG反应后将其复合物稀释0、2、5、10、50、100倍作为优化条件,将横坐标设定为反应中加入的羊抗兔IgG质量浓度,纵坐标为荧光强度。由图10可知,复合物原液与稀释2倍的溶液复合物最终荧光强度较高且比较稳定,故本次实验选择稀释2倍的溶液复合物。
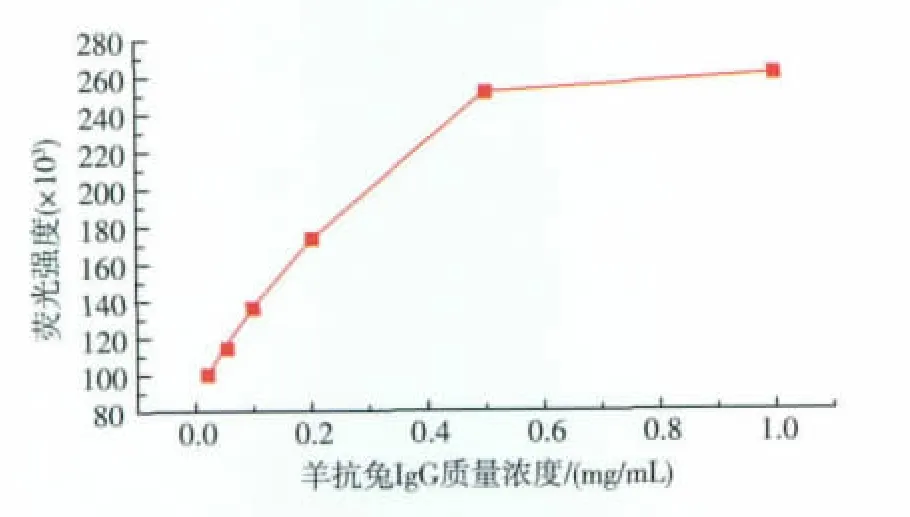
图10 QDs-羊抗兔IgG不同稀释倍数与荧光强度的关系曲线Fig.10 Fluorescence intensity curve of QDs-goat antirabbit IgG in different concentration
3.5 标准曲线
在实验选定的最佳条件下,荧光强度与黄曲霉毒素B1质量浓度在0.1~100 ng/mL范围内呈良好的线性关系(图11),线性方程为IF=-1 333.35[AFB1]+267 752(R2=0.996 8),检出限为 0.1 ng/mL。7 次测量50 ng/mL标准黄曲霉毒素B1以评估该方法的精密度,相对标准偏差为3.0%。
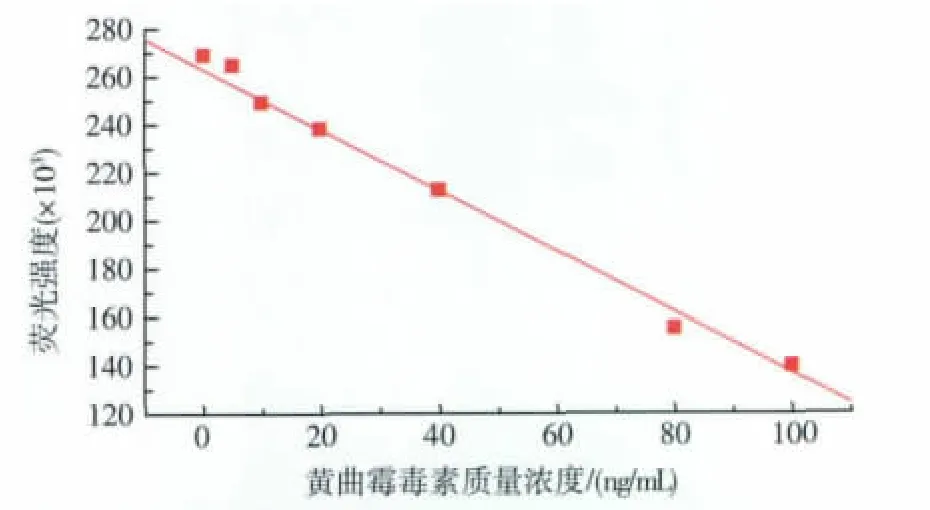
图11 黄曲霉毒素B1质量浓度与荧光强度的关系曲线Fig.11 Standard curve for AFB1 and fluorescence intensity
3.6 玉米样品中黄曲霉毒素B1的检测
按照实验部分所述,实验中考察了所建立的方法,由表1可知,玉米粉样品中黄曲霉毒素B1的加标回收率为88.0%~98.8%,表明本实验所建立的新型检测技术的准确性高,可以用于实际样品中黄曲霉毒素B1的检测。

表1 玉米粉样品中黄曲霉毒素B1的检测回收率Table 1 Recovery rate of AFB,in compowder samples
4 结语
基于生物功能化磁性纳米粒子的有效分离富集、发光量子点的高效荧光标记,结合竞争免疫分析技术,成功建立了黄曲霉毒素B1的新型检测方法。首先在水相中合成CdTe发光量子点,并采用水热法合成了磁性纳米粒子,以AFB1人工抗原功能化磁性纳米粒子作为捕获探针,以发光量子点标记羊抗兔IgG作为信号探针,基于竞争免疫原理,建立了AFB1的新型检测方法。实验优化条件下,荧光强度与AFB1质量浓度在0.1~100 ng/mL范围内呈良好的线性关系,检测限为0.03 ng/mL。同时通过检测玉米中AFB1的情况来评价该方法的准确性,显示了该法良好的应用前景。
[1]Bruchez Jr M,Moronne M,Gin P,et al.Semiconductor nanocrystals as fluorescent biological labels[J].Science,1998,281(5385):2013-2016.
[2]Murray C B,Norris D J,Bawendi M G.Synthesis and characterization of nearly monodisperse CdE(E=sulfur,selenium,tellurium)semiconductor nano-crystallite[J].J Am Chen Soc,1993.115(19):8706-8715.
[3]Peng Z A,Peng X G.Formation of high-quality CdTe,CdSe and CdS nanocrystals using CdO as precursor[J].J Am Chem Soc,2001,123(1):183-184.
[4]Rajh T,Micic O I,Nozik A J.Synthesis and characteristics of surface-modified colloidal CdTe quantum dots[J].The Journal of Physical Chemistry,1993,97(46):11999-12003.
[5]Wu X,Wu H,Hu J,et al.Immunofluorescent Labeling of cancer marker and other cellular targets with semiconductor quantum dots[J].Nat Biotechnol,2003,21(1):41-46.
[6]Medintz I L,Trammell S A,Mattoussi H,et al.Reversible modulation of quantum dot photoluminescence using a protein-bound photochromic fluorescence resonance energy tranfer aceeptor[J].J Am Chem Soc,2004,126(1):30-31.
[7]Zhang C Y,Yeh H C,Kuroki M T,et al.Single-Quantum-Dot-Based DNA nanosensor[J].Nature Materials,2005,4(11):826-831.
[8]李太山,刘绍璞,刘忠芳,等.CdTe纳米晶溶液的荧光和共振瑞利散射特性及CdTe纳米晶与氨基糖苷类抗生素相互作用[J].中国科学 B,2008,38(9):798-807.LI Tai-shan,LIU Shao-pu,LIU Zhong-fang,et al.Properties of fluorescence and Resonance rayleigh scatlering of CdTe nanocrystals and interaction between CdTe nanocrystals and Aminoglycosides[J].Scientia Sinica B,2008,38 (9):798-807.(in Chinese)
[9]Zhang H,Zhou Z,Yang B,et al.The influence of carboxyl groups on the photoluminescence of mercaptocarboxylic acidstabilized CdTe nanoparticles[J].J Phys Chem B,2003,107(1):8-13.
[10]Hua X F,Liu T C,Cao Y C,et al.Characterization of the coupling of quantum dots and immunoglobulin antibodies[J].Anal Bioanal Chem,2006,386(6):1665-1671.
[11]Xing Y,Chaudry Q,Shen C,et al.Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry[J].Nat Protoc,2007,2(5):1152-1165.
[12]Clapp A R,Goldman E R,Mattoussi H.Capping of CdSe-ZnS quantum dots with DHLA and subsequent conjugation with proteins[J].Nat Protoc,2006,1(3):1258-1266.
[13]So M K,Loening A M,Gambhir S S,et al.Creating self-illuminating quantum dot conjugates[J].Nat Proto,2006,1 (3):1160-1164.
[14]Deng H,Li XL,Peng Q,et al.Monodisperse magnetic single-crystal ferrite microspheres[J].Angew Chem Int Edit,2005,44:2782-2785.
[15]Wang L Y,Bao J,Wang L,et al.One pot synthesis and bioapplication of amine-functionalized magnetite nanoparticles and hollow nanospheres[J].Chem Eur,2006,12:6341-6347.
[16]李民勤,徐慧显,何炳林.葡萄糖磁性豪微粒的制备[J].高等学校化学学报,1996,17:147-150.LI Min-qin,XU Hui-xian,HE Bing-lin.Preparation of glucose magnetic nanosomes[J].Chemical Journal of Chinese University,1996,17:147-150.(in Chinese)
