响应曲面法优化玉竹水溶性多糖提取及体外抗氧化研究
2013-02-19孙文武何天龙朱苏骐邵红军段玉峰
杨 颖, 孙文武, 周 晨, 何天龙,刘 楠, 朱苏骐, 邵红军*, 段玉峰*,
(1.陕西师范大学 食品工程与营养科学学院;2.陕西师范大学 化学化工学院;3.陕西师范大学 生命科学学院;4.陕西师范大学 物理学与信息技术学院,陕西 西安 710062)
玉竹(Polygonatum odoratum(Mill.)Druce)是我国重要的药食同源植物,其干燥根茎具有养阴润燥,生津止渴功能,主要用于治疗肺胃阴伤,燥热咳嗽,咽干口渴,内热消渴[1]。它作为一种优于参芪的滋阴、防燥、降温和祛暑的营养滋补品已越来越受到人们的欢迎,其需求量逐年增长[2]。现代化学成分研究发现:玉竹中含有多糖[1]、甾体皂苷[3]、二氢高异黄酮[4]、挥发油[5]、凝集素[6]和二肽[7]等多种成分。 其中,因玉竹水溶性多糖(POP)具有抗衰老[8]、抗氧化[9]、抗病毒[10]、降血糖[11]和增强免疫力[12]等多种生理功能,而POP的提取分离与结构分析也颇受关注。Tomoda等[13]研究发现POP单糖组分为D-果糖、D-甘露糖、D-葡萄糖和D-半乳糖醛酸,其摩尔比为6∶3∶1∶1.5。此外玉竹中还含有4种由葡萄糖和果糖组成的果聚糖[14]。但POP提取工艺优化研究尚未见报道。因此,本实验中利用响应曲面法优化POP提取工艺,将有利于玉竹活性成分及营养保健机理的深入研究,同时也为进一步开发我国丰富的玉竹保健食品提供科学理论依据。
1 材料与方法
1.1 试验材料
1.1.1 药品 玉竹购于陕西省西安万寿路中药材市场,由陕西师范大学生命科学学院药用植物工程技术实验室鉴定为玉竹 (Polygonatum odoratum(Mill.) Druce)的干燥根茎。 1,1-二苯基-2-苦基肼(DPPH),美国Sigma公司产品;其它化学试剂均为国产分析纯试剂。
2.1.2 仪器 U-3010 Sdetrophotometer紫外分光光度计,日本HITICHI公司制造;AL204型电子天平,梅特勒-托利多仪器 (上海)有限公司制造;DL-4C低速大容量离心机,上海安亭科学仪器厂制造;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂制造;LGJ-18C冷冻干燥机,北京四环科学仪器厂制造;透析袋(分子截留量8 000~14 000)美国Sigma公司产品。
1.2 试验方法
1.2.1 POP提取率测定
1)葡萄糖标准曲线绘制:采用苯酚-硫酸比色法[15]。
2)POP质量分数测定:采用苯酚-硫酸比色法和二硝基水杨酸(DNS)比色法[15]分别测定总糖和还原糖的质量分数,Mp=Ms-Mr,式中:Mp、Ms和 Mr分别为 POP、总糖、还原糖的质量(mg)。
3)换算因子测定:f=Ms/ρn,式中:f为总糖与葡萄糖的换算因子,Ms为总糖的质量 (mg),ρ为总糖液中葡萄糖的质量浓度 (mg/mL),n为总糖的稀释倍数。
4)多糖提取率计算公式:

式中:Mo为原料的质量(mg)。
1.2.2 提取工艺流程 参照阎欲晓等[16]的方法并有所改进:样品粉末→热水提取→离心过滤→取上清液→浓缩→醇沉→离心过滤→沉淀→透析→离心过滤→上清液→冷冻干燥→POP
1)样品粉末制备:将样品洗净40℃烘干,粉碎过40目筛,体积分数95%乙醇10∶1 mL/g浸泡样品12 h/次,浸泡3次,完成脱脂脱色后,40℃烘干备用。
2)水浴浸提、抽滤:将一定液料比的样品溶液置于水浴锅中恒温浸提,然后4 000 r/min离心40 min,取上清液,将滤渣进行再次浸提。
3)将2次浸提后的上清液合并,将提取液在50℃左右减压浓缩后按乙醇终体积分数70%加入无水乙醇沉淀[16-17],4℃静置24 h,4 000 r/min离心40 min得沉淀物。
4)沉淀物依次用乙醚、丙酮、甲醇各洗涤3次,蒸馏水复溶后用透析袋活水透析3 d,然后4 000 r/min离心40 min,取上清液,冷冻干燥(-40℃,真空度为0.1 MPa,干燥24 h)后即得POP。
1.2.3 提取工艺单因素试验设计 分别考察了提取温度(℃)、提取时间(h)和液料比(mL/g)3 个因子对POP提取率的影响,每个处理重复5次。
1.2.4 POP提取工艺条件优化 在单因素试验的基础上,采用Design Expert 7.1.6统计分析软件中Box-Behnken试验设计原理,设计响应曲面分析试验。各因子编码值见表1。
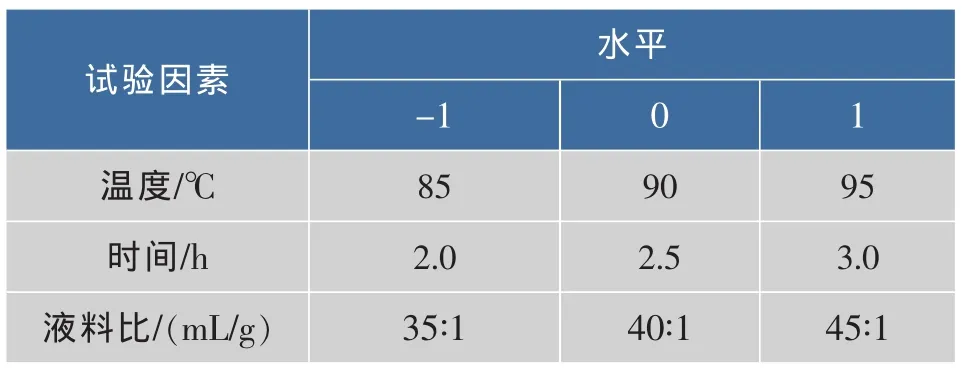
表1 因素水平编码表Tab.1 Independent variables and their levels used in the response surface design
1.2.5 POP的理化性质测定 参照王应强等[18]的方法测定POP的溶解性,进行碘-碘化钾反应,茚三酮反应,斐林试剂反应,三氯化铁反应,双缩脲反应,紫外吸收光谱分析以0.1 mg/mL的POP溶液在190~900 nm范围内扫描。
1.2.6 体外抗氧化性测定
1)清除DPPH·能力:参照 Deng等[19]的方法。 每个处理重复5次。清除率计算公式为
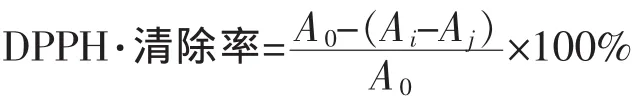
式中,Ai为加入样品反应体系的吸光度;Aj为样品溶液的吸光值;A0为空白对照反应体系的吸光度。以VC为阳性对照。
2)清除H2O2能力:参照付娟等[20]的方法。每个处理重复5次。清除率计算公式为
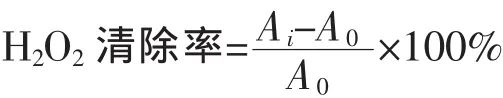
式中,Ai为加入样品反应体系的吸光度;Ao为空白对照反应体系的吸光度。以VC为阳性对照。
3)清除·OH能力:参照Chen等[21]的方法。每个处理重复5次。清除率计算公式为

式中,Ai为加入样品反应体系的吸光度;Aj为未加水杨酸溶液反应体系的吸光度;A0为空白对照反应体系的吸光度。以VC为阳性对照。
4)清除 O2-·能力:采用邻苯三酚自氧化法[22]。 每个处理重复5次。清除率计算公式为:
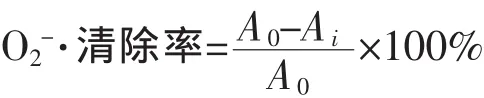
式中,Ai为加入样品反应体系的自氧化速率;Ao为空白对照反应体系的自氧化速率。以VC为阳性对照。
1.2.7 数据处理 采用SPSS-13.0软件计算半抑制浓度(IC50)值。
2 结果与分析
2.1 葡萄糖标准曲线
测得葡萄糖标准曲线的回归方程以及POP对葡萄糖的换算因子分别为:
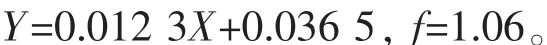
2.2 3种单因素对POP提取率的影响
2.2.1 不同温度的POP提取率变化 见图1(a)。在固定液料比为40∶1 mL/g,提取时间为2.5 h时,随提取温度的上升,POP提取率不断增加,当温度达到90℃时,POP提取率最高。这可能是由于在提取温度较低时物系的传质过程缓慢,多糖提取率变化不大,随着提取温度增高其传质速率大,多糖提取率增大[23]。考虑到实际情况,选择提取温度为90℃。
2.2.2 不同时间的POP提取率变化 见图1(b)。在固定液料比为40∶1mL/g,提取温度为90℃时,当提取时间小于2.5 h时,POP提取率随提取时间的延长而升高,当提取时间大于2.5 h时,POP提取率随提取时间的延长而增加不明显。这可能是由于热水加速细胞吸水膨胀破碎,多糖溶出增多,提取率相应增加,同时细胞的过分破碎使溶解的杂质相应增多,溶剂几乎饱和,阻碍了多糖的溶解,提取率无明显增加[24]。综合考虑提取效率,选择提取时间为2.5 h。
2.2.3 不同液料比的POP提取率变化 见图1(c)。在固定提取温度为90℃,提取时间为2.5 h时,当液料比小于40∶1 mL/g时,POP提取率随液料比的增加而升高,当液料比大于40∶1 mL/g时,POP提取率随液料比的增加而减少。这可能由于提取过程中增加提取液的体积,一方面根据传质规律可以增加多糖的溶出量,另一方面也一定程度稀释了多糖的浓度,在加一定体积倍数乙醇沉淀的过程中不利于多糖沉淀出来,两个方面的作用分别占据主导地位的缘故[25]。所以选择液料比40∶1 mL/g。
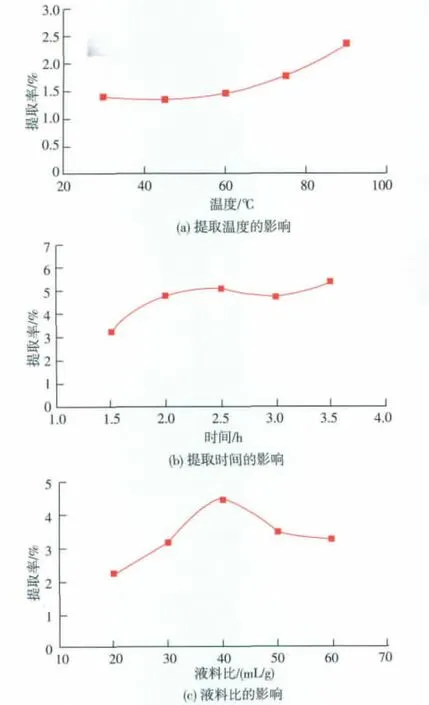
图1 提取温度、提取时间和液料比对POP提取率的影响Fig.1 Effects of different temperatures,times and ratios of water to raw material on extraction yield of POP(Mean±SD;n=5)
2.3 Box-Behnken试验设计及响应曲面分析结果
根据单因素试验结果,选取提取温度、提取时间和液料比3个因素设计响应曲面试验,研究三因素不同组合对POP提取率的影响。试验因素和水平及试验结果见表2。
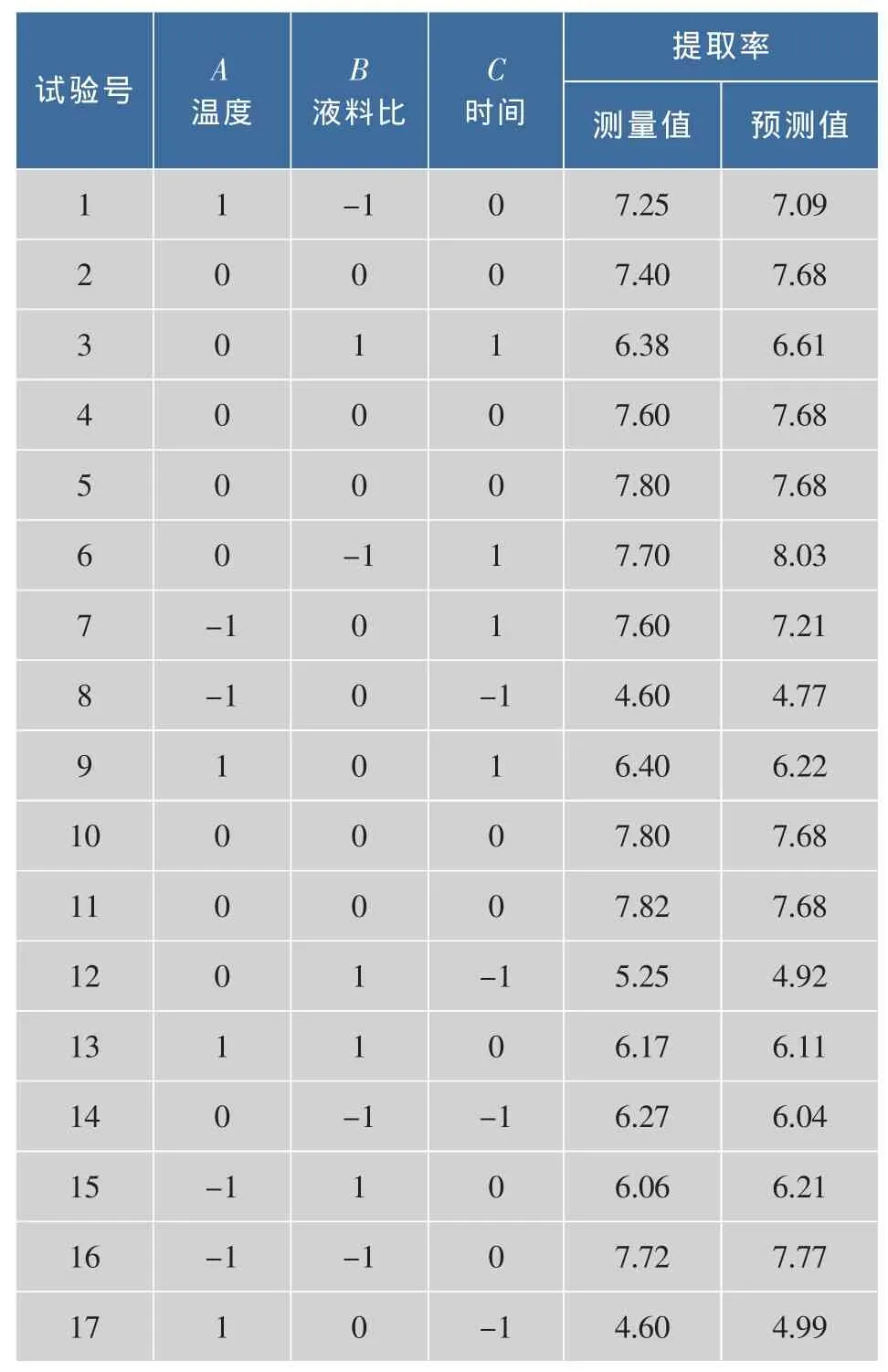
表2 Box-Behnken试验设计及POP提取率的响应曲面值Tab.2 Box-Behnken design matrix and response values for the yield of POP
利用Design Expert 7.1.6软件进行试验结果的数据分析,二次回归拟合得到POP提取率回归方程
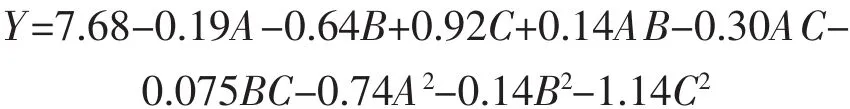
式中,Y为POP的提取率,%;A为提取温度,℃;B为提取时间,h;C为液料比,mL/g。
回归方程项前系数的显著性检验见表3。表中Pr>F值表示大于F值的概率,根据P值判断 (P<0.05),液料比(B)和提取时间(C)对 POP 的提取率有显著性影响,其余交互项等不显著。在实验范围内,三因素对提取率影响程度依次为:提取时间>液料比>提取温度。回归方程的方差分析表明,相关系数平方R2=0.956 8,校正相关系数平方R2Adj=0.901 2,回归方程与实验数据具有一定契合度,可以分析和预测试验数据;模型变异系数CV为5.23,CV值越低表明试验稳定性越好[26]。综上所述,该回归方程可用于描述POP提取工艺的各因素与提取率间的关系。

表3 POP提取参数数学回归分析结果Tab.3 Analysis of variance of the experimental results of the POP
2.4 Box-Behnken试验设计及响应曲面分析结果
根据回归方程,做出响应曲面和等高线,考察所拟合响应曲面的形状,分析液料比、提取温度和提取时间对提取率的影响[27]。 由图 2(a)和 2(b)可知,响应曲面的形状均呈鞍形,相应表现为曲线较为平滑,且随其数值的增加或减少,响应值没有显著性变化,说明液料比对POP提取率影响较小,从等高线偏向的方向可知,提取时间是影响POP提取率的主要因素,提取温度次之。由图2(c)可知,响应曲面的形状呈钟形,相应表现为曲线较陡,随着提取时间的延长和提取温度的升高,POP提取率先增高后缓慢下降,在提取时间为2 h,提取温度90℃左右,POP提取率达最大值。
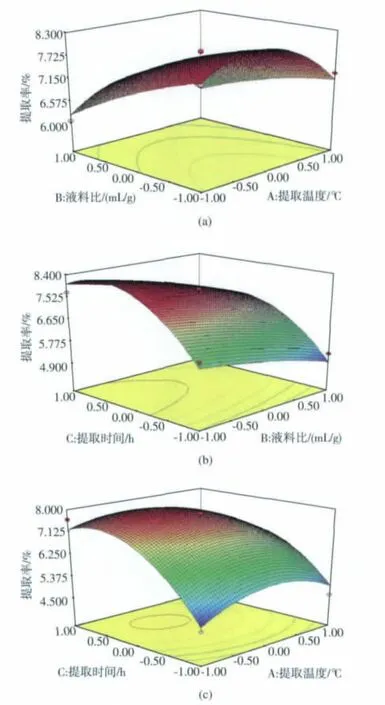
图2 提取时间、提取温度及液料比对POP提取率的响应曲面与等高线Fig.2 Response surface plot and contour plots showing the effect of extracting temperature,time and ratio of liquid to solid on extraction yield of POP
2.5 POP提取工艺条件的确定
通过软件Design-Expert 7.1.6分析得出最优提取工艺条件为:液料比为35∶1,提取温度为88.35℃,提取时间为2.24 h,此时POP的提取率理论预测值为8.47%。考虑到实际操作的可行性,同时又达到节省时间与能耗并取得最佳效果的目的,将POP的提取工艺条件修正为:液料比35∶1,提取温度88℃,提取时间为2.2 h。为检验结果的可靠性,采用修正条件进行提取实验,结果得出POP的实际提取率为(8.46±0.02)%,与理论预测值基本吻合。因此,利用响应曲面分析法得到的POP提取工艺参数真实可靠,具有实用价值。
2.6 POP理化性质测定结果
POP为白色絮状固体,无臭无味,易溶于水,难溶于丙酮、甲醇等有机溶剂;与碘-碘化钾反应不显蓝色,说明POP是非淀粉类多糖;菲林试剂反应、三氯化铁反应和双缩脲反应均为阴性,说明POP不含单糖、多酚和蛋白质;由图3可知,在195 nm处具有明显的多糖吸收峰(POP质量浓度为0.1 mg/mL,A195nm=0.274),在波长260 nm和280 nm处无蛋白质和核酸吸收峰,表明POP主要成分为多糖,不含蛋白质、多肽和核酸。
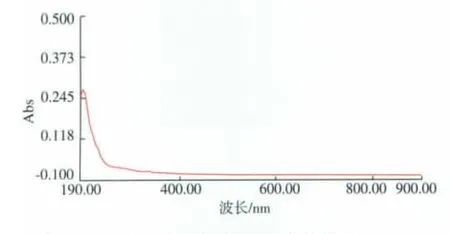
图3 POP的紫外全波长扫描图Fig.3 Ultraviolet spectrumgram of POP
2.7 POP体外抗氧化活性
2.7.1 清除DPPH·能力 DPPH·在有机溶剂中是一种稳定的氮自由基,通过测定与自由基清除剂反应前后吸收减弱的程度,可评价自由基清除剂的活性[19]。POP 对 DPPH·的清除率见图 4(a)。当 POP 质量浓度小于0.50 mg/mL时,对DPPH·的清除率随POP质量浓度的变化较明显,当POP质量浓度大于0.50 mg/mL时,对DPPH·的清除率随质量浓度的增加缓慢增强,当POP质量浓度达到2.50 mg/mL时,对 DPPH·的清除率达到(74.36±0.57)%。由图 4(a)计算出对POP清除DPPH·清除率的IC50值为0.646 mg/mL,大于 VC 的 IC50值(0.048 mg/mL)。
2.7.2 清除H2O2能力 H2O2自身没有什么活性,但它在细胞组织里可以产生·OH,从而对细胞有毒副作用[28]。POP对H2O2的清除率见图4(b)。在0.20~1.20 mg/mL范围内,随着POP质量浓度的升高,清除H2O2自由基能力逐渐增加,两者之间具有明显的量效关系,当POP质量浓度达到1.20 mg/mL时,对H2O2的清除率接近100%。由图4(b)计算出POP清除H2O2的IC50值为0.541 mg/mL,小于VC的 IC50值(0.901 mg/mL)。
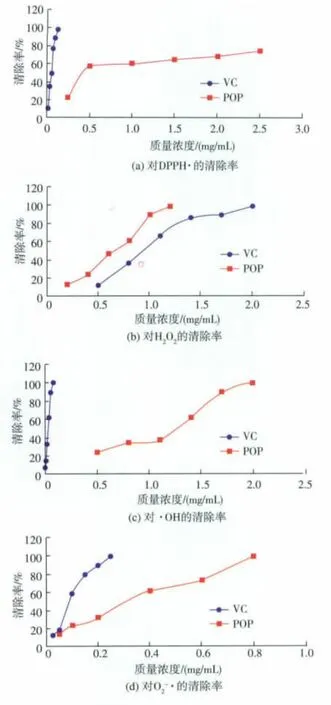
图 4 POP 和 VC 对 DPPH·、H2O2、·OH 和 O2-·的清除率Fig.4 Inhibition effects of POP and ascorbic acid on (a)2,2-diphenyl-2-picrylhydrazyl free radical, (b)hydrogen peroxide, (c)hydroxyl free radical and(d)superoxide anion radical(Mean±SD;n=5)
2.7.3 清除·OH能力 ·OH是人体中最活泼、对机体危害较大的自由基[28]。POP对·OH的清除率见图4(c)。当 POP 质量浓度小于 11.00 mg/mL 时,对·OH的清除率随质量浓度的增加缓慢增强,当POP质量浓度大于11.00 mg/mL时,对·OH的清除率随POP质量浓度的变化较明显,当多糖质量浓度为20.00 mg/mL时,对·OH的清除率接近100%。由图4(c)计算出POP清除·OH的IC50值为10.029 mg/mL,大于VC 的 IC50值(0.238 mg/mL)。
2.7.4 清除O2-·能力 O2-·的形成是氧毒性的主要因素之一[28]。 POP 对 O2-·的清除率见图 4(d)。 在0.05~0.80 mg/mL范围内,随着POP质量浓度的升高,清除O2-·自由基能力逐渐增加,两者之间具有明显的量效关系,当POP质量浓度达到0.80 mg/mL时,对 O2-·的清除率接近 100%。 由图 4(d)计算出POP 清除 O2-·的 IC50值为 0.241 mg/mL,大于 VC 的IC50值(0.078 mg/mL)。
4 结语
应用响应曲面分析法优化了玉竹水溶性POP的提取工艺。玉竹水溶性POP提取的最佳提取工艺参数为:液料比35∶1,提取温度88℃,提取时间为2.2 h。在此优化条件下,玉竹水溶性POP实际提取率为(8.46±0.02)%。
动物机体在新陈代谢的过程中,O2-·、·OH、H2O2等自由基的消除主要依赖于机体完整的抗氧化防御系统的预防性或阻断性控制。促进或增强自由基的消除,可通过减少脂质过氧化物及其降解产物的产生,增强机体的抗氧化能力。以清除自由基的效率等项目为检测指标,从离体或整体水平上来衡量多糖抗氧化作用的大小[28]。阎欲晓[16]等研究发现,不同相对分子质量的玉竹多糖对自由基清除能力是不同的,质量分数70%醇沉多糖对O2-·和·OH的抑制效果最好。本实验结果表明,POP对DPPH·、H2O2、·OH 和 O2-·自由基均有一定的清除活性,相比之下对H2O2清除活性尤其明显,而且相同质量浓度下POP对H2O2的清除活性明显高于VC。
超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)是机体内相关的抗氧化酶,其活力高低间接反映了机体清除自由基的能力,丙二醛(MDA)是脂质过氧化物(LPO)氧化形成的终产物,机体内MDA的水平可直接反映机体脂质受活性氧自由基攻击的损害程度[28]。单颖等[8-9,12]研究发现,玉竹多糖能通过提高衰老模型小鼠血清SOD活性,增强其对自由基的清除能力,抑制脂质过氧化,降低丙二醛含量,从而减轻对机体组织的损伤以延缓衰老;同时玉竹多糖可明显改善衰老模型小鼠的细胞及体液免疫功能,提高胸腺指数和脾指数,增加脾T、B淋巴细胞转化刺激指数和CD8+细胞的数量,恢复CD4+/CD8+比值的失衡状态,从而延缓机体的免疫衰老。谢建军等[11]研究发现,玉竹多糖预处理呈计量依赖性地降低糖尿病大鼠血糖浓度和胰腺组织MDA含量,增强SOD、GSH-Px、CAT活性。以上研究结果提示玉竹多糖的抗氧化作用可能是其免疫调节和降血糖的作用机制之一。
[1]国家药典委员会.中华人民共和国药典:一部[M].2010版,北京:化学工业出版社,2010:78-79.
[2]彭秧锡,刘士军,郭军,等.玉竹的研究开发现状与展望[J].食品研究与开发,2005,26(6):120-122.PENG Yang-xi,LIU Shi-jun,GUO Jun,et al.Present situation and perspective of Polygonatum odoratum (Mill.) Druce product research and development[J].Food Research and Development,2005,26(6):120-122.(in Chinese)
[3]林厚文,韩公羽,廖时董.中药玉竹有效成分研究[J].药学学报,1994,29(3):215-222.LIN Hou-wen,HAN Gong-hou,LIAO Shi-dong.Studies on the active constituents of the Chinese traditional medicine Polygonatum odoratum(Mill.) Druce[J].Acta Pharmaceutica Sinica,1994,29(3):215-222.(in Chinese)
[4]ZHANG Hong,YANG Fan,QI Jin,et al.Homoisoflavonoids from the fibrous roots of Polygonatum odoratum with glucose uptakestimulatory activity in 3T3-L1 adipocytes[J].Journal of Natural Products,2010,73(4):548-552.
[5]竺平晖,陈爱萍.GC-MS法对湖南产玉竹挥发油成分的分析研究[J].中草药,2010,41(8):1264-1265.ZHU Ping-hui,CHEN Ai-ping.Analysis of volatile oils of Polygonatum odoratum from Hunan by GC/MS[J].Chinese Traditional and Herbal Drugs,2010,41(8):1264-1265.(in Chinese)
[6]YANG Yun,XU Huai-long,ZHANG Zi-ting,et al.Characterization,molecular cloning,and in silico analysis of a novel mannose-binding lectin from Polygonatum odoratum (Mill.) with anti-HSV-II and apoptosis-inducing activitiez[J].Phytomedicine,2011,18(8-9):748-55.
[7]秦海林,李志宏,王鹏,等.中药玉竹中新的次生代谢产物[J].中国中药杂志,2004,28(1):42-44.QIN Hai-lin,LI Zhi-hong,WANG Peng,et al.The new secondary metabolite from Polygonatum odoratum[J].China Journal of Chinese Materia Medica,2004,28(1):42-44.(in Chinese)
[8]单颖,潘兴瑜,姜东,等.玉竹多糖抗衰老的实验观察[J].中国临床康复,2006,10(3):79-81.SHAN Ying,PAN Xing-yu,JIANG Dong,et al.Experimental observation on the effect of Polygonatum odoratum polysaccharide on anti-aging[J].Chinese Journal of Clinical Rehabilitation,2006,10(3):79-81.(in Chinese)
[9]单颖,潘兴瑜,姜东,等.玉竹多糖干预后衰老模型鼠抗氧化系统及免疫功能的变化[J].中国临床康复,2006,10(11):135-137.SHAN Ying,PAN Xing-yu,JIANG Dong,et al.Effect of Polygonatum odoratum polysaccharide on anti-oxidation system and immunological function of senile mice[J].Chinese Journal of Clinical Rehabilitation,2006,10(11):135-137.(in Chinese)
[10]杨敏,蒙义文.大玉竹低聚糖硫酸酯抗HSV-2病毒活性的研究[J].应用与环境生物学报,2000,6(5):483-486.YANG Min,MENG Yi-wen.Study on antivirus activity of sulfated Polygonatum odoratum oligosaccharide[J].Chinese Journal of Applied and Environmental Biology,2000,6(5):483-486.(in Chinese)
[11]谢建军,王长松,胡蔓菁.玉竹多糖预处理对糖尿病大鼠胰岛β细胞损伤的影响 [J].中国医院药学杂志,2010,30(14):1200-1203.XIE Jian-jun,WANG Chang-song,HU Man-jing.Influence of pretreatment with Polygonatum odoratum polysaccharides on pancreatic β-cell damage in alloxan-induced diabetes in rats[J].Chinese Journal of Hospital Pharmacy,2010,30(14):1200-1203.(in Chinese)
[12]单颖,姜东,潘兴瑜,等.玉竹多糖对衰老模型鼠细胞及体液免疫功能的影响[J].中国临床康复,2006,10(19):146-148.SHAN Ying,JIANG Dong,PAN Xing-yu,et al.Immune effect of Polygonatum odoratum polysaccharide on aging model mice[J].Chinese Journal of Clinical Rehabilitation,2006,10(19):146-148.(in Chinese)
[13]Tomoda M,Yoshida Y,Tanaka H,et al.Plant Mucilages. Ⅱ .1)Isolation and characterization of a mucous polysaccharide,"Odoratan,"from Polygonatum odoratum var.japonicum rhizomes[J].Chemical&Pharmaceutical Bulletin,1971,19(10):2173-2177.
[14]Tomoda M,Satoh N,Sugiyama A.Isolation and characterization of fructans from Polygonatum odoratum var.japonicum rhizomes[J].Chemical&Pharmaceutical Bulletin,1973,21(8):1806-1810.
[15]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2003:10-12.
[16]阎欲晓,石庆师.玉竹多糖分离纯化及自由基清除能力研究[J].食品工业科技,2009,30(2):149-151.YAN Yu-xiao,SHI Qing-shi.Study on separation,purification and scavenging free radical of polysaccharide in Polygonatum odoratum[J].Science and Technology of Food Industry,2009,30(2):149-151.(in Chinese)
[17]王强,李盛钰,杨帆,等.玉竹中性多糖的分离纯化及单糖组成分析[J].食品科学,2010,31(15):100-102.WANG Qiang,LI Sheng-yu,YANG Fan,et al.Isolation,purification and monosaccharide analysis of a neutral polysaccharide from Polygonatum odoratum(Mill) Druce[J].Food Science,2010,31(15):100-102.(in Chinese)
[18]王应强.丹参糖蛋白的分离纯化与生物活性研究[D].西安:陕西师范大学,2007.
[19]DENG Peng,ZHANG Gu-quan,ZHOU Bo,et al.Extraction and in vitro antioxidant activity of intracellular polysaccharide by Pholiota adiposa SX-02[J].Journal of Bioscience and Bioengineering,2011,111(1):50-54.
[20]付娟,边静静,赵桦.密楝和吴茱萸果实多糖的体外抗氧化和抑菌活性研究[J].食品科学,2010,31(11):69-72.FU Juan,BIAN Jing-jing,ZHAO Hua.In vitro antioxidant and antimicrobial activity of polysaccharides extracted from the fruits of Evodia lenticellata Huang and Evodia rutaecarpa(Juss.) Beth[J].Food Science,2010,31(11):69-72.(in Chinese)
[21]CHEN Hui,XU Xiang-qun,ZHU Yang.Optimization of hydroxyl radical scavenging activity of exopolysaccharides from Inonotus obliquus in submerged fermentation using response surface methodology[J].Journal of Microbiology and Biotechnology,2010,20 (4):835-843.
[22]何钊,冯颖,孙龙,等.黄粉虫多糖响应面法提取及抗氧化活性[J].食品与生物技术学报,2011,30(5):641-647.HE Zhao,FENG Ying,SUN Long,et al.Optimization of extraction process by using response surface methodology and antioxidant activity of polysaccharide from yellow mealworm[J].Journal of Food Science and Biotechnology,2011,30(5):641-647.(in Chinese)
[23]张珏,张志才,王玉红,等.灵芝菌丝体碱提水溶性多糖工艺条件及对羟自由基的清除作用 [J].食品与生物技术学报,2005,24(3):98-100.ZHANG Jue,ZHANG Zhi-cai,WANG Yu-hong,et al.Studies on water soluble polysaccharides from the mycelia of Ganoderma lucidun by alkaline extraction[J].Journal of Food Science and Biotechnology,2005,24(3):98-100.(in Chinese)
[24]上官新晨,陈木森,蒋艳,等.微波提取青钱柳多糖的研究[J].食品与生物技术学报,2007,26(5):6-9.SHANG-GUAN Xin-chen,CHEN Mu-sen,JIANG Yan,et al.Microwave-assisted extraction of polysaccharide from Cyclocarya paliurus(Batal) Ijinskaja[J].Journal of Food Science and Biotechnology,2010,29(1):56-60.(in Chinese)
[25]GUO Xia,ZOU Xiang,SUN Min.Optimization of extraction process by response surface methodology and preliminary characterization of polysaccharides from Phellinus igniarius[J].Carbohydrate Polymers,2010,80(2):344-349.
[26]HOU Xu-jie,CHEN Wei.Optimization of extraction process of crude polysaccharide from wild BaChu mushroom by response surface methodology[J].Carbohydrate Polymers,2008,72(1):67-74.
[27]ZHU Tao,HEO H J,ROW K H.Optimization of crude polysaccharides extraction from Hizikia fusiformis using response surface methodology[J].Carbohydrate Polymers,2010,82(1):7106-110.
[28]FINKEL T,HOLBROOK N J.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408(6809):239-247.
