急性重症胰腺炎脏器损伤及病理学基础研究
2013-01-11李苗苗李金鑫王晓晔
李苗苗 李金鑫 王晓晔
(天津市儿童医院微创外科,天津 300074)
急性重症胰腺炎(severe acute pancreatitis,SAP)在近几年来发生率越来越高,发病过程中除胰腺出血坏死外可并发肺脏、肾脏、肝脏、肠管、心脏等脏器功能障碍[1]。如休克、ARDS、ARF、败血症、肺炎、糖尿病、血栓性静脉炎及DIC等,病死率极高,常合并多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS),目前MODS公认的发病机制有:1.微循环障碍2.组织细胞代谢障碍3.细胞因子及炎性介质过度释放4.肠道细菌与内毒素异位。SAP引起的MODS发病机制有其独特的特点:由于胰腺自身的消化造成的胰腺损伤,导致各种胰酶入血并相继激活,其中其主要作用的胰酶有:胰蛋白酶[2]、磷脂酶A2、激肽释放酶、弹性蛋白酶和脂肪酶,上述胰酶入血首先接触并消化的是全身各器官的血管内皮细胞,导致血管通透性增加,随即胰酶通过血管内皮进入各器官,引起各器官的损伤并进一步引起各种炎症反应[3],由此可见,SAP引发MODS的发病机制中胰酶对血管内皮的损伤是关键环节。
本实验用经十二指肠进入胰胆管逆行注射牛磺胆酸钠方法制作急性重症胰腺炎模型,通过血清生化学检测及病理学证实SAP发病过程中各主要脏器血的损伤,通过流式细胞仪动态观察SAP大鼠不同时间点静脉血脱落血管内皮细胞的相对数变化,探讨SAP导致MODS时血管内皮损伤的发病机制。
1 材料和方法
1.1 实验分组
将90只SD雄性大鼠,随机分为2组:假手术(SO)组、模型(SAP)组,每组45只。每组随机分为3h组、6h组、12h组3个时间组,每时间组15只,各个时间点处死相应时间组大鼠并收集标本。
1.2 急性重症胰腺炎大鼠模型的制备方法
术前大鼠禁食12 h, SAP组用10%水合氯醛0.3 ml/100 g腹腔注射麻醉大鼠[4],行上腹部剑突下正中切口(1~2 cm)、进腹,提起十二指肠,辨认胰胆管及肝门部胆总管,用动脉夹夹闭胆总管近肝门处,于十二指肠降部找到胰胆管开口,用静脉留置针在对侧肠壁上选一无血管区进针,找到并进入十二指肠大乳头,缓慢推进4~5 mm,确定针头在胰胆管内后,拔出针芯,轻压十二指肠大乳头,注入5%牛磺胆酸钠(0.1 ml/100 g,0.2 ml/min)[5],注射完毕后用手压迫进针处3 min,可见胰腺充血、水肿。去除动脉夹,将肠管复位,分层关腹。SO组仅找到十二指肠及胰腺翻动几次后关腹。实验大鼠手术后均禁食禁饮,背部皮下注射生理盐水补液(40 ml/kg体重)[6]。
1.3 观察实验动物存活率
观察两组实验动物精神状况、呼吸状况、死亡时间、死亡数量,观察12 h。
1.4 血清淀粉酶、白蛋白、肝肾功能及静脉血脱落血管内皮细胞的测定
两组于造模成功后3 h、6 h、12 h各取相应组大鼠,用10%水合氯醛0.3 ml/100 g腹腔注射麻醉大鼠,股静脉取血2~3 ml,用全自动生化分析仪检测大鼠血清淀粉酶、白蛋白及肝肾功能;取血1 ml置于EDTA抗凝管中用于流式细胞仪检测脱落血管内皮细胞数。
1.5 各器官病变观察及组织病理学观察评分
两组于造模成功后3 h、6 h、12 h各取相应组大鼠,解剖并剪取相同部位的胰腺、心脏、肝脏、肺脏、肾脏、小肠、胸主动脉组织,分别放入盛有10 福尔马林的小瓶中固定,做石蜡切片,每例均进行苏木精-伊红(HE)染色。倒置显微镜下观察,拍照。分别用低倍镜(100倍)和高倍镜(200倍)观察,每个器官取2张切片,每张切片随机取5个视野。胰腺病理学评分参照Schmidt[7]评分。
1.6 病理组织HE染色
每组动物模型术后组织取材用10%福尔马林固定,修剪病理组织后于脱水机脱水,石蜡包埋,在切片机上常规切片,89℃烤箱过夜后常温保存。行HE染色。
1.7 统计学处理
2 结 果
2.1 实验动物术后状态与存活率观察结果
SAP组大鼠苏醒后,呈腹部屈曲体位,竖毛,精神差,活动差。SP组大鼠苏醒后,呈腹部屈曲体位,无异常活动。SO大鼠术后12h无一死亡,生存率100%,SAP组大鼠死亡10只(3h组死亡2只,6h组死亡3只,12h组死亡5只),存活率78%。SAP组存活率明显低于SO组,P<0.01。
2.2 血清淀粉酶测定结果
SAP组大鼠术后3h、6h、12h血清淀粉酶水平均高于SO组,差异有统计学意义(P<0.01),见表1。 SAP组血淀粉酶水平在术后出现逐渐升高的趋势。
肝肾功能选取AST、ALT、BUN、Cre为观察指标,具体数据见表2~5。SAP组大鼠与SO组相比, 各时间点AST、ALT、BUN、Cre水平均明显增高,差异有统计学意义(P<0.01)。随病程延长,SAP组大鼠AST、ALT、BUN、Cre水平逐渐增高。
2.3 两组大鼠静脉血脱落血管内皮细胞相对计数
SAP组大鼠术后3h、6h、12h静脉血血管内皮细胞相对数与SO组对比明显增高,差异有统计学意义(P<0.01),见表7。

表1 两组大鼠血清淀粉酶水平
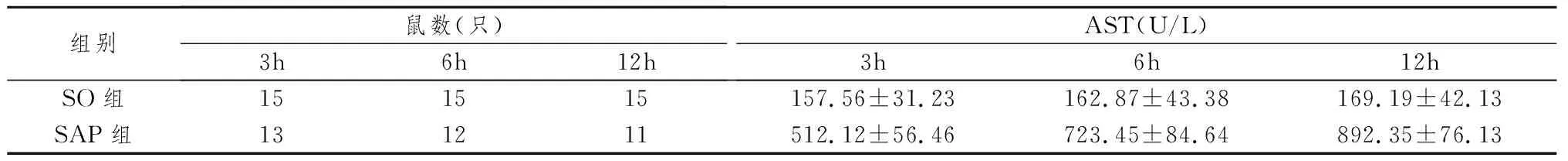
表2 两组大鼠血清AST水平
注:各时间点两组大鼠AST水平比较P<0.01。

表3 两组大鼠血清ALT水平
注:各时间点两组大鼠ALT水平比较P<0.01。

表4 两组大鼠血清BUN水平
注:各时间点两组大鼠BUN水平比较P<0.01 。

表5 两组大鼠血清Cre水平
注:各时间点两组大鼠Cre水平比较P<0.01。

表6 两组大鼠血清白蛋白水平
与SO组比较,*P<0.05,#P>0.05

表7 两组大鼠脱落血管内皮细胞相对计数
注:各时间点两组大鼠Cre水平比较P<0.01
2.4 脱落血管内皮细胞与血清淀粉酶的相关性及回归分析
将SAP组大鼠不同时间点的脱落血管内皮细胞相对数与血清淀粉酶的水平分别作为x变量和y变量,绘制散点图,随着脱落VEC的增加,AMY水平逐渐增加,两者之间有明显的正相关,用SPSS13.0统计软件Spearman相关分析的相关系数r=0.849,P<0.01, 如图1散点图所示。用SPSS13.0统计软件行直线回归分析得直线回归方程Y=5.495+0.006x, F=87.9,P<0.01。

图1 SAP组各时间点脱落血管内皮细胞数与AMY散点图
2.5 脱落血管内皮细胞与胰腺病理评分的相关性及回归分析
将SAP组各时间点胰腺病理Schmidt评分与脱落血管内皮细胞数分别作为x变量和y变量,绘制散点图,两者之间有明显的正相关,用SPSS13.0统计软件Spearman相关分析的相关系数r=0.842,P<0.01,散点图如图2所示。用SPSS13.0统计软件行直线回归分析得直线回归方程Y=21.227+4.837x, F=82.843,P<0.01。
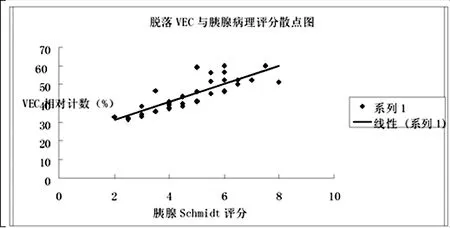
图2 SAP组大鼠各时间点胰腺病理评分与脱落血管内皮细胞数散点图
2.6 各器官病理组织学观察
2.6.1胰腺及各主要脏器大体外观观察
SO组:腹腔内有少许淡黄色腹水,余脏器未见肉眼可辨病理改变。SAP组:模型诱导后5分钟胰腺呈现广泛被膜下出血水肿以胰腺体尾部为明显;3小时后胰腺组织轮廓消失,呈粘冻状的出血坏死改变,腹水呈淡红色,6、12小时组胰腺组织广泛出血坏死,范围扩大,胰腺周围大网膜及腹膜有较多皂化斑点,腹腔内大量血性腹水。肝脏组织3小时呈明显淤血水肿改变,6、12小时肝脏色泽苍白浑浊,部分大鼠肝脏边缘可见散在不规则灰色斑块及坏死表现。肾脏早期变化不明显,6、12小时段呈明显肿胀,部分大鼠肾包膜表面有散在出血点,肾周脂肪皂化。肺脏早期呈充血水肿,后期肺脏组织呈淡红色,部分可见较多散在出血点,胸腔内有淡黄色或血性胸水。
2.6.2胰腺及各主要脏器镜下病理观察
模型组:胰腺:细胞肿胀、细胞器崩解以及蛋白质变性是细胞坏死的基本表现,而细胞核的固缩、碎裂、溶解又是典型表现,间质小血管壁坏死,胰腺间质出现炎性细胞浸润,灶状或片状细胞坏死,呈现核固缩、破碎,胞质疏松、淡染,细胞界限不清,病变严重程度随造模后时间延长而加重。
肺脏:可见肺间质及肺泡腔水肿,肺小血管周围可见炎性细胞浸润,毛细血管扩张淤血;6、12小时组支气管周围较多炎性细胞浸润,肺组织结构紊乱,肺泡腔部分融合成肺大泡,部分萎缩,毛细血管坏死,肺泡壁可见散在红细胞。
肝脏:3小时组多数以肝脏细胞充血水肿伴炎性细胞浸润为主,后期可见局灶性或不规则片状出血坏死,部分为凝固性坏死,肝窦及汇管区周围大量炎性细胞浸润及散在红细胞。肾脏:可见肾小球毛细血管淤血,肾小管上皮细胞散在坏死及间质水肿,炎症细胞浸润;6、12小时组随着时间的延长,坏死面积逐渐扩大,肾小囊内出现嗜伊红染色絮状物和红细胞,肾小管内可见均质管形和红细胞管型,小部分出现肾小管上皮细胞片状坏死。
小肠:可以看到肠黏膜充血水肿、间质水肿伴炎症细胞浸润,肠绒毛部分肠黏膜上皮细胞变性坏死、脱落,黏膜出血。主动脉:可见平滑肌间质水肿,细胞肿胀,排列紊乱,肌纤维管腔面血管内皮细胞连续性减低。
心脏:心肌细胞肿胀,排列紊乱,点片状坏死,炎性细胞浸润,心肌纤维呈局灶性嗜酸变性及坏死,横纹肌模糊或消失,纵行肌纤维断裂,病变心肌呈带状或灶性分布,心肌间质血管扩张瘀血,血窦扩张。
SAP组大鼠各器官病理切片的共同特点为:血管内皮细胞坏死、脱落,血管壁破裂、出血,血管周围炎性细胞浸润,各组织细胞溶解坏死,组织结构紊乱。
假手术组:除部分胰腺腺泡细胞水肿及肺脏支气管周围炎性细胞浸润外其余脏器细胞未见异常改变。
2.6.3两组大鼠胰腺病理Schmidt 评分
SAP组大鼠术后3h、6h、12h胰腺病理评分与SO组大鼠相比显著增高,差异有统计学意义,P<0.01。见表8。

表 8 两组大鼠胰腺病理Schmidt 评分
注:各时间点两组大鼠病理评分比较P<0.01
3 结 论
SAP大鼠各组织器官存在血管内皮细胞损伤,并出现外周血脱落血管内皮细胞增多。脱落血管内皮细胞数量与胰腺病理损伤及淀粉酶水平呈正相关。
SAP时胰蛋白酶入血,首先损伤血管内皮细胞,并使血管内皮细胞脱落,血管通透性增加,导致胰酶透过血管内皮进入组织,引起细胞溶解坏死并引发炎症反应,造成多器官功能障碍综合征。因此脱落血管内皮细胞增多是预测早期MODS的可靠指标之一。
目前,国内外关于急性重症胰腺炎的治疗主要有以下几方面:(1)抑制胰液分泌,主要药物有生长抑素、奥曲肽;(2)抑制胰酶活性,主要药物有乌司他丁、加贝脂、抑肽酶等;(3)抑制胃酸分泌,主要为H2受体拮抗剂和H+-K+-ATP酶抑制剂;4.应用抗菌药物预防感染;5.改善微循环及营养支持;6.血液透析治疗[8];7.手术引流胰周坏死组织,减少坏死物质吸收[9]。但在临床实践中,首诊SAP患者往往已经进入MODS早期,即激活的胰蛋白酶已经进入血液循环并损伤血管内皮屏障,此时,上述治疗方案中用于抑制胰酶分泌的措施不能终止已释放入血的胰酶对组织的损伤,同时血液透析及抑制炎症反应药物只能抑制炎症反应的"瀑布样反应"[10,11],不能从根本上抑制胰酶对各组织器官的进一步损伤。手术治疗也只是起到引流坏死物质,减少炎症物质吸收的作用[12,13]。因此,在SAP治疗过程中,需要进一步探讨出新的药物能拮抗胰蛋白酶对血管内皮细胞的损伤作用,从而达到保护血管内皮细胞更好治疗急性重症胰腺炎。
[1] Pelichovska M, Cvachovec K, Hoch J. intensive care for patients with severe acute pancreatitis with a significant multiorgan dysfunction〗 [J]. Rozhl Chir, 2004,83(9):443-450.
[2] Keck T, Friebe V, Warshaw AL, et al. Pancreatic proteases in serum induce leukocyte-endothelial adhesion and pancreatic microcirculatory failure [J]. Pancreatology, 2005,5(2-3):241-250.
[3] Bhatia M, Saluja AK, Singh VP, et al. Complement factor c5a exerts an anti-inflammatory effect in acute pancreatitis and associated lung injury[J]. Am J Physiol Gastrointest Liver Physiol, 2001,280(5):G974-978.
[4] Cosen-Binker LI, Binker MG, Negri G, et al. Acute pancreatitis possible initial triggering mechanism and prophylaxis[J]. Pancreatology, 2003,3(6):445-456.
[5] Hegyi P, Rakonczay Z, Jr., Sari R, et al. L-arginine-induced experimental pancreatitis[J]. World J Gastroenterol, 2004,10(14):2003-2009.
[6] Bohus E, Coen M, Keun HC, et al. Temporal metabonomic modeling of l-arginine-induced exocrine pancreatitis [J]. J Proteome Res, 2008,7(10):4435-4445.
[7] Williams B, Baker AQ, Gallacher B, et al. Angiotensin ii increases vascular permeability factor gene expression by human vascular smooth muscle cells [J]. Hypertension, 1995,25(5):913-917.
[8] Yang C, Guanghua F, Wei Z, et al. Combination of hemofiltration and peritoneal dialysis in the treatment of severe acute pancreatitis [J]. Pancreas, 2010,39(1):16-19.
[9] Mier J, Leon EL, Castillo A, et al. Early versus late necrosectomy in severe necrotizing pancreatitis [J]. Am J Surg, 1997,173(2):71-75.
[10] Wig JD, Bharathy KG, Kochhar R, et al. Correlates of organ failure in severe acute pancreatitis[J]. JOP, 2009,10(3):271-275.
[11]Zhu Y, Yuan J, Zhang P, et al. Adjunctive continuous high-volume hemofiltration in patients with acute severe pancreatitis: A prospective nonrandomized study [J]. Pancreas, 2011,40(1):109-113.
[12]Malangoni MA, Martin AS. Outcome of severe acute pancreatitis[J] Am J Surg, 2005,189(3):273-277.
[13]Lefter LP, Dajbog E, Scripcariu V, et al. Safety and efficacy of conservative management in acute severe pancreatitis[J]. Chirurgia (Bucur), 2006,101(2):135-139.
