甲状腺良性结节L-T4抑制性治疗的研究
2013-01-11韩静静吴艺捷
韩静静 吴艺捷
(泰山医学院附属医院内分泌科,山东 泰安 271000;上海交通大学医学院附属第一人民医院,上海 200080)
甲状腺良性结节是内分泌临床的常见、多发病,文献报道可触及的甲状腺结节患病率为4~7%,而采用高频率的超声检查,甲状腺结节的患病率明显上升,有报道大于50%[1]。临床上对于除需手术治疗的良性结节,常采取定期随访、补充碘、L-T4抑制性治疗、放射性碘、经皮酒精注射和激光光凝术等多种治疗方法[2]。虽然临床采用L-T4抑制性治疗较常用,但对其疗效、影响因素及不良反应等方面仍存在争议。本研究旨在进一步评价L-T4抑制性治疗良性甲状腺结节的疗效、量效关系、疗效影响因素及不良反应等,为提高甲状腺疾病的诊治水平提供临床依据。
1 对象和方法
1.1 对象
选择在上海交通大学医学院附属第一人民医院就诊的经甲状腺细针穿刺(FNA)细胞学检查证实为良性甲状腺结节的患者450例为研究对象。女性373例,男性77例;年龄16~87岁,平均年龄55.7±13.4岁。
1.2 方法
入选患者分为L-T4抑制性治疗组和对照组。(1)非巨大结节>20mm、TSH>1mIU/L、ECT非热结节、FNA提示良性结节、无严重心脏疾病及同意接受治疗者给予L-T4抑制性治疗为治疗组。予L-T4口服,起始剂量根据初始TSH水平决定,定期复查甲状腺功能,根据结果调整药物用量,直至TSH达到0.3-0.4mIU/L。(2)对照组未予药物治疗。分别于治疗后3、6、9、12月时随诊甲状腺功能和超声结节大小的变化、计算有效率(最大结节容积缩小≥50%)、不良反应发生率。将随访至12月份时治疗组患者分为有效组、无效组,采用单因素分析比较两组在年龄、性别、病程、TSH、TPOAb(甲状腺过氧化物酶)、Tg(甲状腺球蛋白)、细胞病理学类型、B超结节性状和L-T4治疗量等的差异,并根据单因素分析结果,以有统计学意义的变量为自变量,采用逐步回归分析的方法,探讨影响L-T4抑制性治疗疗效的因素。
甲状腺功能检测:检测设备为法国IMMUNOTECH公司试剂盒,检测方法为放射免疫试验法(RIA)。
甲状腺B超:甲状腺超声扫描采用美国ATL公司HDI5000彩色多普勒超声诊断仪,探头频率为5~12MHz,患者取仰卧位,充分暴露颈部,常规探查甲状腺两叶及峡部。
公式:甲状腺结节计算公式(ml):长×宽2×π/6×1000(长、宽的单位为cm)
△TSH=治疗前TSH-治疗后TSH(单位为mIU/L)
△FT3=治疗前FT3-治疗后FT3(单位为pmol/L)
△FT4=治疗前FT4-治疗后FT4(单位为pmol/L)
△TPOAb=治疗前TPOAb-治疗后TPOAb(单位为U/mL)
△Tg=治疗前Tg-治疗后Tg(单位为U/mL)
1.3 统计学处理
应用SPSS统计软件包(SPSS 16.0版本)进行统计分析。结果用均值±标准差表达,计量参数的两样本间均数差异的比较采用t检验,单因素分析用t检验。原始数据为正态分布的用t检验,非正态分布的用非参数检验。计数参数的两样本间差异的比较用χ2检验、校正检验χ2或Fisher′s确切概率检验,多因素分析用Logistic回归分析。P<0.05有统计学意义。
2 结 果
2.1在2007年1月~2009年9月间有450例证实为良性结节的患者,治疗组315例,对照组135例。结果治疗组在3、6、9、12月时最大结节容积较基线值缩小,而对照组6、9、12月时最大结节容积与基线值比较则呈现增大趋势(见图1)。治疗组在治疗3、6、9、12月时治疗有效率分别为9.9%、28.8%、46.5%、48.3%,而对照组除3月时有3例(4.3%)患者出现最大结节容积缩小≥50%,余随访时间均未观察到结节明显缩小者。大于60岁的患者服用L-T4后易发生心悸、失眠。体重变化无统计学差异。
2.2治疗组在治疗12月时有效组152例,无效组163例。比较两组相关参数,结果TSH被抑制水平较低(<0.43mIU/L)、结节含大量胶质、基线结节容积较小(<0.53ml)患者治疗效果较好,而病理上皮细胞为主,B超提示结节钙化者治疗效果欠佳,以上指标有效组与无效组间相比两组差异有统计学意义(P<0.05)。而年龄、性别、病程、L-T4剂量、△TSH、FT3、△FT3、FT4、△FT4、Tg、△Tg、TPOAb、△TPOAb、病理淋巴细胞为主、病理含铁血红素细胞为主、液化两组差异无统计学意义。两组进行多因素Logistic回归分析,按回归系数从大到小依次排列为TSH抑制值、钙化、含大量胶质。图2为最大结节直径与TSH的关联图,可见随着TSH的降低,结节直径缩小。
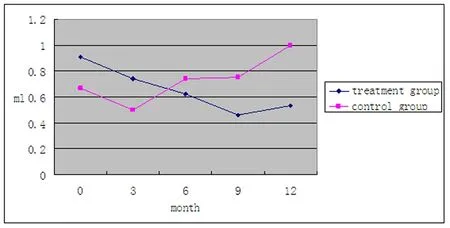
图1 最大甲状腺结节容积随时间变化

图2 最大结节直径与TSH的关联
3 讨 论
L-T4应用于治疗甲状腺结节已有50年的历史,但是关于L-T4疗效、疗效的影响因素、不良反应等仍存在争议。
大多数研究提示L-T4抑制性治疗为有效的治疗方法,TSAI等[3]对60例非毒性良性甲状腺结节进行了为期6个月的随机双盲对照研究,治疗组TSH被抑制到<0.3mIU/L,结果36.7%接受L-T4抑制性治疗的患者甲状腺结节体积下降达50%与对照组相比有显著性差异,提示L-T4抑制性治疗是治疗甲状腺结节的有效方法。但另一些研究则认为L-T4抑制性治疗疗效欠佳,Papini等[4]将甲状腺结节体积>5ml,细胞病理学证实为良性结节的62例甲状腺良性结节患者随机分成:PLA组即经皮甲状腺结节激光切除术、L-T4组及随访组,进行了为期12个月的前瞻性随机对照研究。其中L-T4组L-T4的剂量为1.5ug/Kg?d,TSH抑制至<0.3uIU/ml。结果PLA组甲状腺结节的体积显著减小(△体积=-5.2±3.1ml),33.3%患者甲状腺结节体积减小>50%。而L-T4组甲状腺结节体积无显著性缩小(△体积=-0.6±2.3ml),无甲状腺结节体积减小>50%者,随访组甲状腺结节体积无显著性增大(△体积=+0.7±2.2ml),无甲状腺结节体积减小>50%者。其中L-T4组与随访组两组差异无统计学意义。该研究提示体积较大的甲状腺结节对L-T4抑制性治疗的疗效欠佳。本研究显示结节最大容积在治疗组中明显缩小而在对照组中则有增大趋势,两组治疗前后结节容积变化差异有统计学意义(P<0.05)。
甲状腺结节的细胞学类型可影响L-T4抑制性治疗的疗效,例如富含胶质、退行性变结节的疗效较好,而增生和纤维化的结节疗效较差[5]。结节大小也是影响因素之一[6],一般结节径线<1cm者治疗效果较好,而1cm以上者则治疗效果较差。以上影响抑制性治疗疗效的因素早有报道,最近有学者报道血清Tg水平是影响L-T4抑制性治疗疗效的重要因素。TSAI等[3]发现经L-T4治疗后甲状腺结节体积显著性减小者血清Tg水平较对照组低,治疗前血清甲状腺球蛋白水平越高,L-T4抑制性治疗疗效越好而血清TSH水平、甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TgAb)滴度与甲状腺结节体积变化无相关性。本研究显示TSH抑制值、基线结节容积大小、结节有无钙化、是否含大量胶质、病理是否以上皮细胞为主影响L-T4抑制性治疗的有效性,其中TSH抑制值与疗效的关系最为密切。
关于L-T4抑制治疗的副作用,一些研究提示接受L-T4抑制治疗者常出现房颤、骨质疏松、肌无力等副作用。Papini报道有25% L-T4抑制性治疗患者出现心悸、震颤等症状。Gammage等[7]研究亦显示L-T4增加房颤的发生率。Chen等则发现接受 L-T4抑制性治疗患者可有骨密度降低。但另一些研究则未发现明显副作用。Dubois等[8]用前瞻性随机对照双盲试验方法研究L-T4抑制性治疗对心血管及骨骼肌肉系统疾病的影响,37例女性甲状腺结节患者随机分为两组L-T4治疗组和对照组进行了为期12个月的前瞻性研究。治疗组最初给予L-T4 1.7ug/Kg?d,之后根据TSH 调整L-T4剂量,使血清TSH处于正常低限。利用生物电阻抗分析、双能X线检测技术、腰围测量、皮肤皱褶测量等观察肌肉、脂肪和水份变化、能量消耗及肌肉功能。结果L-T4治疗组及随访组机体组份、心率、能量代谢、肌肉功能等无明显差异,提示L-T4抑制性治疗对女性机体组份或肌肉功能无明显影响。Reverter等[9]则证实L-T4抑制性治疗对骨密度无明显影响。本研究显示大于60岁的患者服用L-T4后易发生心悸、失眠,差异有统计学意义,而体重变化差异无统计学意义。
综上所述,L-T4抑制性治疗良性甲状腺结节是可选择的有效的方法,但年龄较大患者易发生心悸、失眠等不良反应。TSH抑制值、基线结节容积大小、结节有无钙化、是否含大量胶质、病理是否以上皮细胞为主影响L-T4抑制性治疗的有效性。为获得L-T4抑制性治疗的最佳效果,临床工作中治疗前应重视对患者年龄、结节基线容积、结节钙化、细胞病理学、TSH抑制值等情况综合评价。
[1] Demir T,Akinci B,Comlekci A,et al.Levothyroxine (L-T4) suppression treatment for benign thyroid nodules alters coagulation[J].Clinical Endocrinology,2009,71 (3):446-450.
[2] Gharib H,Papini E.Thyroid Nodules: Clinical Importance, Assessment, and Treatment[J]. Endocri- nology and Metabolism Clinics of North America,2007,36 (3):707-735.
[3] TSAI C,PEI D,Hung Y-J,et al.The effect of thyroxine-suppressive therapy in pati- ents with solitary non-toxic thyroid nodules-A randomised,double-blind, Placebo -c ontrolled study[J]. Inter- national Journal of Clinical Practice,2006,60 (1):23-26.
[4] Papini E,Guglielmi R,Bizzarri G,et al.Treatment of benign cold thyroid nodules: A randomized clinical trial of percutaneous laser ablation versus levothyroxine therapy or follow-up[J]. Thyroid, 2007,17 (3):229-235.
[5] Vermiglio F,Lo Presti VP,Violi MA,et al.Changes in both size and cytological features of thyroid nodule after levothyroxine treatment[J].Clin Endocrinol(Oxf),2003,59:347-353.
[6] Costante G,Crocetti U,Schifino E,et al.Slow growth of benign thyroid nodules after menopause:no need for long-term thyroxine suppressive therapy in post-menpausal women[J].J Endocrinol Invest,2004,27:31-36.
[7] Gammage MD,Parle JV, Holder RL,et al.Association between serum free thyroxine concentration and atrial brillation[J].Archives of Internal Medicine,2007,167(9): 928-934.
[8] Dubois S,Abraham P,Rohmer V,et al.Thyroxine therapy in euthyroid patients does not affect body composition or muscular function[J].Thyroid,2008,18 (1):13-19.
[9] Reverter JL, Holgado S, Alonso N,et al.Lack of deleterious effect on bone mineral density of long term thyroxine suppressive therapy for differentiated thyroid carcinoma[J]. Endocr Relat Cancer,2005,12(4):973-981.
