舒尼替尼上市后肝损害的信号检测与分析
2013-01-04王程程彭媛唐利张志勇四川大学华西医院药剂科四川成都6004四川大学华西药学院四川成都6004
王程程,彭媛,唐利,张志勇(.四川大学华西医院药剂科,四川 成都6004;2.四川大学华西药学院,四川 成都6004)
药物上市前安全性研究存在一定的局限性,如动物实验的种属差异、临床实验试验病例少、研究时间短、试验对象经过严格筛选和用药目的单纯等,使发生率较低的、需要较长时间应用才能发现的药物不良反应(ADR)以及在实际应用中其他因素如药物相互作用、病理因素等对药效的影响均未能发现,所以药物上市后的应用仍存在一定的风险[1]。因此有必要对药物进行上市后再评价。药物上市后再评价的方法之一就是基于不良反应自发报告系统(spontaneous reporting system,SRS),利用数据挖掘方法进行信号的筛选和评价,从而发现药品安全性问题。
苹果酸舒尼替尼(sunitinib)是一种多靶点酪氨酸激酶抑制剂,能抑制血小板衍生生长因子受体、血管内皮生长因子受体、干细胞因子受体等多种酪氨酸激酶受体,阻断信号传导,使肿瘤细胞失去继续分裂和生长的能力。临床用于胃肠道间质瘤(GIST)、晚期肾细胞癌(RCC)和神经内分泌瘤(pNET)患者的治疗。美国食品药品监督管理局(FDA)2006年批准其上市,我国亦于2007年10月批准其进口。舒尼替尼是一种新型的抗肿瘤药物,在国内上市时间较晚,价格较高,有必要进行重点监测和评价。
1 信号检测
1.1 研究资料 美国不良事件报告系统(adverse events reporting system,AERS)收集发生在美国境内的自发性安全报告、发生在美国境外严重和非预期的报告、以及所有严重的、非预期性和与用药相关的上市后临床研究报告,其数据量大,信息丰富,可用于分析。AERS数据库采用《药事管理的标准医学术语集》(MedDRA)编码[2],共包括 DRMO、DRUG、REAC、OUTC、PRSR、THER和INDI 7个文件,在去除化妆品、医疗器材等非药物的不良反应和删除重复报告后,共选取2009-2011年4 598 698份报告进行研究。
1.2 信号检测方法 目前应用于SRS数据库进行信号检测的方法主要有报告比值比法(ROR)、比例报告比法(PRR)、贝叶斯置信度递进神经网络法(BCPNN)、多项经验贝叶斯伽玛泊松分布缩减法(MGPS)等。Rothman等[3]通过假设数据对PRR和ROR进行比较,发现PRR的检测结果会出现较大偏倚,且不能估计相对危险度。Chen等[4]基于AERS数据库比较ROR、PRR和MGPS法,发现ROR敏感性和早期发现信号的能力较好。李婵娟等[5]研究广东省ADR数据库发现当报告数≥3时,与BCPNN法相比,ROR法灵敏度、特异度都很高,因此选用ROR法作为信号检测方法。
2 信号分析
2.1 MedDRA标准化查询 MedDRA标准化查询(SMQ)产生源于MedDRA用户对采用标准查询工具获取安全性数据的需求。用户通过MedDRA获取某一疾病的数据时,可以直接以疾病名称进行检索,为了全面获取病例,有时会以该疾病相关症状、体征或实验室检查等为查询条件。SMQ包含有与某个被关注的医学情况或领域相关的,来自于一个或多个系统器官分类(system organ class,SOC)的术语组,覆盖相关的症状、体征、实验室检查等,并且经过验证证明能检索到其定义范围内的相关数据[6]。
2.2 与肝损害相关的SMQ 将ROR法筛选得到的信号,通过http://bioportal.bioontology.org/网站查找出其对应的SMQ,由于不应用搜索算法的SMQ仅是简单的术语的组合,其应用效率和精度均会降低,因此需进行人工筛选。
2.3 信号分析方法 针对筛选得到的与肝损害相关的ADR,查找出其对应的患者的资料,包括年龄、性别、用药时长、发生时间、用药剂量、适应症等。计量资料先进行正态分布检验,计数资料采用χ2检验,然后将有统计学差异的因素进行logistic回归,以向前逐步法建立模型,采用哑变量法对分类变量进一步量化。所有数据应用SPSS20.0进行统计学处理,P<0.05为差异有统计学意义。
3 结果
3.1 信号检测结果 在进行分析的4 598 698份报告中,19 069份为舒尼替尼为首要怀疑的不良反应报告,经过ROR法检测,并选取其中药物-不良反应报告数大于3的报告[5],共得到321个舒尼替尼安全性信号,其中涉及到与肝损害的SMQ有:肝源性胆汁淤积及黄疸(cholestasis and jaundice of hepatic origin);胆 管 相 关 性 疾 病 (bile duct related disorders);胆道系统相关的实验室检查、症状和体征(biliary system related investigations,signs and symptoms);肝衰竭、肝纤维化、肝硬化以及其他肝损害相关的状况(hepatic failure,fibrosis and cirrhosis and other liver damage-related conditions);非感染性肝炎(hepatitis,non-infectious);感染性胆道疾病 (infectious biliary disorders);肝 脏 感 染 (liver infections);肝脏恶性以及未特指的肿瘤(liver neoplasms,malignant and unspecified);肝脏相关的实验室检查、症状和体征(liver related investigations,signs and symptoms);可能与肝有关的凝血功能障碍(possible liver-related coagulation and bleeding disturbances)。排除感染和肿瘤相关的SMQ,共筛选出17个可能与肝损害相关的ADR,分别为皮肤黄染(yellow skin);黄疸(jaundice);高胆红素血症(hyperbilirubinaemia);血胆红素升高(blood bilirubin increased);肝衰竭(hepatic failure);肝毒性(hepatotoxicity);肝性脑病(hepatic encephalopath-y);暴发性肝炎(hepatitis fulminant);细胞溶解型 肝 炎 (cytolytic hepatitis);高 血 氨 症 (hyperammonaemia);高转氨酶血症 (hypertransaminasaemia);AST 增高(aspartate aminotransferase increased);低 蛋 白 血 症 (hypoalbuminaemi-a);肝功能异常(hepatic function abnormal);食管静脉曲张破裂出血(oesophageal varices haemorrhage);腹水(ascites);中毒性肝炎(hepatitis toxic)。
3.2 信号分析结果 由于患者自身疾病(如肝胆系统肿瘤)可能对肝损害的发生有影响,故排除治疗肝胆系统肿瘤的报告,共得到用药信息完整的1 536例患者信息,其中与肝损害有关的有126例。
3.2.1 性别、适应证、用药剂量、发生时间与信号 经过χ2检验,肝损害与其他ADR在性别、发生时间、剂量中分布差异均无统计学意义,适应症之间存在差异,结果见表1。
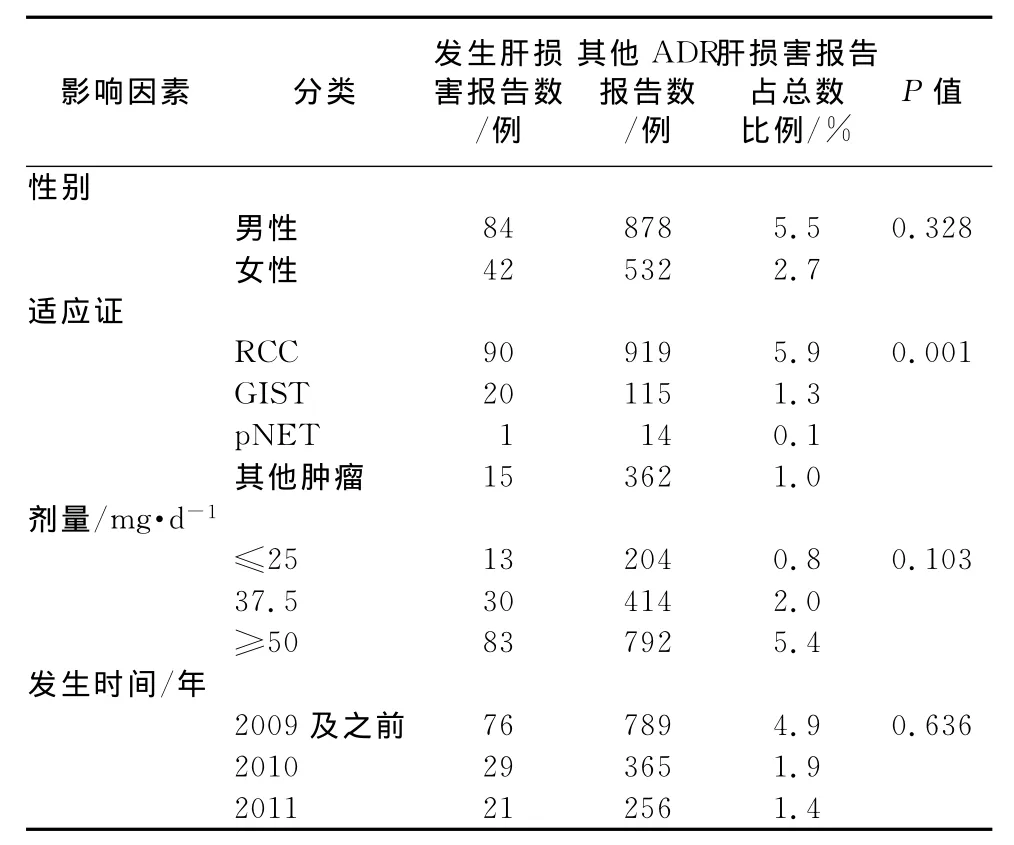
表1 信号影响因素的卡方检验结果Tab 1 Result of Chi-square test for signal effect factors
3.2.2 年龄、用药时长与信号 经过检验两者均不符合正态分布,进行秩和检验,年龄、用药时长P值分别等于0.017和0.001,与其他ADR相比分布差异均具有统计学差异。将有统计学差异的3个因素(年龄、适应证、用药时长)进行logistic回归分析。分析结果显示:年龄、适应证、用药时长均与肝损害发生相关有统计学意义;年龄因素中,相对于70岁以上的年龄组,小于等于70岁是肝损害的危险因素,其中50~60岁危险度最高;用药时长因素中,相对于用药超过90 d,5~90 d之内是危险因素;适应证中,相对于其他肿瘤,GIST和RCC是危险因素,其中GIST的危险度最高,结果见表2。

表2 不良反应的多因素logistic回归分析结果Tab 2 Binary logistic regression analysis for multi-factors of adverse reaction
4 讨论
对SRS数据库进行挖掘是目前药物警戒领域的研究热点。数据挖掘方法虽然很多,但目前在国际范围内并未建立信号检测的金标准,也没有一种方法比其他方法更好[7],因此寻求更好的挖掘方法是目前药物警戒的研究方向之一。
国内文献对不良反应编码时多采用WHO不良反应术语集(WHOART),但由于 WHOART首选术语较少,不包含疾病及病史的编码,给实际应用带来了不便,而MedDRA包含数据量大,在术语的选择、录入及检索方面具有很大的优势,且可涵盖病史及合并疾病的编码[8],全球越来越多的国家在使用。在分析药物与某一系统的损害时,很多文献[9-10]多采用SOC的方法,但一些实验室检查指标的变化如血胆红素、转氨酶水平等也可以部分反映疾病变化,按照MedDRA这些指标的SOC属于investigations,因此在研究药物与肝损害关系时如果仅选择SOC为hepatobiliary disorders的不良反应,研究结果的可靠性将受到影响,又如在分析抗血小板药物与出血的关系时,由于出血可能发生在很多系统中,如果一一查找,效率就会下降,但如果选用与出血相关的SMQ 如haemorrhage terms(excol laboratory terms)、haemorrhage laboratory terms等就会很方便的查找出出血相关不良事件,因此SMQ的使用能够协助我们识别和查询可能相关的病例,但需注意的是虽然SMQ在不断增加,但是仍不能覆盖所有的医学课题和安全性问题。
在该项研究中,年龄在70岁以下、RCC、GIST以及用药在5~90 d内是肝损害发生的危险因素。分析其原因可能与年轻患者用药剂量相对较高,治疗更为积极;肾细胞癌主要远处转移部位为肺、骨、脑、肝及肾上腺[11],胃肠道间质瘤肝转移发生率在15.9%~29%之间[12],肝损害的发生可能与肝转移有关。根据《急性药物性肝损伤诊治建议(草案)》,药物初次使用后出现肝损伤的潜伏期一般在5~90 d内,舒尼替尼亦主要发生在这段时间,提示我们在治疗开始前、每个治疗周期、以及临床需要时应监测肝功能。需要注意的是这些分析都是探索性的,对待结果应该十分慎重,因为AERS数据库中存在各种各样的报告偏倚,报告中的不良反应可能是联合用药或患者本身疾病进展或其他合并症等因素影响的结果,此外数据库受到递交数据的完整性、重复报告、报告率低等因素的影响。
基于计算机和统计技术的算法在数据挖掘中起到很大作用,但算法只是输入和输出间的加工过程,统计算法本身是基于报告的数量关联而非生物学关联[13],因此药物安全信号与药物之间并不是因果关系,需要进一步评价,筛选出有价值的信号之后再确定是否采取措施。
[1]杨乐,吴晔.浅谈加强我国药品上市后研究[J].中国药物警戒,2007,4(5):265-267.
[2]Sakaeda T,Kadoyama K,Okuno Y.Statin-associated muscular and renal adverse events:data mining of the public version of the FDA adverse event reporting system[J].Plosone,2011,6(12):e28124.
[3]Rothman KJ,Lanes S,Sacks ST.The reporting odds ratio and its advantages over the proportional reporting ratio[J].Pharmacoepidemiol Drug Saf,2004,13(8):519-523.
[4]ChenY,Guo JJ,Steinbuch M,etal.Comparison of sensitivity and timing of early signal detection of four frequently used signal detection methods:an empirical study based on the US FDA adverse event reporting system database[J].Pharm Med,2008,22(6):359-365.
[5]李婵娟.药品不良反应信号检测方法理论及应用研究[D].第四军医大学流行病与卫生统计学,2008.
[6]谢珺.浅析MedDRA标准化查询在安全数据检索和报告方面的应用[J].药物流行病学杂志,2011,20(8):426-429.
[7]Harpaz1 R,DuMouchel W,Shah NH,etal.Novel data-mining methodologies for adverse drug event discovery and analysis[J].Clin Pharmacol Ther,2012,91(6):1010-1021.
[8]吴桂芝,田春华,王丹,等.WHOART和MedDRA在药品不良反应监测中的应用[J].中国药物警戒,2010,7(2):81-85.
[9]李婵娟,夏结来,江静,等.广东省药品不良反应监测数据库的信号检测[J].中国药物警戒,2008,17(3):194-197.
[10]刘媛,程能能,杜文民,等.上海市药品不良反应自发呈报数据库中神经系统药物不良反应的信号检测[J].中国临床药学杂志,2010,19(2):85-88.
[11]National Comprehensive Cancer Network.Guidelines of Kidney Cancer.2011.
[12]蔡国响,蔡三军,师英强,等.26例胃肠道间质瘤肝转移的临床特征和生存分析[J].中华消化杂志,2005,25(9):521-525.
[13]张晓兰,夏佳.浅谈药物警戒中的安全信号与信号管理[J].药物流行病学杂志,2012,21(2):90-93.
