高效液相色谱法同时测定石上柏中4个双黄酮类化合物
2013-01-04黄建勇李少光赵美凤李宇翔林新华姚宏福建医科大学附属协和医院药学部福建福州350001福建医科大学药学院药物分析系福建福州350004
黄建勇,李少光,赵美凤,李宇翔,林新华,姚宏 (1.福建医科大学附属协和医院药学部,福建 福州350001;.福建医科大学药学院药物分析系,福建 福州350004)
石上柏(SelaginelladoederleiniiHieron)为蕨类植物门卷柏科植物深绿卷柏的全草,又名大叶菜、地侧柏、水柏枝等,主产于贵州、云南、广东、广西、福建、浙江及台湾等地,其味甘、微苦、涩、性凉,有清热解毒、祛风除湿、抗癌止血等功效[1],临床用于治疗咽喉肿痛、风湿痹痛、鼻咽癌、绒毛膜上皮癌、肺癌、宫颈癌及外伤出血等各种疾病[2-3],效果显著,毒副作用少。尽管石上柏已在临床有广泛应用,但关于其质量控制方法的研究报道较少。为满足用药安全、有效和质量可控的要求,有必要为其建立质量分析方法。笔者课题组前期从石上柏中分离得到了4个双黄酮类成分,包括穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素和3′,3′′′-双柚皮素。文献已报道这些双黄酮类成分具有较好的抗癌活性[4-7],因此,这些双黄酮可能是石上柏的活性物质基础。本文以这4种成分为指标成分,建立同时测定石上穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素和3′,3′′′-双柚皮素的HPLC法,该法简便、快速,重现性好,为石上柏质量控制提供了定量分析方法。
1 材料
Agilent 1260型高效液相色谱仪(配备四元低压混合泵、自动进样器、柱温箱、二极管阵列检测器)。
穗花杉双黄酮对照品购自上海融禾医药科技发展有限公司,罗伯斯特双黄酮、2′′,3′′-二 氢-3′,3′′′-双芹菜素和3′,3′′′-双柚皮素对照品为本实验室制备分离获得。上述对照品经HPLC归一法验证纯度均为98%以上。色谱级乙腈(Merck)、醋酸(国药集团化学试剂有限公司);注射用水(实验室自制);其他试剂均为分析纯。所有溶剂均用0.45μm微孔滤膜过滤,并超声除气。
石上柏购自福州市林氏草药店,经福建医科大学药学院姚宏副教授鉴定为蕨类植物门卷柏科植物深绿卷柏的全草。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素对照品各约10 mg,置5 mL量瓶中,加80%乙醇超声溶解并稀释至刻度,摇匀,得对照品储备液。
2.1.2 供试品溶液 称取干燥过筛的样品粉末1 g,精密称定,置具塞锥形瓶中,加石油醚(60~90℃)50 mL,超声提取60 min(功率250 W,频率40 kHz),弃去上清液,再重复超声提取1次。药渣放置于滤纸上,室温挥干石油醚后转移入具塞锥形瓶中,精密加入50 mL70%乙醇,加塞,称重,超声提取60 min(功率250 W,频率40 kHz),补足溶剂,过滤,精密量取滤液10 mL,58℃水浴蒸干,用80%乙醇复溶后定容于10 mL量瓶中待用。进样分析前用0.45μm微孔滤膜过滤,取续滤液为供试品溶液。
2.2 色谱条件 用上述供试品溶液优化色谱分析条 件。采 用 UltimateTMXB-C18(4.6 mm ×250 mm,5μm)色谱柱分析;以乙腈(B)-0.5%醋酸溶液(A)为流动相,优化获得梯度洗脱条件(0~4 min,B:35%→44%;4~20 min,B:44%→46%;20~21 min’B:46%→78%;21.1~35 min,B:99%;35.1~42 min,B:12%)、检测波长(270 nm)、流速(1.0 mL·min-1)及柱温(30℃),进样量10μL。色谱分析结果如图1所示,石上柏中4个成分达到基线分离,且一次进样色谱分析时间小于30 min。

图1 样品(A)和对照品(B)色谱图Fig 1 Chromatograms of sample solution(A)and reference substances(B)
2.3 标准曲线及检测限 准确量取“2.1.1”项下4种对照品储备液适量置于同一2 mL量瓶中,加无水乙醇稀释到刻度,摇匀,制成含4种成分质量浓度均为200μg·mL-1的标准工作液。取上述标准工作液按倍比稀释法配制标准系列工作溶液(100,50,25,12.5,6.25,3.12,1.56μg·mL-1)按“2.2”项下色谱条件进样分析,以对照品质量浓度(μg·mL-1)为横坐标(X),色谱峰面积为纵坐标(Y),绘制标准曲线,并计算检测限(S/N≥3)及定量限(S/N≥10),结果见表1。

表1 标准曲线及检测限(n=8)Tab 1 Calibration curves and LOD(n=8)
2.4 精密度试验 取对照品溶液一份(穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素质量浓度分别为12.5,12.5,12.5,12.5μg·mL-1),按“2.2”项下色谱条件,连续进样6次,记录峰面积,计算得穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双 柚 皮 素 的 RSD 分 别 为1.5%,2.0%,3.9%及1.8%。
2.5 重现性试验 取同一批药材6份,按照“2.1.2”项下方法平行制备供试品溶液6份,并按“2.2”项下色谱条件进样分析,测得穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素含量平均值的 RSD分别为1.2%,1.3%,2.2%及1.3%。
2.6 稳定性试验 取供试品溶液1份,室温放置,按“2.2”项下色谱条件,于0,2,4,8,10,24,36,48 h各进样一次分析,记录峰面积,代入标准曲线,计算穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜 素及 3′,3′′′-双柚 皮素含量平均值的RSD分别为0.2%,0.2%,0.4%及0.07%,结果表明在48 h内样品溶液稳定性良好。
2.7 加样回收率试验 精密称取已测知含量的样品6份,每份1 g,精密称定后置具塞锥形瓶中,分别加入穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素对照品溶液(质量浓度均为500μg·mL-1)200μL,按照“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱条件进样分析,计算加样回收率,见表2。
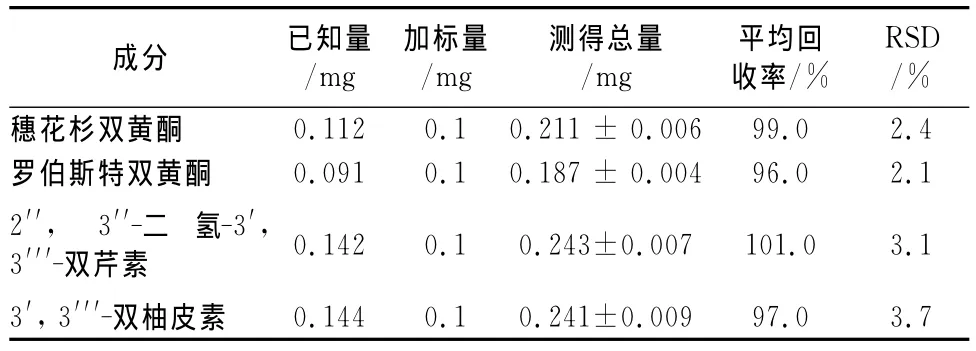
表2 回收率测定结果(n=6)Tab 2 Results of recovery rate by standard addition method(n=6)
2.8 样品含量测定 取供试品,按照“2.1.2”项制备成供试品溶液。按“2.2”项色谱条件,进样分析,以外标法计算样品中穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素的含量,结果见表3。
表3 含量测定结果(mg·g-1,±s,n=3)Tab 3 The contents of components(mg·g-1,±s,n=3)

表3 含量测定结果(mg·g-1,±s,n=3)Tab 3 The contents of components(mg·g-1,±s,n=3)
样品编号穗花杉双黄酮罗伯斯特双黄酮2′′,3′′-二氢-3′,3′′′-双芹菜素3′,3′′′-双柚皮素1 0.112±0.004 0.091±0.003 0.142±0.007 0.144±0.003 2 0.151±0.007 0.082±0.001 0.101±0.005 0.104±0.003 3 0.140±0.001 0.123±0.001 0.191±0.001 0.193±0.002
3 讨论
3.1 提取方法的选择 本实验分别考察了回流提取、索氏提取和超声波提取。超声波提取效率高,且简便快速,故采用超声波提取。
实验中针对配制供试品溶液的不同提取溶剂(50%、70%及100%乙醇),不同溶剂体积(30,50,75,100 mL)及不同提取时间(15,30,60,90 min)分别考察。结果样品70%乙醇50 mL超声提取(50 mL×60 min×1次),穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素提取较完全。
3.2 检测波长的选择 本研究采用的检测器为二极管阵列检测器,记录的紫外光谱显示,穗花杉双黄酮在210,288及335 nm左右有吸收峰,罗伯斯特双黄酮在210,268 nm及345 nm左右有吸收峰,2′′,3′′-二氢-3′,3′′′-双芹菜素在 210,268 nm,290 nm及338 nm左右有吸收峰,而3′,3′′′-双柚皮素在212,286 nm左右有吸收峰,考虑到分析方法的耐用性(如使用普通紫外检测器),因此选择单一波长270 nm为检测波长。
3.3 流动相的选择 试验了甲醇-水、乙腈-水不同配比的流动相系统,乙腈-水系统梯度洗脱可以达到很好的分离效果。同时,水中加入0.5%醋酸可有效改善穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素色谱峰峰形,故选择乙腈-0.5%醋酸系统。
3.4 石上柏含量测定指标成分的选择 笔者课题组前期研究从石上柏中分离、纯化得到了穗花杉双黄酮、罗伯斯特双黄酮、2′′,3′′-二氢-3′,3′′′-双芹菜素及3′,3′′′-双柚皮素4个双黄酮成分,且有文献研究表明这些双黄酮成分具有较好的抗癌活性[4-7]。本文选择石上柏中的4个主要活性成分为含量测定指标成分,一定程度上可客观地反映出石上柏药材的质量。
[1]中国科学院中国植物志编委会.中国植物志[M].北京:科学出版社,2004:87.
[2]全国中草药汇编编写组.全国中草药汇编(上册)[M].北京:人民卫生出版社,1975:240,339,340,903.
[3]杨今详.抗癌中草药制剂[M].北京:人民卫生出版社,1981:107,335,336.
[4]Lee NY,Min HY,Lee J,etal.Identification of a new cytotoxic biflavanone fromSelaginelladoederleinii[J].Chem Pharm Bull(Tokyo),2008,56(9):1360-1361.
[5]Silva GL,Chai H,Gupta MP,etal.Cytotoxic biflavonoids fromSelaginellawilldenowii[J].Phytochem,1995,1(40):129-134.
[6]Guruvayoorappan C,Kuttan G.Amentoflavone,a biflavonoid from Biophytum sensitivum augments lymphocyte proliferation,natural killer cell and antibody dependent cellular cytotoxicity through enhanced production of IL-2 and IFN-gamma and restrains serum sialic acid and gamma glutamyl transpeptidase production in tumor-bearing animals[J].J Exp Ther Oncol,2007,6(4):285-295.
[7]Lee JS,Lee MS,Oh WK,etal.Fatty acid synthase inhibition by amentoflavone induces apoptosis and antiproliferation in human breast cancer cells[J].Biol Pharm Bull,2009,32(8):1427-1432.
