蜂胶中总黄酮含量的测定
2012-12-25王烁蒋明蔚李晓斌贾楠
王烁,蒋明蔚,李晓斌,贾楠
(中国食品发酵工业研究院,北京,100027)
蜂胶(propolis)是蜂产品中一类十分重要的天然物质,是蜜蜂从植物芽孢及树干上采集的树胶,并混入蜜蜂上颚分泌物和蜂蜡等加工而成的一种具有芳香气味的胶状固体物。其中含50%~55%树脂,30% ~40%蜂蜡,5% ~10%花粉,还有油脂,氨基酸等[1-2]。近年来,国内外对蜂胶的药理作用进行了大量的研究。发现蜂胶内含有的黄酮类物质是重要的活性成分[3]。它对多种疾病(如心血管疾病、肿瘤、糖尿病、肝病、肠胃病等)具有十分明显的医疗保健功效[4-6]。
目前,国内外测定黄酮含量的方法有很多种[7-9],如聚酰胺树脂吸附法[10],高效液相色谱法,荧光法,气相色谱-质谱联机检测法[11]等。其中,用聚酰胺树脂吸附法测总黄酮时,用苯洗脱层析柱,会把蜂胶中一些弱极性的黄酮洗掉。高效液相色谱法测的是蜂胶中高良姜素、山奈酚、槲皮素、杨梅酮、松鼠素、芹菜素、芦丁、柯因的含量,至于总黄酮的含量,目前尚未见相关报道。气-质联机检测是有机物质含量比较准确的检测方法,但是由于气质联用检测设备投入比较大,操作要求严格,因此这种方法很难在生产企业中推广应用。分光光度比色法是易于推广的测定总黄酮方法,但是大多数方法中都是测定蜂胶制品的黄酮含量,并没有一种针对蜂胶胶囊内容物的测定方法。市面上90%以上的蜂胶产品皆为蜂胶胶囊,因此,建立一种快速准确而又操作简单的测定蜂胶胶囊中总黄酮的方法是极为必要的。
本文选择简便安全的紫外分光光度法,测定蜂胶胶囊中总黄酮的含量,且与国标 GB/T20574-2006[12]方法比对,试验表明,2种显色剂测定结果无显著性差异,该方法的准确度和精密度较高,简便快速。
1 实验部分
1.1 实验器材与试剂
1.1.1 实验仪器
梅特勒AL204-IC电子天平,普析通用T6新世纪紫外可见分光光度计,天津泰斯特DK-98-IIA电热恒温水浴锅,津腾隔膜真空泵GM-0.33II。
1.1.2 实验试剂
聚酰胺粉,60~90目;芦丁对照品,纯度≥95%;体积分数95%乙醇;无水乙醇。
乙醇溶液(30%):量取无水乙醇溶液300 mL,加水溶解,定容于1 000 mL容量瓶中,摇匀。
醋酸钾溶液(0.98 g/L):称取醋酸钾9.814 g,加水溶解,定容于100 mL容量瓶中,摇匀。
硝酸铝溶液(100 g/L):称取 Al(NO3)3·9H20 17.60 g,加水溶解,定容于100 mL容量瓶中,摇匀。
亚硝酸钠溶液(50 g/L):称取NaNO25g,加水溶解,定容于100 mL容量瓶中,摇匀。
氢氧化钠溶液(100 g/L):称取 NaOH10g,加水溶解,定容于100 mL容量瓶中,摇匀。
所有试剂均为优级纯或分析纯;实验用水为去离子水;实验样品为某品牌胶囊。
1.2 实验方法
1.2.1 原理
蜂胶是含有黄酮类的化合物。黄酮化合物的母核中某些位置如C3和C5上含有羟基时能与铝、铅等金属离子形成稳定的络合物,这些络合物在光谱上产生明显变化。黄酮与金属离子的这种作用不仅可以用于鉴别这类成分中羟基的位置,还可以作为进行定量分析的基础。实验就是采用这种原理,通过Al3+与黄酮形成络合物在最大吸收波长处有一吸收峰然后比色测定而进行定量的。
1.2.2 样品溶液的制备
(1)称取某品牌蜂胶囊液体0.4 g于烧杯内,加少量体积分数95%乙醇溶液,65℃水浴45 min搅拌使之溶解,取出后冷却至室温,分数次洗入50 mL容量瓶中,至乙醇溶液无色。用95%乙醇溶液定容至50 mL,摇匀,静置。精密吸取上清液5 mL于小烧杯中,加少量聚酰胺粉吸附,用真空泵抽滤,且用95%乙醇溶液分次清洗,滤液收集至25 mL比色管中,用95%乙醇溶液定容,摇匀,即得样品溶液1。
(2)称取液体0.4 g于烧杯内,加20 mL 95%乙醇溶液,65℃水浴45 min搅拌使之溶解,取出后冷却至室温,上清液使用滤纸过滤,烧杯、滤纸、漏斗、残渣用少量乙醇洗涤至滤液无色,定容至50 mL,摇匀即得样品溶液2。
1.2.3 芦丁供试品溶液的制备
精密称取经120℃干燥至恒重的芦丁标准品50 mg,用无水乙醇溶解并定容至50 mL容量瓶中,摇匀即得浓度为1.0 mg/mL的标准溶液,准确吸取10 mL于50 mL容量瓶中,摇匀,即得浓度为0.2 mg/mL的标准溶液。
1.2.4 用亚硝酸钠-硝酸铝-氢氧化钠作显色剂测定黄酮含量(方法一)
1.2.4.1 最大吸收波长的选择
精密吸取0.2 mg/mL的芦丁标准溶液2 mL于10 mL比色管中,加5%NaNO2溶液0.3 mL,放置6 min,然后加入 10%Al(NO3)3溶液 0.3 mL,放置 6 min,再加入4 mol/LNaOH溶液1 mL,用95%乙醇稀释至刻度,摇匀,放置15 min,在分光光度计上,在波长200~600 nm内扫描,得出吸收光谱,结果见图1。

图1 芦丁的吸收光谱
从图1可以看出,在510 nm时有最大吸光度,所以实验选择波长510 nm处测定。
1.2.4.2 显色剂用量及放置时间试验
吸取0.2 mg/mL的芦丁标准溶液2 mL,于10 mL比色管中,各加一定量的5%NaNO2溶液,摇匀后放置一段时间,加入一定量的10%Al(NO3)3溶液,摇匀后放置一段时间,再加入一定量的4 mol/L的NaOH溶液,用95%乙醇稀释至刻度,摇匀,于510 nm处测定吸光值。如表1所示。
所得结果为,最佳的显色剂用量和放置时间是:加5%NaNO2溶液0.3 mL,摇匀后放置6 min,加10%Al(NO3)3溶液0.3 mL,摇匀后放置6 min加入4 mol/LNaOH溶液1 mL,此时有最大吸光值。
读者们,去绘制一张记忆的地图。记忆许给你的是一个远景,它包括那些最为隐秘的信息和最为顺从的感情与感觉。我们的一切解释都来源于眼睛,因为人始自于眼睛,其他的都是些材料,它们没有回应能力又饶舌。我们通过眼睛观看,也通过眼睛来确认。我们有视觉的精明机警和当下的清晰透澈,但回忆却认为在我们说出之前的一切都是它给我们的。慢慢地就这样我们有了这样一种认识,即为我们所有的这个“这里”其实是记忆的一个花招,因为记忆有要追上别的更多的记忆的压力,即将来,因而它必须给自己一个定位。徐浡君将这两者都统一起来了,即过去和现在,也就是说,通过这两者他得到了未来。
1.2.4.3 稳定性实验
精密吸取0.2 mg/mL芦丁供试品溶液2.00 mL于10 mL比色管中,加5%NaNO2溶液0.3 mL,摇匀后放置6 min,加10%Al(NO3)3溶液0.3 mL,摇匀后放置6 min加入4 mol/LNaOH溶液1 mL,以空白试液为参比,在波长510 nm处以不同时间间隔测定吸光度,根据实验所测实验数据表2,结果表明吸光度在标准溶液显色15 min吸光度最大,15~18 min内吸光度基本稳定,20 min后吸光度明显减小,故实验选择显色后15 min比色。
1.2.4.4 标准曲线的绘制
(1)准确吸取芦丁供试品溶液0.00,0.50,1.00,1.50,2.00,3.00 mL,分别置于6个10 mL比色管中。
(2)于上述比色管中各加95%乙醇使成5 mL,分别加5%NaNO2溶液0.3 mL,放置6 min,然后加入10%Al(NO3)3溶液0.3 mL,放置6 min,再加入4 mol/LNaOH溶液1 mL,用95%乙醇定容,摇匀,放置15 min,以不加芦丁标准溶液的比色管中的溶液为空白的参比,510 nm波长处测定吸光度。
根据表3所测实验数据,得回归方程为Y=1.244 4X+0.001 5,r2=0.999 9。
结果表明芦丁含量在0.0~0.6 mg/mL与吸光度呈现良好的线性关系(如图2所示)。其芦丁含量、吸光度实验数据见下表3:
精密吸取0.2 mg/mL芦丁供试品溶液2 mL于10 mL比色管中,按1.2.4.4(2)实验操作,以空白试液为参比,在波长510 nm处测定吸光度,连续8次。
实验所测实验数据如下表4,RSD为0.138%,表明仪器精密度良好。

表1 显色剂用量及放置时间试验

表2 稳定性实验

图2 方法-标准曲线

表3 标准曲线实验数据

表4 精密度实验
1.2.4.6 回收率实验
精密称取已知含量(90.0 mg/g)的某品牌蜂胶6份,按下表分别加入不同量的芦丁标准品,按实验1.2.2.1方法制备溶液,各取2.5 mL于10 mL比色管里,按实验1.2.4.4(2)方法显色,测定吸光度,计算结果见下表5:
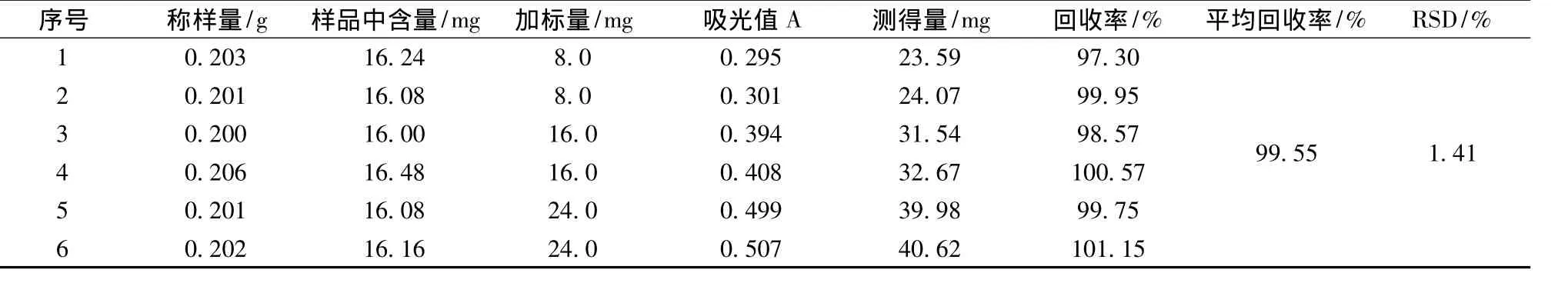
表5 回收率试验数据
实验中,平均回收率为 99.55%,RSD值为1.41%,小于3%,说明方法的准确度良好。
1.2.4.7 方法的检出限
根据国际理论和应用化学联合会IUPAC给出的

表6 20次测定空白溶液的吸光值
根据上表数据实验的取样量,方法测定过程中的稀释倍数计算可得出,本方法的检出限为1.25 mg/g。
1.2.5 用硝酸铝-乙酸钾作显色剂测定黄酮含量(此方法为国标方法)(方法二)
分别吸取经1.2.2.处理好的待测样品溶液2,1.0 mL,各5份,按国标GB/T20574-2006方法测定吸光度分别计算其中总黄酮的含量。吸光值和计算结果如下表7所示。

表7 某品牌蜂胶中总黄酮含量
2 实验结果与分析
2.1 同一品牌同一批次的蜂胶胶囊分别用两种方法测总黄酮含量
分别用两种方法测定同一批次中蜂胶中总黄酮的含量,每种方法取8份样品,每份样品0.40 g,结果见表8:

表8 两种方法(不同显色体系)测定蜂胶中总黄酮的含量
根据上表数据,经T检验计算判断,样本中t=1.454,小于t(0.05/7)=2.365,所以,以0.05为显著性水平,当df=7时,两种测定方法差异不显著。
2.2 讨论
本文建立一种新的测定蜂胶制品中总黄酮的方法,用亚硝酸钠-硝酸铝-氢氧化钠为显色剂,以芦丁为对照品,用分光光度法测定蜂胶中总黄酮的含量。回归方程是Y=1.244 4X+0.001 5,r2=0.999 9,方法的检出限为1.25 mg,加标回收率为97.30%~101.15%。
针对蜂胶胶囊样品的几个特殊性:一是蜂胶胶囊内容物中自有的黑褐色容易影响测定结果;二是溶于95%乙醇溶液后水浴加热会变成胶状物质,用滤纸过滤慢且容易损失;三是由于胶囊中含有大量的油脂成分,与水互不相溶,致使溶液浑浊影响测定结果。本方法采用了聚酰胺吸附及真空泵抽滤的方法,避免了测定结果的不准确且有效提高测定速度。
用2种不同显色体系对同一样品,测得的总黄酮含量基本一致,经过T检验分析表明,以硝酸铝-亚硝酸钠-氢氧化钠显色体系测定方法和国标GB/T20574-2006方法没有显著性差异。经实验表明,该方法准确度和精密度较高,稳定性好,更适用于蜂胶胶囊等脂溶性样品中总黄酮的测定。
[1] 彭增起,牛文娟,常彦红.蜂胶中类黄酮及类黄酮的保健作用[J].中国养蜂,1996,4(135),14-15.
[2] 顾青,张艳萍,钟立人.蜂胶中有效成分提取工艺研究[J].食品工业,2001,2,38-39.
[3] Li F,AwaleS,ezuka Y,et al.Cytotoxic constituents from-Brazilian red propolis and their structure-activity relationship[J].Bioorganic & Medicinal Chemistry,2008,16(5):434-5 440.
[4] 卓碧蓉,缪晓青.蜂胶降血压作用的研究现状[J].中国蜂业,2011,62(5),27-29.
[5] Maruyama H,Sumitou Y,Sakamoto T,et al.Antihypertensiveeffects of flavonoids isolated from Brazilian green propolisin spontaneously hypertensive rats[J].Biol Pharm Bull,2009,32(7):1 244-1 250
[6] 张翠平,胡福良.2008~2009国内外蜂胶研究概况[J].中国蜂业,2010,61(4),35-38.
[7] VolpiN,Bergonzini.G Journal of Pharmaceutical[J].Biomecical Analysis,2006,42:453-361.
[8] Nikolova M,Gevrenova R,Ivancheva S.External flavord aglycones from veronica Chamaedrys L.(Scrophulariaeeae)[J].Acta Pharm Anal,2003,52(2):145-149.
[9] 杨琴,邵兴军.超临界CO2萃取蜂胶软胶囊中黄酮类化合物的含量测定[J].中国蜂业,2011,62(1):34-36.
[10] 张中建,阎小伟.聚酰胺吸附法测定总黄酮[J].食品工业科技,2002,10(23):81-82.
[11] 崔国庆,刘国富.蜂胶乙醇提取物化学成分的GC/MS研究[J].天然产物研究与开发,2001,(6):34-35.
[12] GB/T20574-2006.蜂胶中总黄酮含量的测定方法分光光度比色法[S].
[13] IUPAC.Pure and Applied Chemistry.1976,45(2):101.
[14] IUPAC.Pure and Applied Chemistry.1976,45(2):107.
