低浓度乙二胺四乙酸对金黄色葡萄球菌生物被膜形成的影响*
2012-12-25郭志华胡婷婷单玲玲
郭志华,胡婷婷,单玲玲
(宿州学院化学与生命科学学院,安徽宿州,234000)
金黄色葡萄球菌(Staphylococcus aureus)是引发食源性疾病的常见致病菌,广泛存在于空气、水、灰尘及人和动物的排泄物中,对食品安全构成严重威胁[1]。
生物被膜是指细菌附着在生物的或非生物的接触面生长,分泌多糖、蛋白质等多聚化合物构成胞外基质,将其自身包裹其中而形成的大量微生物聚集体[2]。生物被膜中的细菌,尤其是处于深层的细菌,生物化学特性和形态结构均与浮游(planktonic)细菌不同,增殖和生长缓慢,对各种化学药物(包括杀菌剂)的耐受性更高[3]。被膜态的金黄色葡萄球菌具有普遍存在、难发现和难去除等特点,其抗药性远高于浮游态的金黄色葡萄球菌。美国国立卫生研究院(NIH)指出,人类细菌性感染约有65%是由生物被膜引起的[4]。因此食品工业中生物被膜的形成对食品安全的威胁是不容忽视的,而当前对它的研究主要集中在医学领域,食品工业领域涉及较少。
乙二胺四乙酸(EDTA),是人工合成螯合剂,能和许多阳离子在一起形成复合物,在食品行业被广泛用作稳定剂和螯合剂,它具有抑菌作用、限制生长必需的阳离子、破坏细菌细胞膜中的二价配合物等功能,可作为防腐剂使用。然而关于EDTA在细菌生物被膜中的影响的研究还很少,大部分的研究集中在EDTA作为抗菌剂防止致病菌污染导尿管。这些研究用的是高浓度的EDTA,通过抑制生长来抑制生物被膜的形成,或通过EDTA的螯合特性的杀菌效果根除成熟的生物被膜[5]。
本研究报道低浓度的EDTA可抑制金黄色葡萄球菌生物被膜的形成,对低浓度EDTA在食品加工过程中单独或和其它化学物质结合使用,防止金黄色葡萄球菌生物被膜的形成提供理论依据。
1 材料与方法
1.1 材料仪器
1.1.1 菌种及培养
菌株:金黄色葡萄球菌,购于安徽农业大学。
培养基:胰蛋白胨大豆肉汤(TSB:青岛高科海博生物技术有限公司)。
1.1.2 主要试剂
EDTA(分析纯),国药集团化学试剂有限公司。其余试剂均为国产化学纯。
1.1.3 仪器与设备
MULTISKAN GO酶标仪,美国 Thermo;BBSSDC-A超净工作台;AL204分析天平;SHP-250型生化培养箱。
1.2 实验方法
1.2.1 微孔板法分析生物被膜的形成
微孔板上生物被膜形成定量分析方法见文献[6]。无菌的96孔PVC微孔板每孔中加入100 μL的TSB培养基,并接入10 μL过夜培养的新鲜菌液,盖上盖子,37℃培养36 h。培养结束,移出培养液,微孔板用蒸馏水洗涤3次,去除结合松散的浮游细菌,吸附紧密的细菌细胞用100 μL的甲醇固定15 min,移除甲醇,微孔板室温晾干,每孔加入100 μL 1%的结晶紫溶液,在室温中染色5 min,移除剩余的染液,并用蒸馏水冲洗板子直到滴水无色为止。随后,微孔板在37℃孵育30 min,彻底干燥之后,加入200 μL 33%(体积比)的冰乙酸溶解吸附的细胞,从每个孔中吸出100 μL到新的微孔板中,用酶标仪测定630 nm处的吸光度值(OD)。所有的生物被膜的检测均平行进行3次,每孔读取3次读数,并计算相应实验的平均值和标准方差。
1.2.2 EDTA影响生物被膜形成的实验
1.2.2.1 EDTA浓度的影响
用无菌的EDTA制作原始溶液(100 mmol/L,pH 7.0)。在转接的开始,将EDTA加入到TSB培养基中,EDTA 最终浓度分别为 0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mmol/L,用来评价每个 EDTA 浓度对金黄色葡萄球菌生物被膜形成的影响。
1.2.2.2 培养时间的影响
在不同的培养期额外加入EDTA,评价EDTA加入时间对金黄色葡萄球菌生物被膜形成的影响。
准备有EDTA和无EDTA的TSB培养基,“阶段转变实验”评价EDTA在生物被膜形成不同阶段的作用。无菌的96孔PVC微孔板孔中加入100 μL有EDTA和无EDTA的TSB培养基,并接入10 μL过夜培养的新鲜菌液,盖上盖子,37℃培养16 h(阶段1),去除孔中浮游的细菌,每孔清洗3遍,加入100 μL添加EDTA和没EDTA的TSB培养基,接着培养32 h(阶段2),经过共48 h的培养,检测生物被膜。
此外,本试验做了在有EDTA和无EDTA的TSB培养基中金黄色葡萄球菌的生长曲线。
1.2.2.3 金属离子的影响
为研究在金属螯合剂EDTA与二价金属阳离子相互作用对金黄色葡萄球菌生物被膜形成的影响,在TSB 中分别加入 Mg2+、Fe2+、Ba2+、Ca2+,接种金黄色葡萄球菌,培养36h后测定生物被膜情况。
1.2.2.4 EDTA消除成熟的生物被膜的研究
在不含EDTA的TSB培养基中接入新鲜金黄色葡萄球菌,PVC96微孔板上37℃培养36 h生成生物被膜。去除培养液,清洗3遍,去除松散的菌体,每孔加入含有不同浓度EDTA的PBS溶液,37℃培养36 h,测生物被膜情况。
1.2.2.5 聚集实验[7]
聚集实验在试管中进行,金黄色葡萄球菌接种在5 mL添加EDTA和无EDTA的TSB液体培养基中,37℃培养36h,培养结束后小心吸取上层溶液,测OD600,其余的经涡轮振荡后,取菌悬液,测OD600。
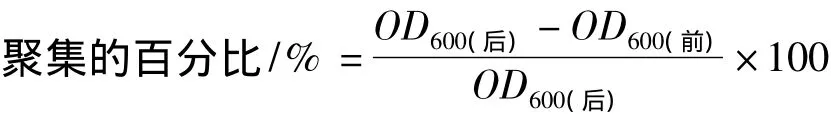
2 结果与分析
2.1 EDTA浓度对金黄色葡萄球菌生物被膜形成的影响
EDTA对金黄色葡萄球菌生物被膜形成的影响由图1。随着EDTA浓度的增加,生物被膜的生成量逐渐下降,到0.2 mmol/L时下降量基本趋于稳定,EDTA对金黄色葡萄球菌生物被膜形成最小抑制浓度为0.2 mmol/L,抑制率可达32%。0.2 mmol/L EDTA抑制生物被膜形成的能力与无EDTA相比存在显著差异(P<0.01),说明低浓度EDTA能够抑制金黄色葡萄球菌生物被膜的形成,这与文献报道结果一致,抑制作用与EDTA添加浓度有关[5]。
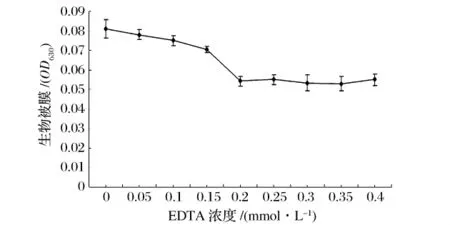
图1 EDTA浓度对生物被膜的影响
2.2 EDTA加入时间时间对金黄色葡萄球菌生物被膜形成的影响
为确定EDTA影响生物被膜生成的哪个阶段,在整个生长阶段的0、5、10、15、20、25、30、35、40 h 分别加入EDTA,使其最终浓度为0.2 mmol/L,结果见图2。表明在零时间加入EDTA对生物被膜形成抑制作用最好。随着时间的延长,加入EDTA对生物被膜形成的影响就越小。因此推断EDTA只影响金黄色葡萄球菌生物被膜形成的早期阶段。这一假设被“阶段转变实验”证实。“阶段转变实验”第1阶段和第2阶段相比无显著性差异(P>0.05),EDTA在早期的出现会抑制生物被膜的形成,在第2阶段加入EDTA不能影响生物被膜的形成。这些数据表明,EDTA只能影响金黄色葡萄球菌生物被膜形成的早期阶段。生物被膜的形成可分为3步:细菌在接触表面的吸附、微菌落的发育、包被多糖蛋白质复合物的成熟被膜的形成,不同阶段具有不同的生理特性[8]。本研究的结果表明,EDTA可能从开始就影响金黄色葡萄球菌在接触面的吸附,从而抑制生物被膜的形成。
2.3 EDTA对金黄色葡萄球菌生长的影响
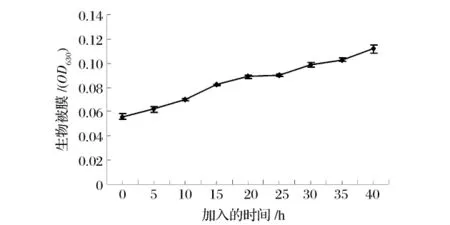
图2 EDTA加入时间对生物被膜的影响
为了进一步研究EDTA抑制生物被膜的作用机理,我们把金黄色葡萄球菌在有或无EDTA的TSB培养基中培养,每隔3 h测OD600,获得的生长曲线如图3所示。没有EDTA时金黄色葡萄球菌由接种到33 h细胞数量增加到最高值,33 h后细胞的生长处于衰亡期,有一部分菌体就开始死亡。而加入EDTA后,菌体的生长受到抑制。这表明生物被膜的抑制可能与生长受到抑制有关。EDTA在浓度为0.2 mmol/L时,不仅可抑制生物被膜的形成,而且具有抑制金黄色葡萄球菌生长的作用。刘剑等人在研究EDTA对变异链球菌生长抑制和抗黏附作用研究中发现,EDTA对变异链球菌的最低抑菌浓度为0.5 mg/mL,约为 1.71 mmol/L[9]。
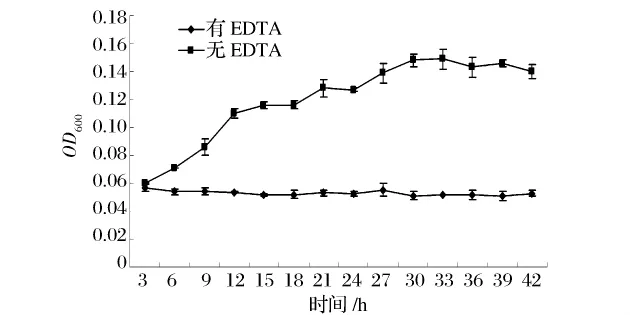
图3 金黄色葡萄球菌在有或无EDTA的生长曲线
2.4 金属离子与EDTA混合对金黄色葡萄球菌生物被膜的影响
不同金属离子与EDTA混合对金黄色葡萄球菌生物被膜形成有不同的影响(图3),EDTA-Fe、EDTACa、EDTA-Mg混合后生物被膜的量有一定的增加,与无EDTA相比,有显著性差异(P<0.01),说明Fe2+、Ca2+、Mg2+可以阻断EDTA抑制生物被膜的效应。但是EDTA-Ba混合后生物被膜量变化不大,与无EDTA相比,无显著性差异(P>0.05),Ba2+不能完全阻断EDTA抑制生物被膜生成。这与文献报道一致,Ehud Banin[10]研究不同二价金属离子对EDTA抑制绿脓杆菌生物被膜形成的效应发现,Ba2+没有影响EDTA的抑制效应;Mg2+没有完全阻断EDTA的抑制效应;但Fe2+、Ca2+可完全阻断EDTA的抑制效应。对于绿脓杆菌,加入Ca2+,可增加生物被膜的粘结性,减少菌的分散。Chen[11]等认为,Fe2+产生的静电作用有助于生物被膜的粘性,Fe2+和Ca2+可稳定生物被膜。
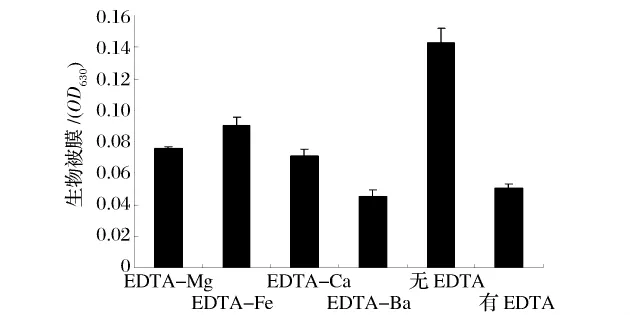
图4 金属离子与EDTA混合对生物被膜的影响
2.5 EDTA消除成熟的生物被膜的研究
为了研究EDTA对已生长成熟的金黄色葡糖球菌生物被膜是否有影响,把EDTA加入金黄色葡糖球菌已成熟的生物被膜溶液中培养36 h,统计分析结果显示,每个EDTA浓度与无EDTA之间没有统计学差异(P>0.05),EDTA不能破坏已经形成的生物被膜,即使是高浓度的EDTA也不能影响成熟的细胞被膜数量。
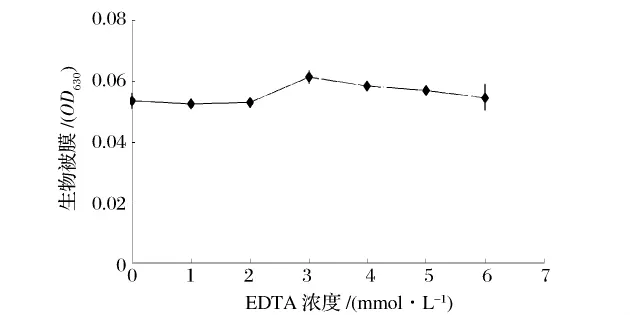
图5 EDTA对成熟生物被膜的影响
2.6 聚集实验
因为生物被膜是在细胞-表面和细胞-细胞之间形成的,因此要评估EDTA对这两种相互作用的影响。上述的研究是在PVC微孔板中进行的,以了解EDTA在细胞-表面相互作用的影响。通过研究,EDTA可抑制金黄色葡萄球菌在PVC上生物被膜的形成。当培养基中没有EDTA时,聚集的百分比为86%;培养基中有0.2 mmol/L EDTA时,聚集百分数降到30%。聚集的形成说明细胞之间有粘附作用,加入EDTA后减少聚集的形成,说明EDTA能抑制细胞之间的粘附作用。
3 讨论
相较于其他细菌,能够形成生物被膜的细菌更耐消毒剂和清洗。因此,抑制生物被膜的形成和根除生物被膜具有特殊意义。实验中研究了低浓度EDTA对金黄色葡萄球菌在PVC上产生生物被膜的影响。
低浓度的EDTA可抑制金黄色葡萄球菌产生生物被膜,而且是在生物被膜形成的早期就可形成影响。EDTA可作食品添加剂加入食品中用来防腐,国家标准使用的浓度为0.075 g/kg,约0.668 mmol/L。实验证实,0.2 mmol/L的EDTA就可以抑制生物被膜的形成,远低于国家标准,可减少原料浪费。
实验证明EDTA只影响金黄色葡萄球菌生物被膜形成的早期阶段,加入EDTA时间越早对金黄色葡萄球菌的生物被膜的形成影响越大。从在加入EDTA和没有加入EDTA的培养液中培养的金黄色葡萄球菌的生长曲线可以了解,EDTA对生物被膜的抑制可能与生长受到抑制有关。后面的聚集实验,进一步证明了这一观点。
因为EDTA作为一个螯合剂,可螯合金属离子如镁、钙、钡和铁等。一开始假设的生物膜抑制是由于EDTA螯合。然而,实验表明除去了Fe2+、Ca2+可阻断EDTA对生物膜形成的抑制作用,证明EDTA对生物膜抑制作用,并非由于螯合性能。
聚集的形成说明细胞之间有粘附作用,加入EDTA后减少聚集的形成,说明EDTA能抑制细胞之间的粘附作用,可减少金黄色葡萄球菌的生物被膜形成,对食品生产及生活清洁中的抑制生物被膜的行程及易于消除有积极意义。
EDTA对金黄葡萄球菌生物被膜有抑制或分散的作用,因此,在食品工业中合理使用EDTA,可有效地防止金黄色葡萄球菌生物被膜的形成。
[1] 张娜,韩北忠,李敏,等.食品接触表面对金黄色葡萄球菌生物被膜形成的影响[J].食品研究与开发,2006,27(7):33-38.
[2] 孙纪录,陈小雪,韩北忠.金黄色葡萄球菌生物被膜的控制方法研究进展[J].中国酿造,2011(6):1-3.
[3] 闫寅卓,魏巧思,刘畅.浮游态与生物被膜态金黄色葡萄球菌中类胡萝卜素的差异[J].食品研究与开发,2009,30(9):73-76.
[4] Chicurel M.Bacterial biofilms and infections-slimebusters[J].Nature,2000,408:284-286.
[5] Chang Yuhua,Gu Weimin,Lynne Mclandsborough.Low concentration of ethylenediaminetetraacetic acid(EDTA)affects biofilm formation of Listeria monocytogenes by inhibiting its initial adherence[J].Food Microbiology,2012,29(1):10-17.
[6] 唐俊妮,康名松,陈焕春,等.葡萄球菌核酸酶对金黄色葡萄球菌和其他细菌生物被膜形成的抑制作用[J].中国科学:生命科学,2011,41(7):586-592.
[7] Shanks RM,Meehl MA,Brothers KM,et al.Genetic evidence for an alternative citrate-dependent biofilm formation pathway in Staphylococcus aureus that is dependent on fibronectin binding proteins and the GraRS two-component regulatory system [J].Infection and Immunity,2008,76(6):2 469-2 477.
[8] 易华西,王专,徐德昌.细菌生物被膜与食品生物危害[J].生物信息学,2005(4):189-191.
[9] 刘剑,李晓眠,江勇.EDTA对变异链球菌生长抑制和抗黏附作用研究[J].中国现代医学杂志,2008,18(22):3 293-3 296.
[10] Ehud Banin,Keith M,Brady E,et al.Chelatorinduced dispersal and killing of Pseudomonas aeruginosa cells in a biofilm[J].Appl Environ Microbiol,2006,72(3):2 064-2 069.
[11] Chen X,Stewart PS.Role of electrostatic interactions Cohesion of bacterial biofilms[J].Appl Microbiol Biotechnol,2002,59(6):718-720.
