硝基还原假单胞菌谷氨酰胺酶的分离纯化及酶学性质*
2012-12-25杨成张涛江波缪铭沐万孟马亚君张薇
杨成,张涛,江波,缪铭,沐万孟,马亚君,张薇
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
谷氨酰胺酶 (glutaminase,EC 3.5.1.2,GA)是一种催化L-谷氨酰胺(L-Gln)水解成L-谷氨酸和氨的酰胺酶,广泛分布于动物体内及细菌、真菌等微生物中[1-2]。谷氨酰胺酶是食品工业中的一种重要酶制剂,是一种既有水解活力又有转移活力的多功能酶。一些微生物来源的谷氨酰胺酶因具有转移活力,可以催化谷氨酰胺的γ-谷氨酰基转移反应,制备一种功能性食品添加剂——茶氨酸。
茶氨酸(L-theanine)是茶叶特有的一种氨基酸,是茶叶中有效的呈味物质,具有抗肿瘤、降血压、提高学习能力、抗疲劳、神经保护和提升免疫力等多种生理功能[2]。目前,微生物发酵法制备茶氨酸已成为国内外研究热点,其主要应用的酶制剂有谷氨酰转肽酶 (γ-glutamyltranspeptidase,GGT,EC 2.3.2.2)和谷氨酰胺酶。其中,有关于谷氨酰转肽酶的应用,国内已有较多报道,主要有贾晓鹤等人[3]和王春晖等人[4]利用重组谷氨酰转肽酶和帅玉英等人[5]自主筛选出的GGT高产菌株制备谷氨酰转肽酶催化合成茶氨酸。谷氨酰胺酶催化合成茶氨酸的报道主要有王春晖等人[4]报道的利用硝基还原假单胞菌细胞生物合成茶氨酸,但国内有关于谷氨酰胺酶酶法制备茶氨酸以及谷氨酰胺酶的分离纯化和酶学性质的报道却较为少见。
本文主要研究硝基还原假单胞菌(Pseudomonas nitroreducens)SK16.004所产的谷氨酰胺酶的分离纯化和酶学性质,为进一步研究酶的催化机制及其在茶氨酸酶法制备中的应用提供依据。
1 材料与方法
1.1 实验材料
菌种:硝基还原假单胞菌(Pseudomonas nitroreducens)SK16.004,江南大学食品科学与技术国家重点实验室筛选保藏。
主要试剂:L-谷氨酸-γ-单羟肟酸,Sigma公司;Hiprep DEAE FF 16/10,美国 GE公司;Superdex 75 10/300 GL,美国GE公司;考马斯亮蓝R250,上海化学试剂公司进口分装;(NH4)2SO4,上海化学试剂公司;其他化学试剂均为分析纯。
斜面培养基(g/L):蛋白胨10,牛肉浸膏3,NaCl 5,琼脂15,pH 7.0,于121℃,0.08 MPa 下灭菌 20 min。
种子培养基 (g/L):蛋白胨10,牛肉浸膏3,NaCl 5,pH 7.0,于121℃,0.08 MPa 下灭菌 20 min。
发酵培养基 (g/L):蔗糖5,谷氨酸钠6,酵母膏1,MgSO4·7H2O 0.7,K2HPO40.5,KH2PO40.5,EDTA-Fe 0.1,pH 7.0,于121℃,0.08 MPa 下灭菌 20 min。
1.2 实验仪器
Äkta purifier 100蛋白质纯化系统,GE公司;10 kDa截留量超滤膜,Millipore公司;混合纤维树脂微孔滤膜(0.45 μm),上海新亚净化仪器厂;DK-8D型电热恒温水槽,上海精密实验设备有限公司;721E型可见分光光度计,上海光谱仪器有限公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 菌体培养及酶的提取
取2环斜面种子接入到种子培养基中,于30℃,200 r/min下培养14 h后接入装液量为10%的发酵培养基,接种量为3%,于同样条件下培养21 h。发酵结束后培养基在4℃,10 000 r/min离心10 min,得到湿菌体,将菌体用pH 7.0,10 mmol/L的K3PO4缓冲液重悬后超声破碎30 min(工作1s,暂停2s),于10 000 r/min,4℃离心10 min即得粗酶液。
向粗酶液中加入70%(NH4)2SO4,于4℃静置4 h,9 000 r/min离心除去杂蛋白,再向溶液中继续加入(NH4)2SO4至浓度为80%,4℃静置12 h后离心得到酶蛋白沉淀。沉淀用少量pH 7.5,10 mmol/L的K3PO4缓冲液溶解后透析24 h,以除去其中的透析好的酶液通过DEAE-fast flow离子交换柱和Superdex 75凝胶柱进行分离纯化,采用Äkta蛋白纯化系统进行检测,最终得到目的蛋白。多次重复纯化步骤,将收集到的纯酶液进行冷冻干燥,用于测定酶学性质。
1.3.2 Hiprep DEAE-FF 16/10离子交换层析
Hiprep DEAE-FF 16/10弱阴离子交换柱 (φ1.6 cm×10 cm)用起始缓冲液(10 mmol/L,pH7.5的K3PO4缓冲液)平衡10个柱体积后,上样1 mL,冲洗2个柱体积后,用含有0~1 mol/L NaCl的起始缓冲液进行线性梯度洗脱5个柱体积,流速保持在2 mL/min。二次层析时,使用线性洗脱5个柱体积,其他条件同上。
1.3.3 Superdex 75 10/300 GL凝胶过滤层析
Superdex 75 10/300 GL凝胶柱用含0.15 mol/L NaCl的10 mmol/L,pH 7.0的磷酸钾缓冲溶液平衡5个柱体积。浓缩DEAE活性峰后,上样0.5 mL,用同样的溶液洗脱1.5个柱体积,流速为0.5 mL/min。
1.3.4 SDS-PAGE电泳
分离胶和浓缩胶的浓度分别为12%和4%,操作电流为20 mA,上样量10 μL,电泳完毕后,用12%的三氯乙酸固定,考马斯亮蓝染色2 h后脱色。
1.3.5 酶活测定方法
比色法测定酶活[6]:根据谷氨酰胺酶可以将谷氨酰基转移到盐酸羟胺上得到L-谷氨酸-γ-单羟肟酸的原理[10],在 1 mL,100 mmol/L 咪唑-HCl(pH 9.0)缓冲溶液的酶活测定体系中,含35 mmol/L的谷氨酰胺 (L-Gln)和150 mmol/L的盐酸羟胺,加入150 μL酶液,于30℃下反应15 min,加入2 mL终止液(10%FeCl3∶24% 三氯乙酸∶6 mol/L HCl∶水 =8∶2∶1∶13),测定540 nm下的吸光度。酶活力单位定义为1 min生成1 μmol L-谷氨酸-γ-单羟肟酸所需要的酶量。
1.3.6 蛋白质浓度的测定
采用Lowry法[7],以牛血清蛋白为标准。
1.3.7 GA的最适温度及温度稳定性
将酶液分别在 30、37、40、50、55、60、70℃,pH 9.0的条件下进行酶反应,测定酶活,以最高酶活为100%,得到不同温度下的相对酶活,确定谷氨酰胺酶的最适反应温度。
将酶液分别在 30、37、40、50、55、60、70℃下保存4 h,每隔一定时间取样,在最适温度,pH 9.0的条件下测定残余酶活,以未经处理的酶液的酶活为100%,得到相对酶活并作图。
1.3.8 GA的最适pH及pH稳定性
将酶液分别用不同pH缓冲液调至pH 5.0~11.0,在55℃下进行酶反应,测定酶活,以最适pH下的酶活为100%,确定谷氨酰胺酶的最适反应pH。
将酶液分别在pH 5.0~11.0的缓冲液中保存12 h,在55℃、pH 9.0条件下测定酶活,以最高酶活为100%,得到相对酶活并作图。
1.3.9 金属离子对GA酶活的影响
酶液在含5 mmol/L EDTA的K3PO4缓冲液中透析12 h,除去金属离子后于不含EDTA的缓冲液中4℃透析24 h除去残留EDTA。在处理后的酶液中分别加入不同的金属离子 (Mn2+、Co2+、Ni2+、Zn2+、Cu2+、Mg2+、Ca2+、Ba2+、Fe2+、Fe3+,离子终浓度分别为0.2 mmol/L和2 mmol/L),并于4℃,pH 9.0条件下保温1 h后测定残余酶活,以不添加金属离子或化合物的酶液活力为100%。
1.3.10 GA的底物专一性
实验采用多种γ-谷氨酰基供体[6]代替酶活测定方法中的L-Gln,其他反应条件不变,测定酶活,考察谷氨酰胺酶对不同谷氨酰供体的亲和力,以L-Gln为供体时的酶活力为100%。
1.3.11 GA酶反应动力学常数的测定
考察L-Gln,盐酸羟胺酶活测定体系中,底物LGln的反应动力学常数。分别配制0.5~25 mmol/L不同浓度的底物溶液,测定酶活,根据Lineweaver-Burk双倒数法作图,计算GA的米氏常数Km和最大反应速度Vmax。
2 结果与讨论
2.1 谷氨酰胺酶的分离纯化
2.1.1 硫酸铵分级沉淀结果
由图1可以看出,(NH4)2SO4饱和度达到80%时,沉淀级分的比酶活最高,因此先用70%饱和度的(NH4)2SO4沉淀除去大部分杂蛋白,然后增加(NH4)2SO4的饱和度到80%,收集沉淀级分。
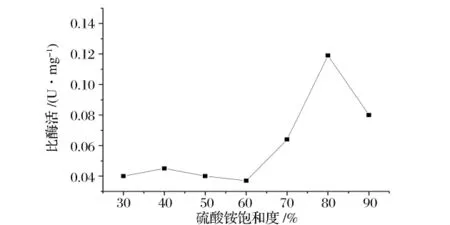
图1 硫酸铵分级沉淀结果
2.1.2 DEAE离子交换层析
据文献报道[6],谷氨酰胺酶的等电点一般在5.5~7.5左右,pH稳定范围在5.5~8.0,因此选择弱阴离子交换柱DEAE-Sepharose fast flow对GA进行分离纯化。图2显示,酶活主要集中在洗脱体积为75~93 mL的峰中,GA主要在0.3~0.5 mol/L NaCl范围内被洗脱下来。为进一步纯化,将活性峰浓缩后再次上样。
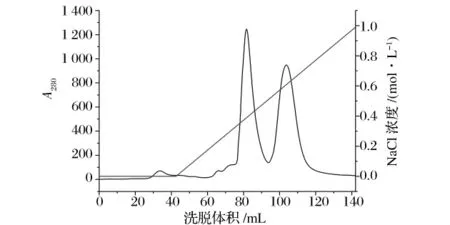
图2 GA的DEAE-Sepharose Fast Flow柱层析图
由图3可以看出,活性峰中的酶蛋白,进一步洗脱后得到4个蛋白峰,分别测定酶活后,发现酶蛋白主要集中于0.3~0.4 mol/L的洗脱梯度中,其他3个峰未测到酶活。经两次离子交换层析后,除去大量的杂蛋白,酶被纯化了2.6倍,回收率为19.53%。

图3 GA的二次DEAE-Sepharose Fast Flow柱层析图
2.1.3 凝胶过滤层析
据文献报道[6],微生物谷氨酰胺酶的分子质量范围多在25~67 ku,因此实验采用排阻范围在3~70 ku的Superdex 75 10/300 GL凝胶柱,在洗脱体积为9~11 mL处得到单一活性峰,通过酶活检测收集活性峰,回收率为9.33%,纯化倍数为4.14倍。由图4出峰结果,可估计目的蛋白的分子质量大约在41 kDa左右。
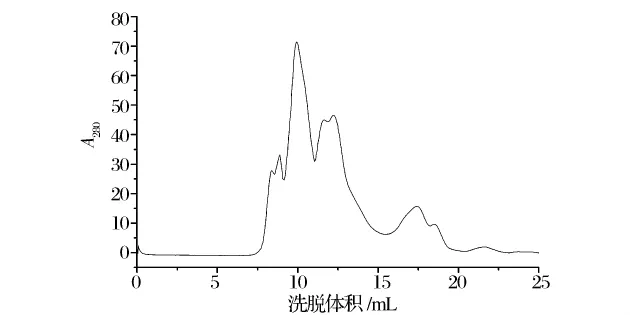
图4 GA的Superdex 75 10/300 GL凝胶层析色谱图
2.1.4 纯化各步骤酶活回收率
由表1可知,粗酶液经过各步纯化后,比酶活提高到0.949 U/mg,纯化倍数达到4.14倍。
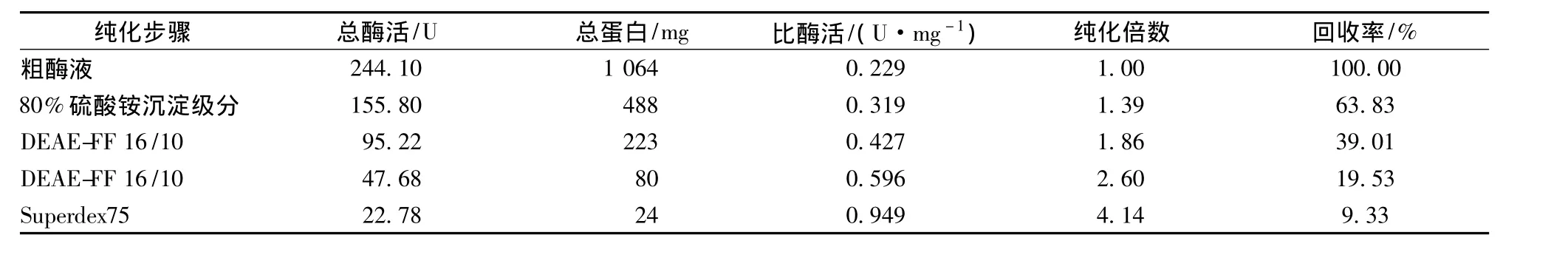
表1 GA的分离纯化结果
2.1.5 SDS-PAGE电泳
将分离纯化后的组分分别进行SDS-PAGE电泳,结果如图5所示。纯化后的样品呈单一条带,达到电泳纯度。根据标准分子质量计算,该酶的分子质量约为41ku,与凝胶柱分析结果一致。
2.2 GA的最适温度及温度稳定性
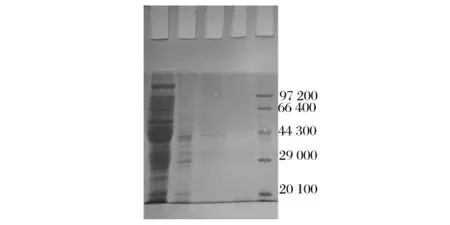
图5 不同纯化阶段酶活组分SDS-PAGE电泳图
由图6可知,该酶的最适反应温度在55℃左右,在37~60℃内保持较高的活性,酶的相对活力保持在70%以上。其最适温度与Weingand-Ziadé等人[8]报道的50℃和 Durá等人[9]报道的 40℃较为接近(表4)。
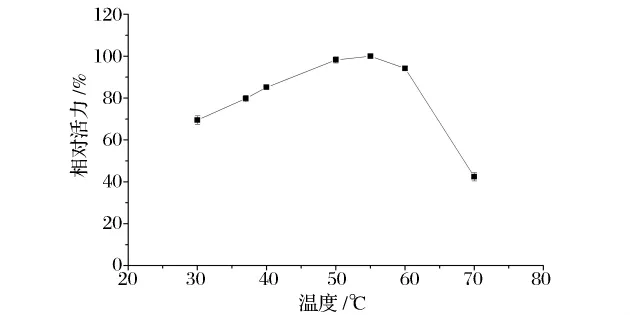
图6 GA的最适反应温度
由图7可知,GA具有较强的热稳定性,在30~55℃保温4 h后,酶活保持在80%以上,基本没有损失;而在温度高于60℃,保温0.5 h时,酶活损失严重;至70℃时,酶活下降了近90%。
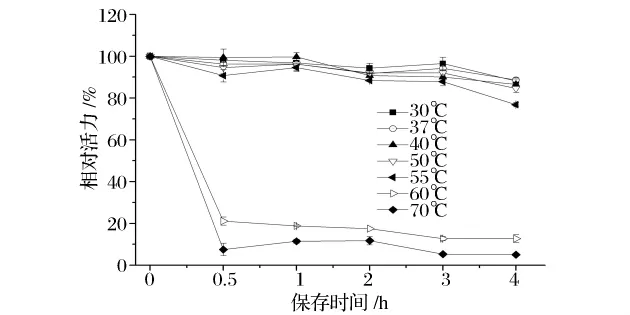
图7 GA的温度稳定性
通过对GA最适温度和温度稳定性的研究,有助于确定制备茶氨酸的酶反应条件。在茶氨酸的制备过程中可以通过单因素实验,选择30℃,40℃,50℃及55℃进行最适反应温度的研究。
2.3 GA的最适pH值及pH稳定性
由图8可知,酶反应的最适pH为9.0,在pH为5.0~11.0时,酶活保持在80%以上,具有广泛的最适pH值范围,其最适 pH与 Tachiki等人[6]报道的pH 9.0和Durá 等人[9]报道的 pH 8.5 接近,综合其他研究结果(表4)可知,微生物来源的GA的最适pH 多偏碱性[11]。
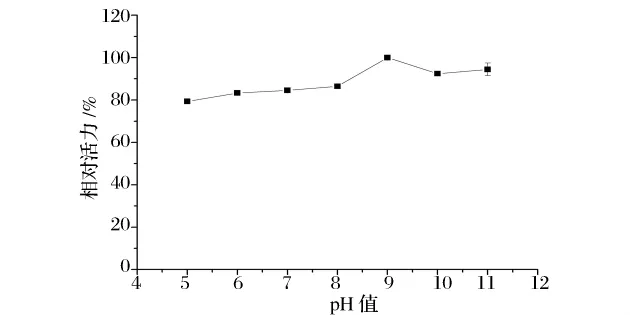
图8 GA最适反应pH
由图9可知,GA在pH 5.0~11.0内酶活基本保持稳定,其耐酸耐碱能力比Tachiki等人[6]报道的pH 5.5~8.0要高。
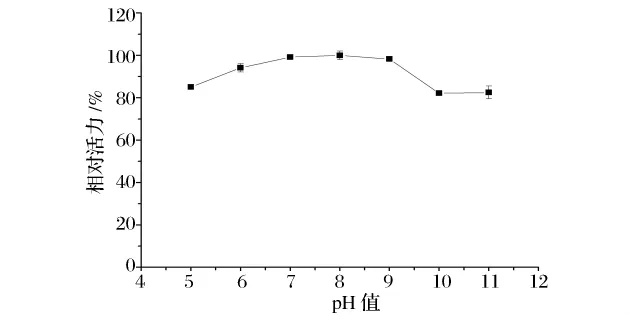
图9 GA的pH稳定性
根据上述实验可证明该酶在碱性条件下活力高且保持稳定,适宜进行转移反应,制备茶氨酸。本实验室同样测定出,利用GA生产茶氨酸的反应体系最适pH为9.5与该酶的最适pH接近。
2.4 金属离子对GA酶活的影响
金属离子的加入一方面可以改变溶液的离子强度,对蛋白质链上氨基酸的电离造成影响,从而改变蛋白质的高级结构,另一方面许多金属离子是某些复合蛋白酶的辅助因子,会对酶的活性位点产生影响,所以金属离子的加入会对酶活产生影响(见表2)。
由表2可知,在10种金属离子中,不同浓度的Mn2+、Co2+、Ni2+、Zn2+、Ba2+、Ca2+对 GA 的酶活影响不明显,Cu2+、Mg2+、Fe2+可以提高 GA 转移活力,且随着浓度的增高,Cu2+对促进酶活提高作用最大,与Tachiki等人的研究结果相似[6]。EDTA会轻微抑制酶活,而添加Fe3+会降低34.38%的转移活力。
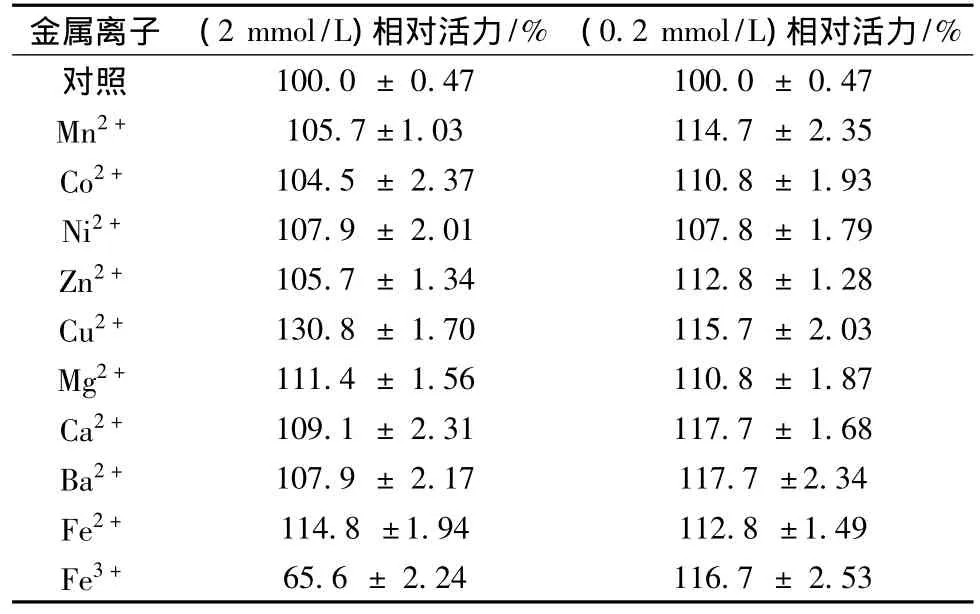
表2 金属离子对酶活的影响
2.5 GA的底物专一性
多数研究结果显示GA具有很强的底物专一性,L-Gln是GA催化的最好底物。此外,部分微生物来源的微生物也可以催化D-Gln、L-天冬酰胺和D-天冬酰胺的水解[1]。因此本文对硝基还原假单胞菌所产GA的底物专一性进行了研究结果见表3。

表3 谷氨酰胺酶的底物专一性
由表3可知,GA对L-Gln的亲和力最强,具有很好的专一性。对 γ-谷氨酰-对硝基苯胺 (含芳香基团)的亲和力较弱,分析原因可能是空间位阻的大小影响酶与底物的亲和力。而GA与谷氨酸钠、谷氨酸、天冬酰胺的亲和力极弱。结果表明,GA主要具备谷氨酰基的转移活力,而对其他氨基酸基团或天冬酰基的转移活性极弱。该结果与Tachiki等人[6]的研究结果不同,GA的底物专一性更好,分析原因可能是酶的空间结构与特殊位点存在差异,从而产生不同的立体异构专一性。
由于GA对L-Gln的高度专一性,可以初步确定将L-Gln作为茶氨酸制备过程中最适的谷氨酰基供体。
2.6 GA酶反应动力学常数的测定
酶促反应的动力学是研究酶促反应的速度以及影响速度的各种因素的科学。动力学研究既可以为酶的机理研究提供实验数据,又可以指导酶在生产中的应用,以最大限度地发挥酶的催化作用。Km值是酶的特征性常数,只与酶的性质、酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。
采用Lineweaver-Burk双倒数法作图,绘制酶作用于L-Gln的动力学曲线,以图10中横坐标的截距为-1/Km,纵坐标的截距为1/Vmax,根据回归方程计算,得到谷氨酰胺酶对底物 (L-Gln)的Km值为0.72 mmol/L,对底物 (L-Gln)的 Vmax为 0.55 μmol/(min·mL)。表4列出了部分不同来源的GA的性质比较。
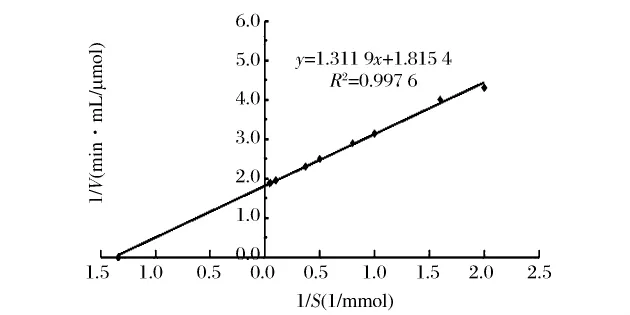
图10 GA的Lineweaver-Burk图
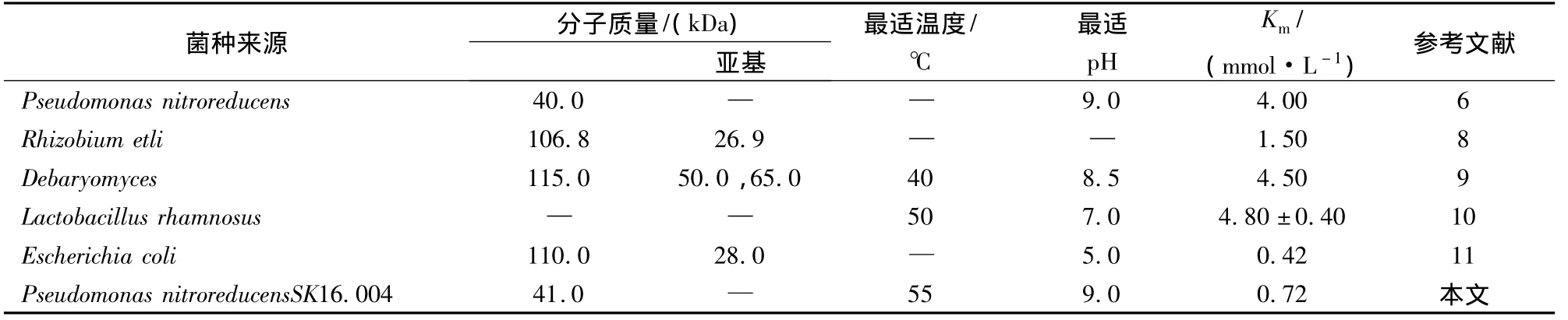
表4 不同来源的谷氨酰胺酶的性质比较[11-12]
由表4可知,不同菌种谷氨酰胺酶的性质有所不同,其中P.Nitroreducens SK16.004与E.coli所产GA的相对分子量和最适pH相差较大,但对于反应底物Gln的Km值较为接近[12]。来自假单胞菌属不同菌株所产的GA,虽最适pH与相对分子量较为接近,但在耐热性和Km值上有较大差别[6]。但酵母菌属的De-baryomyces[9]与乳杆菌属的 Lactobacillus[10]虽来源不同,但在酶学性质如最适温度、pH和Km值等多方面具有相似之处。
3 结论
(1)采用DEAE-Sepharose Fast Flow和Superdex 75 10/300 GL凝胶过滤等纯化方法,获得了硝基还原假单胞菌谷氨酰胺酶,纯化倍数为4.14,回收率为9.33%。通过SDS-PAGE电泳检测纯度,得到单一条带,即纯化后样品达到电泳纯,谷氨酰胺酶的相对分子量约为41 ku。
(2)硝基还原假单胞菌SK16.004谷氨酰胺酶转移酶活的最适温度为55℃,温度在37~60℃范围内时,酶残余活力在70% 以上。该酶的最适pH为9.0,在pH 5.0~11.0时,转移酶活保持稳定。
(3)在 10 种金属离子中,Mn2+、Co2+、Ni2+、Zn2+、Ba2+对 GA 的酶活影响不明显,Cu2+、Mg2+、Ca2+、Fe2+可以提高GA转移活力,其中Cu2+对促进酶活提高作用最大。EDTA会轻微抑制酶活,而添加Fe3+会降低34.38%的转移活力。
(4)GA对不同的底物 γ-谷氨酰-对硝基苯胺(含芳香基团)、谷氨酸钠、谷氨酸、天冬酰胺的亲和力较弱,而对L-Gln的亲和力最强,具有很高的底物专一性。
(5)以L-Gln为底物,采用Lineweaver-Burk双倒数法作图得到 GA的 Km值为0.72 mmol/L,Vmax为0.55 μmol/(min·mL)。
[1] 罗科丽,彭喜春,晏日安,等.微生物谷氨酰胺酶的研究进展[J].中国调味品,2010,35(11):30-34.
[2] 帅玉英,张 涛,江 波,等.茶氨酸的研究进展[J].食品与发酵工业,2008,34(11):117-123.
[3] 贾晓鹤,陈莉,赵宁伟,等.生物转化法应用重组谷氨酰转肽酶合成 L-茶氨酸[J].食品工业科技,2008,29(2):166-169.
[4] 王春晖,林智.茶氨酸生物合成研究[D].北京:中国农业科学院茶叶研究所,2005.
[5] Yuying Shuai,Tao Zhang,Bo Jiang,et al.Development of efficient enzymatic production of theanine by γ-glutamyltranspeptidase from a newly isolated strain of Bacillus subtilis SK11.004[J].Journal of the Science of Food and Agriculture,2010,90(15):2 563-2 567.
[6] Takashi Tachiki,Takeshi Yamada,Masashi Ueda,et al.Purification and some properties of glutaminase from Pseudomonas nitroreducens IFO 12694 [J].Bioscience,Biotechnology,and Biochemistry,1996,60(7):1 160-1 164.
[7] Lowry O H,Rosenbrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,19(3):265-275.
[8] Huerta-Saquero A,Calderón J,Arreguin R,et al.Overexpression and purification of Rhizobium etli Glutaminase A by recombinant and conventional procedures[J].Protein Expression and Purification,2001,21(3):432-437.
[9] Durá M A,Flores M,Toldrá F.Purification and characterization of a glutaminase from Debaryomyces spp.[J].International Journal of Food Microbiology,2002,76(1-2):117-126.
[10] Alexandra Weingand-Ziadé,Christiane Gerber-Décombaz,Michael Affolter,et al.Functional characterization of a salt-and thermotolerant glutaminase from Lactobacillus rhamnosus[J].Enzyme and Microbial Technology,2003,32(7):862-867.
[11] Standish C.Hahtman.Glutaminase of Escherichia coli[J].The Journal of Biological Chemistry,1968,243(5):853-863.
[12] Renu Nandakumar,Kazuaki Yoshimune,Mamoru Wakayama,et al.Microbial glutaminase:biochemistry,molecular approaches and applications in the food industry[J].Journal of Molecular Catalysis B:Enzymatic,2003,23(2-6):87-100.
