TNF-α 和钙-钙调蛋白依赖性蛋白激酶Ⅱ在大鼠心肌缺血后适应中的作用*
2012-12-23张家明郝海菊李景东
刘 敏, 张家明, 李 超, 郝海菊, 李景东
(华中科技大学同济医学院附属协和医院心内科,湖北 武汉430022)
近年来在多种动物和人类发现心肌缺血预适应和后适应现象,即在心肌缺血前后给予多次短暂的缺血再灌注能减轻随后的再灌注损伤,两者具有内源性心肌保护作用,受到实验和临床研究的高度重视。由于临床上心肌梗死的发生有一定程度的不可预知性,因而进行缺血后适应干预治疗更具有应用前景[1],但是其发生机制尚未阐明[2-3]。
研究表明,心肌缺血再灌注时可产生肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等多种炎性细胞因子,细胞钙超载等也参与细胞的损伤过程。钙-钙调蛋白依赖性蛋白激酶Ⅱ(calcium-calmodulin-dependent protein kinase II,CaMKII)是一种分布广泛的多功能丝氨酸/苏氨酸蛋白激酶,介导的底物磷酸化和去磷酸化是细胞信号转导过程中的重要环节,也是胞内代谢调节的最重要因素之一,通过磷酸化肌浆网钙泵和受磷蛋白等在调节胞内钙离子平衡过程中发挥重要作用[4],但是目前有关缺血后适应对TNF-α 和CaMKⅡ的影响报道甚少[2-3],本研究通过建立心肌缺血再灌注损伤模型,观察缺血后适应对心肌组织TNF-α 和CaMKⅡ水平变化的影响,并应用重组人肿瘤坏死因子受体:Fc 融合蛋白(recombinant human tumor necrosis factor receptor:Fc fusion protein,rhTNFR:Fc)以中和缺血再灌注过程中产生的过量TNF-α,探讨两者在心肌缺血后适应中的作用和机制。
材 料 和 方 法
1 材料和主要试剂
成年SD 雄性大鼠重200 ~250 g,购自同济医学院实验动物中心。TNF-α 及CaMKII-PThr287Ⅰ抗购自Cell Signaling Technology。CaMKII 及GAPDHⅠ抗购自Santa Cruz Biotechnology。相应的Ⅱ抗均购自武汉安特捷生物技术有限公司。ECL 发光试剂盒购自Amersham。Trizol、逆转录试剂盒及SYBR Green 荧光定量PCR 试剂盒均购自大连宝生物工程有限公司。rhTNFR:Fc 购自上海中信国健药业有限公司。TNF-α 引物序列上游为5'-CAAAACTGCAGTGACAAGCC-3',下游为5'-GGACTCCGTGATGTCTAAGT-3';β-actin 引物序列上游为5'-CATCCGTAAAGACCTCTATGCCAAC-3',下游为5'-ATGGAGCCACCGATCCACA-3',由武汉生命技术公司合成。伊文思蓝购自Sigma。2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)购自上海索莱宝生物科技有限公司。其它生化试剂均为进口分装或国产分析纯。
2 主要方法
2.1 缺血再灌注模型 SD 大鼠用10%水合氯醛以3 mL/kg浓度腹腔注射麻醉。将SD 大鼠固定于手术台,气管切开后接小动物呼吸机(上海奥尔科特生物科技有限公司),潮气量按30 mL/kg 设定。于左侧第3 ~4 肋间开胸暴露心脏,破心包膜。接BL-420F 生物机能实验系统,平衡15 min。于左心耳根部下方2 mm 处用6-0 带线缝合针盲扎左冠状动脉前降支,将缝合线穿过橡胶管打一活结。心脏表面颜色呈苍白、发绀,同时心电图ST 段抬高提示结扎成功。结扎30 min后,打开活结,进行再灌注2 h。
2.2 实验分组 将SD 大鼠分为5 组:假手术组(sham 组,n=16),只分离左前降支,不结扎;缺血再灌注组(IR 组,n =16),同2.1 方法;缺血后适应组(IP 组,n =16),缺血30 min后,给予10 s 再灌注/10 s 缺血,共循环3 次,之后给予119 min 再灌注;rhTNFR:Fc+缺血再灌注组(F+IR 组,n=16)及rhTNFR:Fc+缺血后适应组(F +IP 组,n =16),术前按1.75 mg/kg 腹腔注射rhTNFR:Fc,余步骤分别同缺血再灌注组和缺血后适应组。其中每组中的8 只心脏用于Western blotting和RT-PCR 检测,其余的8 只用于测定心肌梗死面积。
2.3 心肌梗死面积测定 待再灌注2 h 结束后,永久性结扎左前降支,从升主动脉逆行性注射1 mL 1%伊文思蓝,待整个心脏变蓝后,迅速将其取出,放入PBS 溶液中清洗干净,去除心房及右室。将处理后的心脏放入-20 ℃冰箱冷冻15 min 后取出,用刀片横切成2 mm 薄片,再放入现配pH 7.4 的1%TTC 中孵育20 min,之后放入10%多聚甲醛中过夜。相机拍照后,用Image-Pro Plus 6.0 软件测定心肌梗死面积、缺血区面积及总面积。
2.4 Western blotting 检测 从-80 ℃冰箱中取出心脏,去除心房和右心室。肌浆网内和细胞内蛋白提取方法同文献所述[5]。按照每孔50 μg 上样,SDS-PAGE 电泳,将蛋白转移至硝酸纤维素膜上。用5%脱脂牛奶封闭,然后Ⅰ抗4 ℃孵育过夜。相应Ⅱ抗室温孵育2 h 后,暗室中ECL 发光剂曝光。蛋白条带相对浓度用Quantity One Software 软件测定。
2.5 RT-PCR 检测 取100 mg 左室前壁组织用Trizol 提取mRNA。用260 nm 吸光度值测定RNA 浓度。0.5 μg RNA 加入10 μL 混合液中,在37 ℃15 min 和85 ℃5 s 孵育进行逆转录过程。1 μL cDNA 加入10 μL 混合液中进行实时定量PCR 过程。基因表达量用StepOne Software2.1 软件计算。
3 统计学处理
结 果
1 缺血后适应及rhTNFR:Fc 对大鼠心肌梗死面积的影响
与sham 组比较,IR 组梗死面积/缺血区面积及缺血区面积/总面积的比值均显著增加(P <0.01);与IR 组比较,IP 组以及F+IR 组和F+IP 组均显著减少(P <0.01),其中F+IP组的比值减少最明显,见图1、2。
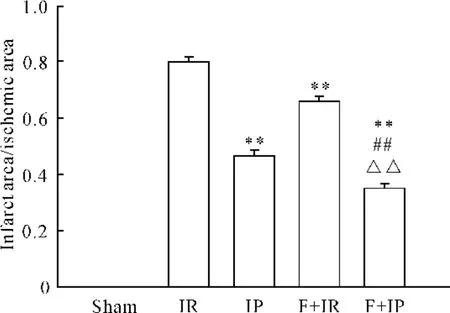
Figure 1. The ratio of infarct area to ischemic area in the five groups. ±s. n =8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F+IR.图1 各组心肌梗死面积/缺血面积的比值

Figure 2. The ratio of ischemic area to total area in the five groups. ±s. n =8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F+IR.图2 各组心肌缺血面积/总面积的比值
2 各组心肌组织TNF-α 表达的变化
与sham 组比较,其余各组TNF-α 蛋白表达均显著升高(P <0.01);与IR 组比较,IP 组以及F +IR 组和F +IP 组均显著降低(P <0.01),其中F +IP 组降低最明显,见图3。心肌组织TNF-α mRNA 表达相对量如图4 所示,与TNF-α蛋白表达检测结果一致。
3 各组心肌组织CaMKⅡ蛋白表达和活性的变化
心肌组织CaMKⅡ蛋白表达如图5 所示,与sham 组比较,IR、IP、F+IR 组及F +IP 组均显著降低(P <0.01)。与sham 组比较,IR 组p-CaMK Ⅱ蛋白表达显著降低(P <0.01);与IR 组比较,IP 组、F +IR 组和F +IP 组均明显升高(P <0.01),其中以F+IP 组升高最为显著,见图6。
讨 论

Figure 3. The relative expression of TNF-α protein in the five groups. ±s. n =8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F+IR.图3 各组TNF-α 蛋白表达的相对量

Figure 4. The relative expression of TNF-α mRNA in the five groups. ± s. n =8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F+IR.图4 各组TNF-α mRNA 表达的相对量

Figure 5. The protein expression of CaMKⅡ. ±s.n = 8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F+IR.图5 各组CaMKⅡ蛋白的表达

Figure 6. The protein expression of p-CaMKⅡ. ±s.n=8. **P <0.01 vs IR;##P <0.01 vs IP;△△P <0.01 vs F +IR.图6 各组p-CaMKⅡ蛋白的表达
近年发现,在多种动物和人类存在心肌缺血后适应对心脏的保护作用,其发生机制包括减少氧自由基的产生和细胞内钙超载、减轻内皮功能失调等被动机制以及主动激活再灌注损伤保护激酶和其它蛋白激酶而产生保护作用,但尚未完全阐明[2-3]。目前认为,缺血再灌注损伤涉及一系列多因素参与的复杂病理生理过程,包括细胞因子参与的炎症反应、氧自由基、细胞内钙超载等因素引起细胞、亚细胞结构甚至基因的损伤。研究表明,急性缺血再灌注可导致心肌自分泌和释放TNF-α[6],TNF-α 能诱导氧化应激,后者激活NFkappa B 转位[7],在炎症反应损伤过程中发挥重要作用[8-9],另一方面,在心肌缺血预适应过程中对心肌具有保护作用[10-11]。TNF-α 对心肌损伤和保护的双重作用,表现为浓度和时间依赖性并且与TNF-α 作用的受体类型有关,即TNF-α 在高浓度时主要与TNFR1 受体结合加重细胞损伤,而在低浓度时主要与TNFR2 受体结合发挥保护作用[9,12]。但是TNF-α 在心肌缺血后适应中的作用目前尚不清楚[3,11],因此本研究通过建立大鼠缺血再灌注损伤模型,观察到缺血再灌注组心肌梗死面积、心肌组织TNF-α 含量较对照组明显增加,而缺血后适应组较缺血再灌注组和对照组均明显减少,提示缺血后适应的心肌保护作用可能与缺血后适应减少TNF-α 的产生有关。Kin 等[7]也观察到,缺血后适应能抑制大鼠心肌氧化应激反应介导的NF-kappa B 转位和TNF-α 释放从而减轻细胞凋亡。
为证实上述推测,我们应用重组人肿瘤坏死因子受体融合蛋白rhTNFR:Fc 以中和缺血再灌注过程中产生的高浓度TNF-α,结果显示,心肌梗死面积在rhTNFR:Fc 并缺血再灌注组较缺血再灌注组明显减少,提示通过应用rhTNFR:Fc 降低TNF-α 含量可减少心肌梗死面积,支持缺血后适应可能同样通过减少TNF-α 的产生而发挥心肌保护作用的推断。其机制可能通过降低缺血再灌注时高浓度的TNF-α 到较低水平,一方面减少与TNFR1 受体的结合从而减轻损伤反应,另一方面通过与TNFR2 受体结合发挥保护作用,这有待进一步证实。本研究还观察到,心肌梗死面积在rhTNFR:Fc 并缺血后适应组较rhTNFR:Fc 并缺血再灌注组以及缺血后适应组均有进一步减少,提示联合应用rhTNFR:Fc 和缺血后适应能增强缺血后适应的心肌保护作用,并且效果优于二者单用。
细胞内钙超载是缺血再灌注损伤的病理生理机制之一[8],肌浆网在调节胞内钙离子浓度方面发挥重要作用,在心肌缺血再灌注时肌浆网功能失调,肌浆网CaMKⅡ活性降低[13]。CaMKⅡ的活性主要受Ca2+和钙调蛋白调节,激活的CaMKⅡ通过多种途径调节细胞内Ca2+平衡。已有研究表明CaMKⅡ的激活可以磷酸化肌浆网中多种蛋白质,包括肌浆网钙泵、受磷蛋白和兰尼碱受体等,通过磷酸化这些蛋白质调节肌浆网钙离子平衡,但目前尚不清楚缺血后适应是否对心肌胞内CaMKⅡ含量和活性存在影响[3,14]。本研究观察到心肌缺血再灌注组肌浆网CaMKⅡ含量和活性较假手术组均降低,这与先前的报道一致[9];缺血后适应组、rhTNFR:Fc 并缺血再灌注组及rhTNFR:Fc 并缺血后适应组CaMKⅡ含量也较假手术组均降低,提示缺血后适应以及应用rhTNFR:Fc 不能完全消除缺血再灌注降低CaMKⅡ含量的作用。但是缺血后适应能减轻缺血再灌注时CaMKⅡ活性降低的程度,从而维持CaMKⅡ活性接近正常水平,有利于肌浆网多种蛋白质的磷酸化,发挥肌浆网对钙离子摄取和释放的功能,以维持胞内钙稳态,减轻缺血再灌注时钙超载的发生,这与Osada等[15]有关缺血预适应能维持缺血再灌注时肌浆网CaMKⅡ活性的报道一致,表明肌浆网CaMKⅡ在心肌缺血后适应的过程中起重要作用。
重组人肿瘤坏死因子受体融合蛋白可以特异性地与TNF-α 结合,从而阻断TNF-α 与其受体的相互作用,目前已有效用于治疗多种炎症性疾病[16]。近年来研究发现,低剂量TNF-α 对组织细胞具有一定的保护作用,而大剂量TNF-α 引起组织细胞损害,最近有报道不同剂量TNF-α 对肺微血管内皮细胞Nrf2 转录调节活性产生不同影响[17]。本研究结果显示,心肌缺血后适应时,TNF-α 含量降低,CaMKⅡ活性明显增强,在应用rhTNFR:Fc 中和TNF-α 后,CaMKⅡ活性进一步增强,其机制可能是心肌缺血区TNF-α 降低到适度水平主要与TNFR2 受体结合[6,9],引起细胞内钙离子轻度增加[18],能有效激活多种钙离子依赖蛋白酶,包括CaMKⅡ、ERK、MSKI、cPLA2、PKC 等。
本研究尚存在一定局限性,包括未直接观察心肌组织不同的TNF-α 水平对TNFR1 受体和TNFR2 受体功能以及CaMKⅡ含量和活性的影响,如能敲除或者沉默CaMKⅡ基因和TNFR2 基因、在后适应前给予CaMKⅡ抑制剂则更能说明CaMKⅡ的作用,这些有待继续研究。
(致谢:在实验过程中,刘学刚硕士、杨勇博士提供了技术方面的帮助并提出了建设性意见,在此表示感谢。)
[1] Laskey WK. Brief repetitive balloon occlusions enhance reperfusion during percutaneous coronary intervention for acute myocardial infarction:a pilot study[J]. Catheter Cardiovasc Interv,2005,65(3):361-367.
[2] Granfeldt A,Lefer DJ,Vinten-Johansen J. Protective ischaemia in patients:preconditioning and postconditioning[J].Cardiovasc Res,2009,83(2):234-246.
[3] Ovize M,Baxter GF,Di Lisa F,et al. Postconditioning and protection from reperfusion injury:where do we stand?Position paper from the Working Group of Cellular Biology of the Heart of the European Society of Cardiology[J].Cardiovasc Res,2010,87(3):406-423.
[4] Couchonnal LF,Anderson ME. The role of calmodulin kinase II in myocardial physiology and disease[J]. Physiology,2008,23(3):151-159.
[5] Yu Z,Wang ZH,Yang HT,et al. Calcium/calmodulindependent protein kinase II mediates cardioprotection of intermittent hypoxia against ischemic-reperfusion-induced cardiac dysfunction[J]. Am J Physiol Heart Circ Physiol,2009,297(2):H735-H742.
[6] Kleinbongard P,Schulz R,Heusch G. TNFα in myocardial ischemia/reperfusion,remodeling and heart failure[J].Heart Fail Rev,2011,16(1):49-69.
[7] Kin H,Wang NP,Mykytenko J,et al. Inhibition of myocardial apoptosis by postconditioning is associated with attenuation of oxidative stress-mediated nuclear factor-κB translocation and TNFα release[J].Shock,2008,29(6):761-768.
[8] Yellon DM,Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med ,2007,357(11):1121-1135.
[9] Schulz R,Heusch G.Tumor necrosis factor-α and its receptors 1 and 2:Yin and Yang in myocardial infarction?[J]. Circulation,2009 ,119(10):1355-1357.
[10] Deuchar GA,Opie LH,Lecour S. TNFα is required to confer protection in an in vivo model of classical ischaemic preconditioning[J]. Life Sci,2007,80(18):1686-1691.
[11] Kleinbongard P,Heusch G,Schulz R. TNFα in atherosclerosis,myocardial ischemia/reperfusion and heart failure[J]. Pharmacol Ther,2010,127(3):295-314.
[12] Defer N,Azroyan A,Pecker F,et al. TNFR1 and TNFR2 signaling interplay in cardiac myocytes[J]. J Biol Chem,2007,282(49):35564-35573.
[13] Netticadan T,Temsah R,Osada M,et al. Status of Ca2+/calmodulin protein kinase phosphorylation of cardiac SR proteins in ischemia-reperfusion[J]. Am J Physiol,1999,277(3 Pt 1):C384-C391.
[14] Pagliaro P,Moro F,Tullio F,et al. Cardioprotective pathways during reperfusion:focus on redox signaling and other modalities of cell signaling[J]. Antioxid Redox Signal,2011,14(5):833-850.
[15] Osada M,Netticadan T,Kawabata K,et al. Ischemic preconditioning prevents I/R-induced alterations in SR calcium-calmodulin protein kinase II[J]. Am J Physiol Heart Circ Physiol,2000,278(6):H1791-H1798.
[16] Tracey D,Klareskog L,Sasso EH,et al. Tumor necrosis factor antagonist mechanisms of action:a comprehensive review[J]. Pharmacol Ther,2008,117(2):244-279.
[17] 甯交琳,莫立稳,王正国,等. 不同剂量TNF-α 对Nrf2 转录调节活性的影响[J]. 中国病理生理杂志,2010,26(4):791-796.
[18] Jupp OJ,Vandenabeele P,MacEwan DJ. Distinct regulation of cytosolic phospholipase A2phosphorylation,translocation,proteolysis and activation by tumour necrosis factor-receptor subtypes[J].Biochem J,2003,374(2):453-461.
