DNMT 在胃癌中的表达及DNMT 抑制剂5-氮杂-2'-脱氧胞苷对胃癌的影响
2012-12-23汤为学王子卫
何 苗, 汤为学, 姜 蓉, 范 晶, 张 能, 查 朗, 王子卫△
(重庆医科大学1附属第一医院普通外科,2附属第一医院实验研究中心,3基础医学院,4附属第一医院急诊科,重庆400016)
DNA 甲基化转移酶(DNA methyltransferase,DNMT)是催化DNA 甲基化修饰的生物酶。一般认为DNMT 高表达导致抑癌基因高甲基化并失活是肿瘤发展的表观遗传机制[1]。但也有资料表明DNMT 低表达及癌基因低甲基化并激活亦是肿瘤的重要特点[2-4];加上既往对DNMT 的研究集中在DNMT1、DNMT3A 和DNMT3B,而对DNMT2 和DNMT3L 探索甚少。本文遂全面分析5 种DNMT 在胃癌与胃黏膜的表达特点,以期对胃癌(肿瘤)表观遗传学的研究提供参考。
材 料 和 方 法
1 材料
胃癌与对应癌旁组织(60 对)由重庆医科大学附属第一医院胃肠外科提供,标本病理诊断明确。SGC-7901、MKN-45(胃癌细胞株)及GES-1(胃黏膜上皮细胞株)由重庆医科大学附属第一医院实验研究中心馈赠。DNMT1、DNMT2、DNMT3A、DNMT3B 和DNMT3L 抗体购自Santa Cruz;免疫组化与免疫荧光相关试剂购自中杉金桥;免疫印迹相关材料购自碧云天;噻唑蓝(MTT)和5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine)购自Sigma。其它基本实验材料购自鼎国昌盛与惠尔利公司。
2 方法
2.1 免疫组织化学 免疫组化法参照中杉金桥公司提供的试剂盒说明书进行。Ⅰ抗孵育采用4 ℃过夜(Ⅰ抗稀释比为1∶50);显色时间均为5 min。
2.2 免疫组化结果判断 根据细胞着色程度区分染色(a):0(无染色),1(浅黄色),2(黄褐色),3(褐红色)。区分染色细胞占相应细胞总体的比率(b):1(b <25%),2(25% ≤b <50%),3(50% ≤b <75%),4(b≥75%)。再根据a × b 判断阳性结果(c):阴性(c=0),弱阳性(c =1、2),阳性(c =3、4、6、8),强阳性(c =9、12)。计算表达率包括弱阳性、阳性和强阳性的资料。
2.3 细胞培养 SGC-7901、MKN-45 和GES-1细胞均用加10%胎牛血清的RPMI-1640 培养基培养;常规置于37 ℃、5%CO2孵箱内。3 d 传代或更换培养基1 次。
2.4 免疫荧光 接种细胞株至96 孔板,孵育24 h。将孔板内细胞按固定(4%多聚甲醛,室温20 min)、打孔(0.5%Triton X-100,37 ℃20 min)、封闭(山羊血清封闭液,37 ℃30 min)、Ⅰ抗孵育(1∶50,4 ℃过夜)、荧光Ⅱ抗孵育(1∶50,37 ℃1 h)的顺序处理。设立PBS 代替Ⅰ抗的阴性对照。荧光显微镜观察结果。
2.5 Western 免疫印迹 收集细胞,免疫印迹法按参考文献[5]记录的方法进行,实验重复3 次,Quantity One 软件分析结果。
2.6 噻唑蓝比色法 细胞于对数生长期接种至96孔板,1 ×104cells/well,250 μL 培养基/well。5-氮杂-2'-脱氧胞苷终浓度5 μmol/L、50 μmol/L 和500 μmol/L 处理上述细胞。于1、2、3、4、5 d 加MTT(5 g/L,20 μL/well),4 h 后弃培养基加二甲亚砜(150 μL/well),酶标仪490 nm 波长测A 值。设立阴性对照(不加药)及空白对照(无细胞)组,实验设复孔5 个。细胞增殖率= (A目的- A空白)/(A对照-A空白)。
2.7 流式细胞仪检测 细胞平均接种至2 个培养瓶,培养24 h。5-氮杂-2'-脱氧胞苷终浓度50 μmol/L处理其中之一,继续培养96 h。收集2 瓶细胞,PBS 洗涤2 次,分别加入1 mL 70%乙醇中4 ℃固定过夜。第2 d 送流式细胞仪检测细胞周期与凋亡率。实验重复3 次。
3 统计学处理
采用SPSS 17.0 统计软件处理。计数资料用卡方检验、Fisher 精确概率检验或符号秩检验分析。计量资料以均数±标准差(±s)表示,用单因素方差分析比较均数。以P <0.05 为差异有统计学意义。
结 果
1 DNMT 在人胎盘组织表达
根据部分DNMT 抗体说明,取胎盘组织为DNMT 阳性对照标本。5 种DNMT 均在人胎盘组织表达,以DNMT2 显著,见图1,提示抗体与免疫组化步骤无误。

Figure 1. Expression of DNMT2 in human placenta tissue(×400).图1 DNMT2 在人胎盘组织的表达
2 胃癌与癌旁组织中DNMT 的表达

Figure 2. Expression of DNMT in gastric cancer and corresponding non-cancerous tissues(×400).图2 DNMT 在人胃癌及癌旁组织的表达
免疫组化法检测胃癌及癌旁组织DNMT 表达的结果见图2、3。癌旁组织DNMT1 表达率63. 3%(38/60),DNMT2 表达率93.3%(56/60),DNMT3A表达率71.7%(43/60),DNMT3B表达率93.3%(56/60),DNMT3L 表达率75.0%(45/60)。胃癌组织DNMT1 表达率11. 7% (7/60),DNMT2 表达率43.3%(26/60),DNMT3A 表达率15.0%(9/60),DNMT3B 表达率85.0%(51/60),DNMT3L表达率36.7%(22/60)。可见除DNMT3B 外,其余DNMT 在胃癌的表达率不如癌旁组织(P <0. 05)。此外,DNMT1 和DNMT3L 为胞核胞浆共表达,DNMT2 为胞核表达,而DNMT3A 和DNMT3B 为胞浆表达。
3 DNMT 在胃癌与癌旁组织的配对比较
胃癌与自身癌旁组织配对,60 对组织的DNMT表达差异见图4。其中癌旁组织表达低于胃癌组织记为“-”(如癌旁为阳性,癌为强阳性);癌旁组织表达高于胃癌组织记为“+”(如癌旁为阳性,癌为弱阳性);两者表达无差异记为“0”(如两者均为阳性)。运用符号秩检验分析5 种DNMT 在胃癌及癌旁组织的差异,发现DNMT1 和DNMT3A 在胃癌表达显著低于癌旁组织(P <0.01);DNMT2 和DNMT3L 在胃癌表达低于癌旁组织(P <0.05);DNMT3B 在胃癌及癌旁中表达无显著差异(P >0.05)。与结果2 相符合。
4 DNMT 与胃癌临床特征的关联
卡方检验及Fisher 精确概率检验分析DNMT 与胃癌临床特征的关联,结果见表1。DNMT2 表达与胃癌分化及临床分期相关(P <0.05);DNMT3A 表达与胃癌临床分期相关(P <0.05)。而其余DNMT 与性别、年龄、肿瘤大小、幽门螺旋杆菌感染等临床特征无显著关联(P≥0.05)。
5 胃癌与胃上皮细胞株中DNMT 的定位
免疫荧光法研究DNMT 在胃癌与胃上皮细胞中的定位发现,DNMT2 在胞核表达显著,见图5A;DNMT3B 和DNMT3L 在胞浆表达,见图5B;而DNMT1与DNMT3A 特异绿色荧光甚弱。
6 胃癌与胃上皮细胞株中DNMT 的差异
免疫印记法研究DNMT 在胃癌与胃上皮细胞中表达差异,结果见图6、7。DNMT3B 在GES-1 细胞中表达较MKN-45 和SGC-7901 细胞增强(P <0.05);DNMT2 和DNMT3L 在各细胞表达无显著差异(P >0.05);而DNMT1 和DNMT3A 在各细胞几无表达。

Figure 3. The positive expression of DNMT in 60 pairs of gastric cancer and corresponding non-cancerous tissues. * P <0.05,**P <0.01 vs non-cancerous tissue.图3 DNMT 在60 对人胃癌及癌旁组织的阳性表达

Figure 4. Differential expression of DNMT between gastric cancer and corresponding non-cancerous tissues.-:expression of DNMT in non-cancerous tissue was lower than that in gastric cancer tissue. +:expression of DNMT in non-cancerous tissue was higher than that in gastric cancer tissue. 0:expression of DNMT in non-cancerous tissue was similar to that in cancer tissue. DNMT1 and DNMT3A expression in cancer tissues was lower than that in non-cancerous tissues (**P <0.01,sign rank test). DNMT2 and DNMT3L expression in cancer tissues was lower than that in non-cancerous tissues (* P <0.05,sign rank test). The differential expression of DNMT3B between cancer and non-cancer was not significant .图4 胃癌及配对癌旁组织的DNMT 差异

表1 不同胃癌临床特征中DNMT 的表达差异Table 1. Differential expression of DNMT in different clinicopathologic features of gastric cancer[n(%)]

Figure 5. Fluorescence microscopy image of DNMT expression in cell lines(×100). A:DNMT2 was located in nucleus(SGC-7901);B:DNMT3B was located in cytoplasm(MKN-45).图5 DNMT 表达定位
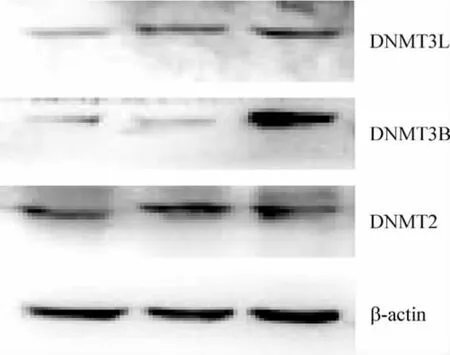
Figure 6. Protein expression of some DNMT in cell lines detected by Western blotting.图6 部分DNMT 蛋白在胃癌细胞与胃黏膜上皮细胞表达
7 5-氮杂-2'-脱氧胞苷对胃癌与胃上皮细胞增殖的影响
噻唑蓝比色法分析5-氮杂-2'-脱氧胞苷不同浓度及作用时间对SGC-7901、MKN-45 和GES-1 细胞增殖的影响,结果见图8。5-氮杂-2'-脱氧胞苷对各细胞株增殖率无显著影响(P >0.05)。
8 5-氮杂-2'-脱氧胞苷对胃癌细胞与胃黏膜上皮细胞周期分布与凋亡的影响
流式细胞术分析5-氮杂-2'-脱氧胞苷对胃癌细胞与胃黏膜上皮细胞周期分布和凋亡率的影响,结果见图9、10。5-氮杂-2'-脱氧胞苷对各细胞株周期分布与凋亡无显著影响(P >0.05)。
讨 论
DNA 甲基化是表观遗传学在肿瘤领域的研究热点[6]。异常DNA 甲基化可致肿瘤基因转录异常,并被看作肿瘤发展表观遗传机制之一[7]。因肿瘤具有整体基因组低甲基化及抑癌基因高甲基化的特点[8],且DNMT 是催化DNA 甲基化修饰的生物酶,故普遍认为DNMT 在肿瘤中异常表达[9]。DNMT 可分DNMT1、DNMT2、DNMT3A、DNMT3B 和DNMT3L 5 种[10-11]。
一般理论是,各种DNMT 在肿瘤高表达,通过高甲基化抑癌基因并抑制其转录而促进肿瘤发展[12-13]。但肿瘤基因组也有整体甲基化率降低的特点[14]。例如正常细胞基因组CpG 岛甲基化率高达80%,而癌细胞中则降低20%至60%[15],此现象不能被DNMT 高表达所解释。且不少研究证实癌基因低甲基化并激活亦是肿瘤重要表观遗传特点[4,14,16],这让我们疑惑“抑癌基因高甲基化失活”与“癌基因低甲基化激活”谁在肿瘤中起主导作用?加上新近资料[3]发现DNMT3A 在肿瘤中表达降低,并与肿瘤增殖、侵袭和转移负相关(起抑癌基因作用)!又让我们深思DNMT 低表达与癌基因低甲基化并激活的联系,及此联系与肿瘤的关系。总之,已有不少资料向肿瘤中DNMT 绝对高表达的理论提出挑战。

Figure 7. Differential expression of some DNMT in different cell lines. DNMT3B expression was higher in GES-1 cells than in MKN-45 and SGC-7901 cells. ±s.n=3. **P <0.05 vs SGC-7901 and MKN-45.图7 DNMT 在胃癌与胃上皮细胞的表达差异

Figure 8. The growth rates of different cell lines with 5-aza-2'-deoxycytidine treatment (MTT assay). A:SGC-7901 cells;B:MKN-45 cells;C:GES-1 cells. ±s.n=5.图8 细胞株经5-氮杂-2'-脱氧胞苷处理后的增殖率

Figure 9. The cell cycle distribution of cell lines with 5-aza-2'- deoxycytidine treatment(flow cytometry analysis).C:control;T:treated with 5-aza-2'-deoxycytidine.±s.n=3.图9 细胞株经5-氮杂-2'-脱氧胞苷处理后的周期分布

Figure 10. The apoptotic rates of cell lines with 5-aza-2'-deoxycytidine treatment(flow cytometry analysis). ±s.n=3.图10 细胞株经5-氮杂-2'-脱氧胞苷处理后的凋亡率
本研究结果提示,“DNMT 高表达导致抑癌基因高甲基化并失活”可能并非胃癌发展的关键机制,至少胃癌中抑癌基因的高甲基化并非由DNMT 高表达所致。此外,抑制DNMT 可能对胃癌与胃上皮细胞增殖、周期分布、凋亡的影响也十分有限。至少在短期内(5 d),抑制DNMT 不对胃癌增殖、凋亡起决定性作用。故本文不支持肿瘤DNMT 绝对高表达并促癌发展的观点。那么胃癌是否存在DNMT 低表达与癌基因低甲基化并激活的联系?以及此联系是否与胃癌发展相关?还有构建DNMT 过表达载体转染胃癌细胞是否对其增殖、凋亡有影响?目前尚不能确定,亟待进一步实验证实。
肿瘤表观遗传研究属新兴科研领域,未知性与不确定性强;近年此领域虽已获不少进展,但可用于肿瘤临床诊治的仍稀少,故需更多学者前赴后继的探索与付出。
[1] Harder J,Opitz OG,Brabender J,et al. Quantitative promoter methylation analysis of hepatocellular carcinoma,cirrhotic and normal liver[J]. Int J Cancer,2008,122(12):2800-2804.
[2] Yegnasubramanian S,Haffner MC,Zhang Y,et al. DNA hypomethylation arises later in prostate cancer progression than CpG island hypermethylation and contributes to metastatic tumor heterogeneity[J]. Cancer Res,2008,68(21):8954-8967.
[3] Gao Q,Steine EJ,Barrasa MI,et al. Deletion of the de novo DNA methy-ltransferase Dnmt3a promotes lung tumor progression[J]. Proc Natl Acad Sci U S A,2011,108(44):18061-18066.
[4] Radhakrishnan VM,Jensen TJ,Cui H,et al.Hypomethylation of the 14-3-3σ promoter leads to increased expression in non-small cell lung cancer[J]. Genes Chromosomes Cancer,2011,50(10):830-836.
[5] 何 苗,汤为学,姜 蓉,等. DNMT 在幽门螺杆菌感染与非感染胃黏膜组织的表达差异[J]. 中国生物化学与分子生物学杂志,2011,27(11):1032-1038.
[6] Esteller T. Detection and interpretation of altered methylation patterns in cancer cells[J]. N Engl J Med,2008,358(11):48-59.
[7] 林东军,郑永江,方志刚,等. 急性白血病p53 基因p1启动子区域DNA 甲基化研究[J]. 中国病理生理杂志,2008,24(7):1327-1330.
[8] Daniel FI,Cherubini K,Yurgel LS,et al. The role of epigenetic transcription repression and DNA methyltransferases in cancer[J]. Cancer,2011,117(4):677-687.
[9] De Marzo AM,Marchi VL,Yang ES,et al. Abnormal regulation of DNA methyltransferase expression during colorectal carcinogenesis[J]. Cancer Res,1999,59(16):3855-3860.
[10] Goll MG,Kirpekar F,Maggert KA,et al. Methylation of tRNAAspby the DNA methyltransferase homolog Dnmt2[J]. Science,2006,311(5759):395-398.
[11] Kim H,Park J,Jung Y,et al. DNA methyltransferase 3-like affects promoter methylation of thymine DNA glycosylase independently of DNMT1 and DNMT3B in cancer cells[J]. Int J Oncol,2010,36(6):1563-1572.
[12] Fu HY,Shen JZ,Wu Y,et al. Arsenic trioxide inhibits DNA methyltransferase and restores expression of methylation-silenced CDKN2B/CDKN2A genes in human hematologic malignant cells[J]. Oncol Rep,2010,24(2):335-343.
[13] Tang SC,Wu MF,Wong RH,et al. Epigenetic mechanisms for silencing glutathione S-transferase M2 expression by hypermethylated specificity protein 1 binding in lung cancer[J]. Cancer,2011,117(14):3209-3221.
[14] Stefanska B,Huang J,Bhattacharyya B,et al. Definition of the landscape of promoter DNA hypomethylation in liver cancer[J]. Cancer Res,2011,71(17):5891-5903.
[15] Kristensen LS,Nielsen HM,Hansen LL. Epigenetics and cancer treatment[J]. Eur J Pharmacol,2009,625(1-3):131-142.
[16] He Y,Cui Y,Wang W,et al. Hypomethylation of the hsa-miR-191 locus causes high expression of hsa-mir-191 and promotes the epithelial-to-mesenchymal transition in hepatocellular carcinoma[J]. Neoplasia,2011,13(9):841-853.
