三阴型乳腺癌FOXA1 和BRCA1 的表达及其对预后的意义*
2012-12-23蒋光愉何伟丽王宁霞
蒋光愉, 李 红, 何伟丽, 王宁霞△
(暨南大学附属第一医院1病理科,2乳腺外科,广东 广州510632)
2011 年,在瑞士圣加仑国际乳腺癌研讨会上Gnant 等[1]总 结 了 三 阴 型 乳 腺 癌(triple negative breast cancer,TNBC)的临床特点,概括为:(1)发病年龄低;(2)肿瘤直径较大;(3)肿瘤恶性程度较高,肿瘤分化程度低,病理学分级高,常表现有基底样乳腺癌的改变;(4)转移、复发风险较大;(5)5 年生存率低。TNBC 发病率在15% ~20%之间,治疗手段单一,预后较非三阴型乳腺癌差,已成为目前国内外乳腺癌研究的热点。本研究应用免疫组化法对三阴型、luminal 型和HER-2 过表达型乳腺癌组织中叉头框蛋白A1(forkhead box protein A1,FOXA1)、BRCA1 蛋白、P53 和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达进行比较,评估4 项指标在预后方面的意义。
材 料 和 方 法
1 材料
收集本院2007 年10 月至2012 年1 月乳腺癌标本113 例,根据免疫组化雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)和HER-2 的表达情况,分为3 组:A 组:ER、PR 和HER-2 均为阴性的TNBC 组,共42 例,平均年龄(45.12 ±10.73 )岁,肿瘤直径平均为(3.98 ±2.78)cm;B 组:ER(+)和/或PR(+)、HER-2(- / +)的luminal 组,共50 例,平均年龄(51.18 ±9.20)岁,肿瘤直径平均(2.17 ± 1.23)cm;C 组:ER(- )、PR(-)、HER-2(+ + / + + +)或荧光原位杂交(fluorescence in situ hybrilization,FISH)检测HER-2 阳性的HER-2 过表达组,共21 例,平均年龄(50.29 ±10.43)岁,肿瘤直径平均(2.87 ±1.38)cm。A 组为三阴组,B 和C 组为非三阴组。分析3 组间发病年龄、肿瘤大小、临床分期、复发及转移以及肿瘤病理组织学分级与FOXA1、BRCA1、P53 及VEGF 表达的相关性。
2 方法
113 例乳腺癌样本切除后均用10%甲醛液固定后,经脱水、石蜡包埋切成厚约4 μm 切片,用免疫组化EnVision 两步法检测3 组样本FOXA1、BRCA1、P53 和VEGF 表达情况。FOXA1 多克隆抗体购自Santa Cruz 生物制剂公司,工作浓度为1∶200;BRCA1鼠抗人抗体购自福州迈新生物技术开发有限公司,工作浓度为1∶40。P53 单克隆抗体和VEGF 多克隆抗体购自福州迈新生物技术开发有限公司,工作浓度均为1∶50。阳性对照片为已知的阳性表达片(由以上生物制剂公司提供),阴性对照片为PBS 液代替Ⅰ抗进行,每组每次实验均设阴性对照片。
3 结果判断
乳腺癌临床分期根据2011 年乳腺癌临床实践指南(中国版)判定。
原发肿瘤大小(tumor,T):Tx:无法评估原发肿瘤;T0:没有原发肿瘤证据;Tis:原位癌;T1:≤2 cm;T2:2 ~5 cm;T3:≥5 cm,如果肿瘤略大于或小于某一临界值,用四舍五入法进行归类。
区域淋巴结(lymph node,LN or N):Nx:区域淋巴结无法评估(例如既往已切除);N0:无区域淋巴结转移;N1:1 ~3 个淋巴结转移;N2:4 ~9 个淋巴结转移;N3:10 个以上淋巴结转移。
远处转移(metastasis,M):M0:无远处转移的临床或影像学证据;M1:体格检查和影像学方法发现远处转移和(或)组织学证实超过0.2 mm 的转移灶。
0 期:TisN0M0; Ⅰ期:T1N0M0、T0N1M0、T1N1M0(淋巴结微转移);Ⅱ期:T0N1M0、T1N1M0、T2N0M0、T2N1M0、T3N0M0;Ⅲ 期: T0N2M0、T1N2M0、T2N2M0、T3N1M0、T3N2M0、T4N0M0、T4N1M0、T4N2M0、任何TN3M0;Ⅳ期:任何T 任何N,M1。
Nottingham Combined Histology Grade 改良的SBR 分级系统根据:腺管形成程度、细胞核多形性、核分裂计数;每项1 分(良好)~3 分(差),3 类分数相加,1 级:3 ~5 分;2 级:6 ~7 分;3 级:8 ~9 分。
FOXA1 在癌细胞的胞核表达,部分在胞浆表达,阳性表达的百分比(P)分成11 个等级:0 分:0;1 分:0 ~10%;2 分:10% ~20%;3 分:20% ~30%,依次类推,最高为10 分。阳性表达的强度(I)分成3 个等级:1 级:黄色;2 级:棕黄色;3 级:棕色。最后得分(S)=P×I,S 在0 ~3 分之间为表达阴性,S 在4 ~30分之间则为阳性表达[2]。BRCA1 阳性表达在正常细胞为细胞核,在癌细胞为细胞浆,棕黄色细胞数≥10%即为阳性[3]。P53 阳性表达表现为细胞核呈棕色,≥5%即为阳性;VEGF 阳性表达表现为细胞浆呈棕色,≥5%即为阳性,见图1。
4 统计学处理
采用SPSS 11.0 统计分析软件进行统计分析。计量资料以均数±标准差(±s)表示。各组样本率之间的差异用χ2检验。各组临床指标间的比较采用完全随机设计资料方差分析,方差不齐时,检验各组间均数差异选用Tukey'sT2 法进行比较,以P <0.05 为差异有统计学意义。
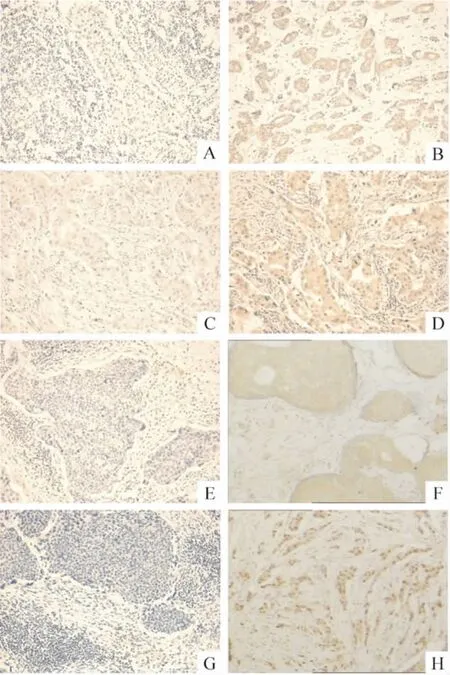
Figure 1. Immunohistochemical staining of breast cancer tissues(× 100). A:FOXA1 negative expression;B:FOXA1 positive control;C:BRCA1 negative expression;D:BRCA1 positive expression ;E:VEGF negative expression;F:VEGF positive expression;G:P53 negative expression;H:P53 positive expression.图1 乳腺癌组织4 种抗体免疫组化染色
结 果
1 各组临床指标间的比较
三阴组(A 组)患者发病年龄低于非三阴组(B和C 组)(P <0.05),平均肿瘤直径大于非三阴组(B和C 组)(P <0.05),临床分期Ⅱ期比率(52.4%)高于非三阴组(B 和C 组),但在Ⅲ期比率中,A 组(38.1%)低于C 组(42.9%),A 组复发率高于其它2 组(P <0.05),见表1。
1.1 研究对象 2014年1月-2014年12月南京市胸科医院的门诊及住院呼吸系统疾病患者6 984例,男性4 681例,女性2 303例,年龄11~99岁,平均年龄(55.24±18.62)岁;按年龄分为五组,≤20岁组258例,20~40岁组1 322例,40~60岁组2 337例,60~80岁组2 626例,≥80岁组441例;按不同季节分组,春季(3-5月)1 931例,夏季(6-8月)1 742例,秋季(9-11月)1 650例,冬季(12-2月)1 661例;所有病例均存在呼吸道感染的临床表现:持续性咳嗽、发热、呼吸急促或呼吸困难;肺部听诊可闻及细湿啰音等。所有患者均知情同意。
2 FOXA1 和BRCA1 在3 组中的表达情况
FOXA1 总的阳性表达率为63.7%(72/113),A组阳性表达率为45.2%(19/42),B 组阳性表达率为88.0%(44/50),C 组阳性表达率为42.9%(9/21),FOXA1 在3 组中的表达存在差异;BRCA1 总的阳性表达率为47.8% (54/113),A 组阳性表达率为66.7%(28/42),B 组阳性表达率为44.0%(22/50),C 组阳性表达率为19.0%(4/21),BRCA1 在3 组中的表达存在显著差异(P <0.01),见表2。
3 FOXA1 表达与临床病理指标间的关系
FOXA1 阳性表达样本中肿瘤直径均值为(2.81 ± 1.80)cm,小 于 阴 性 表 达 组[(3.42 ±2.67)cm](P <0.05);FOXA1 阳性表达率在Ⅰ(91.7%)、Ⅱ(64.0%)临床分期中所占比例较大;在组织学分级1 级(88.9%)、2 级(61.2%)的组别中表达率较高(P <0.05);FOXA1 表达阳性复发率(16.7%)低于FOXA1 表达阴性样本(34.1%)(P<0.05),见表3。
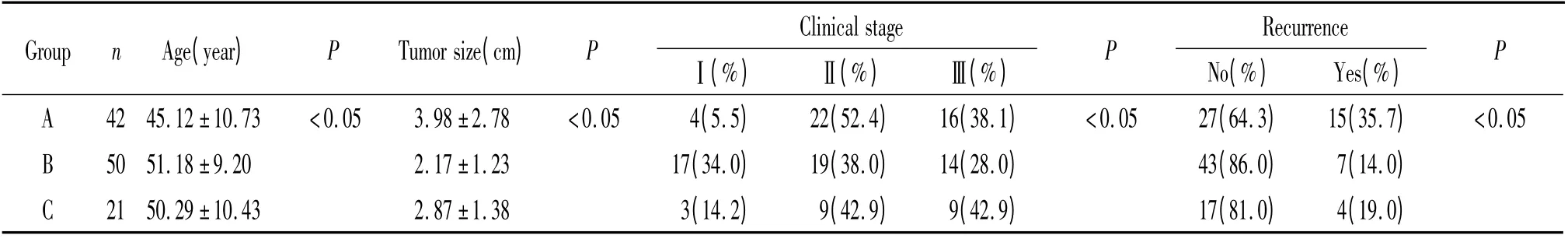
表1 各组临床情况Table 1. The clinical circumstances of each group
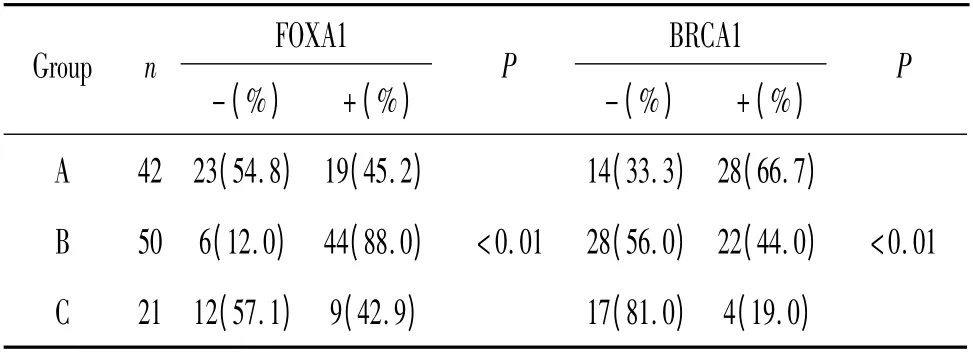
表2 FOXA1 和BRCA1 在各组的表达情况Table 2. FOXA1 and BRCA1 expression in each group
4 BRCA1 表达与临床病理指标间的关系
BRCA1 阳性表达样本中肿瘤直径均值为(3.55±2.63)cm,大于阴性表达组[(2.54 ±1.35)cm](P<0.05);BRCA1 阳性表达率在Ⅲ(61.4%)临床分期中所占比例较大(P <0.05);在组织学分级3 级(58.7%)的组别中表达率较高(P <0.05);BRCA1阳性表达复发率为(69.2%),高于BRCA1 阴性表达组(30.8%)(P <0.05),见表3。
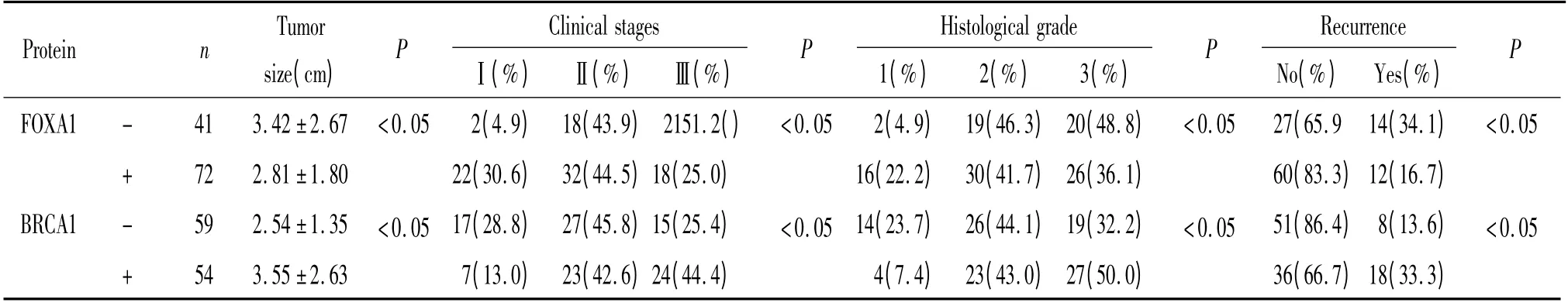
表3 FOXA1 和BRCA1 表达与各临床病理指标的关系Table 3. The relationship between FOXA1 and BRCA1 expression and the clinicopathological parameters
5 FOXA1 表达与P53 和VEGF 表达的关系
FOXA1 在P53 阴性表达样本中的阳性表达率为74.1%(43/58),高于P53 阳性表达组[52.7%(29/55)](P <0.05);FOXA1 在VEGF 阴性表达样本中的阳性表达率为73.2%(41/56),高于VEGF 阳性表达组[54.4%(31/57)](P <0.05),见表4。
6 BRCA1 表达与P53 和VEGF 表达的关系
BRCA1 在P53 阳性表达样本中的阳性表达率为61.8% (34/55),高于P53 阴性表达组[34.5%(20/58)](P <0.05);BRCA1 在VEGF 阳性表达的样本中的阳性表达率为59.6%(34/57),高于VEGF阴性表达组[35.7%(20/56)](P <0.05),见表4。
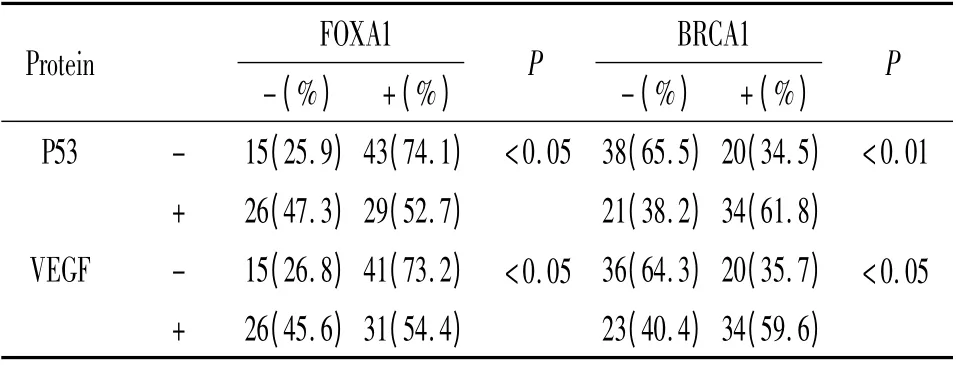
表4 FOXA1 和BRCA1 表达与P53 和VEGF 表达的关系Table 4. The relationship between FOXA1,BRCA1 expression and P53,VEGF expression
讨 论
乳腺癌是一类复杂而多变的全身性疾病,乳腺肿瘤的发生、发展往往伴随乳腺组织多方面生物学行为改变。目前,公认的乳腺癌分子亚型是[1]:luminal A 型(ER 和/或PR 阳性,HER-2 阴性,Ki 67表达<14%),luminal B 型(ER 阳性或PR 阳性,HER-2 阳性,Ki 67 表达>14%),HER-2 过表达型(Her-2 + + +或HER-2 + +或FISH +),basal-like 型(ER、PR 和HER-2 均为阴性,CK5/6 及EGFR 呈阳性表达)。然而,乳腺癌并不能被几类或者几个亚型很好地概括。近年来,随着分子生物学技术的不断发展及其在乳腺癌研究中的应用,已鉴定出越来越多能反映预后和提供治疗靶点的标记物。三阴型乳腺癌是基因表达谱分析(analysis of gene express profiles)应用于临床后,被逐渐认识到的一个乳腺癌亚型,它有特殊的病理特征和较差的预后而成为研究热点。因此,乳腺癌的分型仍需要更多的病理学依据。除此之外,不同亚型的乳腺癌在治疗效果及预后有明显差别,并不能完全用其划分的几个生物学指标来解释。
1 三阴型乳腺癌的临床情况
2 FOXA1 表达与临床病理指标间的关系
叉头框蛋白(FOX)是DNA 转录调节及保护家族成员之一,它调控着生物演化的多个关键环节。FOX 因子的丢失和扩增都可能改变细胞的生长环境以及促进肿瘤细胞的发生和发展。叉头框基因是在果蝇的生物学研究中被发现并命名的,第一例被检测到的哺乳动物叉头框蛋白是FOX A 组的成员[3]。FOX 家族共有17 个成员,从FOXA 到FOXR,是严格按照FOX 基因转录的,各成员在调控生物学行为方面呈现多样性,包括细胞的新陈代谢、生长、增殖、分化、凋亡、侵袭、转移与更新。这些步骤与细胞的生长与自我稳定密切相关,所以FOX 蛋白的丢失与突变将导致肿瘤细胞的生成与发展。目前,已经被证实与肿瘤细胞相关的FOX 家族蛋白包括:FOXO、FOXM、FOXP、FOXC 及FOXA[4]。
Badve 等[2]发现FOXA1 总的阳性表达 率为63.4%,其中在luminal A 组的阳性表达率为84%,luminal B 组阳性表达率为40.7%,FOXA1 表达情况与乳腺癌生存率呈正相关,在预后较好的luminal 型乳腺癌中,FOXA1 阳性表达具有更好的无病生存率(disease-free survival,DFS)。本研究FOXA1 的总阳性表达率为63.7%,A 组阳性表达率为45.2%(19/42),B 组阳性表达率为88.0%(44/50),C 组阳性表达率为42.9%(9/21),FOXA1 在3 组中的表达存在差异;luminal 组(B 组)中FOXA1 阳性表达率较高(88%),与Badve 的研究接近,说明了FOXA1 在非三阴组表达最高。同时本组资料还显示FOXA1阳性表达的乳腺癌临床分期早,具有较好的组织学形态和较低的复发转移率,与肿瘤恶性指标P53 和VEGF 负相关,因此,可将FOXA1 作为乳腺癌良好预后的指标。
3 BRCA1 表达与临床病理指标间的关系
BRCA1 基因位于人染色体17q21 区域上,全长100 kb,含24 个外显子。正常情况下,野生BRCA1蛋白对正常细胞的生长有重要作用,主要是进行DNA 双螺旋机构的修复,调节细胞分裂周期的正常进行。突变BRCA1 相关乳腺癌所占比率较高,家族性乳腺癌中BRCA1 的突变率达20%~30%,在家族性卵巢癌的突变率较低,约10%~20%。有资料显示,50%的家族性乳腺癌及90%的家族性卵巢癌均存在生殖细胞上的BRCA1 基因突变[5]。BRCA1 突变基因携带者的比率约3%,BRCA1 突变基因携带者患乳腺癌的机率是55%~85%。并有研究表明,具有生殖细胞上BRCA1 突变的家族表现出较高的乳腺癌及卵巢癌的易感性,这类病人患乳腺癌的风险性是85%,患卵巢癌的风险率为60%,而且患者的发病年龄小于35 岁比率较大[6]。因此,突变BRCA1 蛋白是了解乳腺癌发展趋势及评估预后的指导性指标,本研究中检测的BRCA1 即为突变型BRCA1 基因相关蛋白。
绝大多数的乳腺癌BRCA1 基因突变携带者产生癌症有类似基底细胞样乳腺癌的改变,包括激素受体阴性、高组织学分级、血管转移、预后较差的临床病理特点[7]以及Ki67 高表达和P53 突变[8-9]。免疫组化或基因芯片技术检测三阴型乳腺癌中有50%以上表达BRCA1[10-11]。本研究BRCA1 在乳腺癌中的阳性表达率为47.8%(54/113),A 组阳性表达率为66. 7% (28/42),B 组阳性表达率为44. 0%(22/50),C 组阳性表达率为19.0%(4/21),明显提示BRCA1 在三阴型组中阳性表达率最高。同时本组资料还显示BRCA1 阳性的乳腺癌具有临床分期晚、病理组织学分级高、转移复发率高的特点。
4 FOXA1 和BRCA1 表达与P53 和VEGF 表达的关系
研究证明,许多肿瘤的发生与p53 基因的异常表达和突变有关[12],而肿瘤的演进与VEGF 有关。本研究显示FOXA1 阳性的乳腺癌与肿瘤恶性程度指标P53 和VEGF 呈负相关;BRCA1 阳性的乳腺癌与P53 和VEGF 呈正相关。
综上所述,FOXA1 有可能作为乳腺癌预后良好的指标。而BRCA1 在三阴型乳腺癌中的表达率明显高于非三阴组,还与多项乳腺癌不良指标相关,表明检测异位BRCA1 蛋白可以作为乳腺癌预后不良的指标。
[1] Gnant M,Harbeck N,Thomssen C. St. Gallen 2011:summary of the consensus discussion[J]. Breast Care,2011,6(2):136-141.
[2] Badve S,Turbin D,Thorat MA,et al. FOXA1 expression in breast cancer:correlation with luminal subtype A and survival[J]. Clin Cancer Res,2007,13(15):4415-4421.
[3] Lai E,Prezioso VR,Smith E,et al. HNF-3A,a hepatocyte-enriched transcription factor of novel structure is regulated transcriptionally[J]. Genes Dev,1990,4(8):1427-1436.
[4] Myatt SS,Lam EW. The emerging roles of forkhead box(Fox)proteins in cancer[J]. Nat Rev Cancer,2007,7(11):847-859.
[5] Welcsh PL,King MC. King,BRCA1 and BRCA2 and the genetics of breast and ovarian cancer[J]. Hum Mol Genet,2001,10(7):705-713.
[6] Miki Y,Swensen J,Shattuck-Eidens D,et al. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1[J]. Science,1994,266(5182):66-71.
[7] Vaziri SA,Krumroy LM,Elson P,et al. Breast tumor immunophenotype of BRCA1-mutation carriers is influenced by age at diagnosis[J]. Clin Cancer Res,2001,7(7):1937-1945.
[8] Miyoshi Y,Murase K,Oh K. Basal-like subtype and BRCA1 dysfunction in breast cancers[J]. Int J Clin Oncol,2008,13(5):395-400.
[9] Abd El-Rehim DM,Ball G,Pinder SE,et al. High-throughput protein expression analysis using tissue microarray technology of a large well ‐ characterised series identifies biologically distinct classes of breast cancer confirming recent cDNA expression analyses[J]. Int J Cancer,2005,116(3):340-350.
[10] Turner NC,Reis-Filho JS,Russell AM,et al. BRCA1 dysfunction in sporadic basal-like breast cancer[J].Oncogene,2007,26(14):2126-2132.
[11] Bayraktar S,Gutierrez-Barrera AM,Liu D,et al. Outcome of triple-negative breast cancer in patients with or without deleterious BRCA mutations[J]. Breast Cancer Res Treat,2011,130(1):145-153.
[12] 李红智,喻林升,王宗敏,等. 乳腺癌细胞凋亡、增殖与相关基因表达、突变的关系[J]. 中国病理生理杂志,2003,19(5):676-678.
