miR-18a 对人主动脉内皮细胞血管生成能力的影响
2012-12-23凌文华
莫 倩, 李 丹, 凌文华
(中山大学公共卫生学院营养系,广东 广州510080)
血管生成(angiogenesis)是指血管内皮细胞经过迁移、增殖、管腔形成与基质重塑等产生新生毛细血管网的过程[1]。修复性血管生成主要发生在伤口的愈合与缺血性损伤,而病理性血管生成有助于肿瘤的生长和转移,并与关节炎、糖尿病视网膜病变等有关[2]。
MicroRNA 是一类由19 ~25 个核苷酸组成的非编码小分子RNA,通过转录后调控参与了人类多种疾病的发生发展过程。miR-17 ~92 家族属于多顺反子家族,其中包括miR-17、miR-18a、miR-19a、miR-20a、miR-19b-1 和miR-92a。目前的研究多集中于促进肿瘤细胞增殖、抗凋亡以及促进肿瘤组织血管生成等方面[3],对miR-17、miR-20 和miR-92a 的报道较多,而关于miR-18a 的报道较少,特别是其对正常动脉内皮细胞血管生成功能的调节作用尚未见报道。故本研究采用体外人主动脉内皮细胞(human aortic endothelial cells,HAECs)血管生成模型,探讨miR-18a 不同表达水平对血管生成功能的调节作用,从而为miR-18a 作为血管性疾病的基因治疗靶点提供理论依据。
材 料 和 方 法
1 材料
内皮细胞培养基购自Sciencell;0.25%胰酶、人纤维黏连蛋白和人血清白蛋白购自Sigma-Aldrich;Matrigel 购自Becton Dickinson;miR-18a mimics 和inhibitor 由GenePharma 合成;LipofectamineTM2000 和Trizol 购自Invitrogen;mirVanaTMqRT-PCR miRNA Detection Kit 购自Applied Biosystems。
2 方法
2.1 细胞培养 HAECs 购自Sciencell,细胞Ⅷ因子相关抗原染色阳性。细胞在内皮细胞培养基(endothelial cell medium,ECM)添加5%胎牛血清、1%内皮细胞生长因子和青霉素(1 × 105U/L)/链霉素(100 mg/L)及5% CO2、37 ℃条件下常规培养。
2.2 转染 细胞传代至第3 代时,胰酶消化后取3×105个细胞至6 孔板培养12 h。利用LipofectamineTM2000 分别将10 nmol/L miR-18a mimics 和20 nmol/L miR-18a inhibitor 转染至细胞,转染物序列见表1。
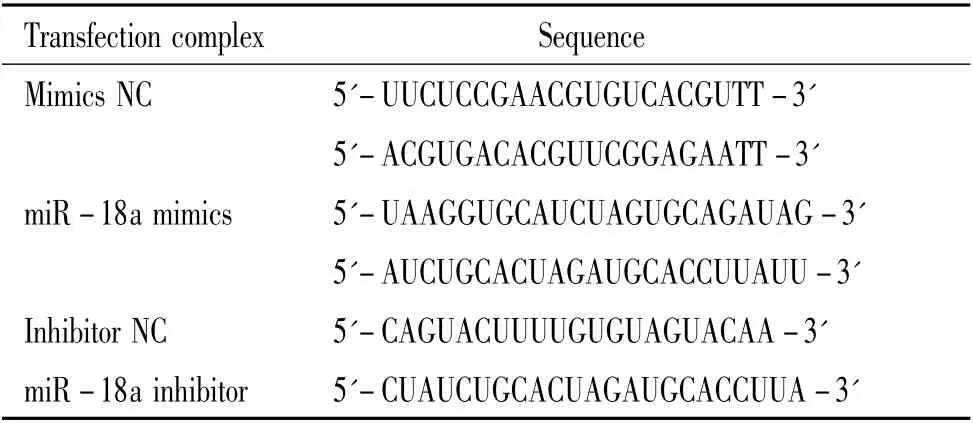
表1 转染物序列Table 1. The sequences of transfection complexes
2.3 总RNA 提取 miR-18a mimics 或inhibitor转染48 h 后,弃去培养基,PBS 清洗2 次后加入1 mL Trizol,反复吹打后室温放置5 min。加入200 μL 氯仿,剧烈振荡15 s 后室温放置10 min,4 ℃、12 000 r/min离心15 min。取上层水相约500 μL 于1.5 mL EP 管,加入500 μL 异丙醇,充分混匀,室温放置10 min,4 ℃、12 000 r/min 离心10 min。弃上清液,加入1 mL 预冷的75%乙醇,涡旋混匀,4 ℃、7 500 r/min离心5 min。弃上清液,室温晾干5 min,加入0.1%焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的双蒸水适量溶解RNA,-80 ℃保存备用。
2.4 qRT-PCR 检测 miR-18a mimics 或inhibitor 转染48 h 后Trizol 提取总RNA,TaqMan qRT-PCR 检测miR-18a 表达。每个样本取1 ng RNA 反转录为cDNA,设定反应条件:16 ℃30 min,42 ℃30 min,85 ℃5 min。PCR 按照试剂盒操作指南进行,反应条件:95 ℃10 min,40 个循环:95 ℃15 s,60 ℃1 min。U6 为内参照基因。miR-18a 引物序列:5'-UAAGGUGCAUCUAGUGCAGAUAG-3'。U6 引物序列:5'-GTGCTCGCTTCGGCAGCACATATACTAAAATTGGAACGATACAGAGAAGATTAGCATGGCCCCTGCGCAAGGATGACACGCAAATTCGTGAAGCGTTCCATATTTT-3'。
2.5 Transwell 小室迁移实验 Transwell 小室用2.5 mg/L 人纤维黏连蛋白预包被45 min。24 孔板中加入800 μL ECM 培养基并将Transwell 小室放入孔中。miR-18a mimics 或inhibitor 转染48 h 后胰酶消化细胞,无血清ECM 培养基重悬后将5 ×104个细胞接种至预包被的Transwell 小室。37 ℃培养6 h 后4%多聚甲醛固定,苏木素染色后倒置显微镜计数迁移至微孔膜下层的细胞数目。每个样本随机计数5 个视野。
2.6 体外黏附力实验 96 孔板用2.5 mg/L 人纤维黏连蛋白预包被2 h 后1%人血清白蛋白封闭1 h。miR-18a mimics 或inhibitor 转染48 h 后胰酶消化细胞,无血清ECM 培养基重悬细胞,接种2 ×104个细胞至预包被的96 孔板中,每组平行5 个样本。37 ℃培养1 h 后4%多聚甲醛固定,0.5%结晶紫染色后每孔加入100 μL 1%醋酸乙醇振荡10 min,570 nm 处测定吸光度值。
2.7 毛细血管管腔样结构形成实验 96 孔板每孔加入50 μL Matrigel,37 ℃包被30 min。miR-18a mimics 或inhibitor 转染48 h 后胰酶消化细胞,ECM培养基重悬细胞,接种细胞(每孔5 ×104个)至预包被的96 孔培养板中。37 ℃培养24 h 后4%多聚甲醛固定,0.5%结晶紫染色。随机选取5 个视野,倒置显微镜计数由内皮细胞围成完整的毛细血管管腔样结构的数量。
3 统计学处理
应用SPSS 17.0 统计软件进行分析,数据以均数±标准差(±s)表示,两组均数比较采用t 检验。以P <0.05 为差异有统计学意义。
结 果
1 内皮细胞miR-18a 的表达
与对照组相比,miR-18a mimics 转染组miR-18a 表达量增加608 倍,见图1A;miR-18a inhibitor转染组miR-18a 表达量下降69%,见图1B,差异均有统计学意义(P <0.05)。
2 体外内皮细胞血管生成功能检测
2.1 Transwell 小室迁移实验 miR-18a mimics 转染组内皮细胞迁移能力与mimics NC 组相比降低60%(P <0.01),见图2A。miR-18a inhibitor 转染组迁移能力是对照组的2 倍,见图2B,差异有统计学意义(P <0.05)。
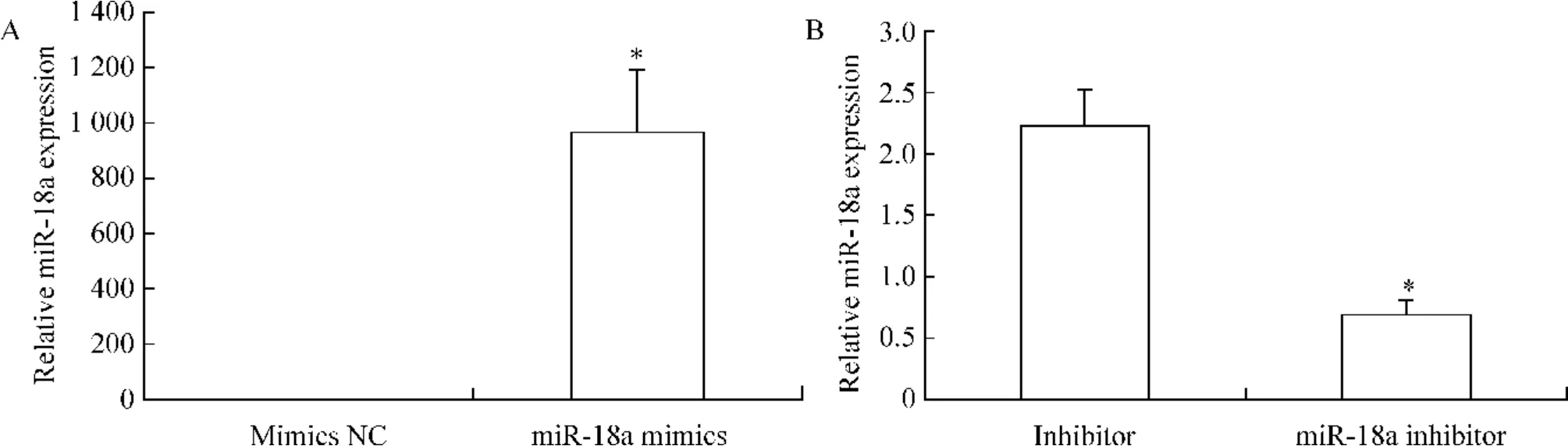
Figure 1. The expression level of miR-18a in human aortic endothelial cells after transfected with miR-18a mimics (A)or inhibitor(B). ±s.n=3. * P <0.05 vs negative control (mimics NC or inhibitor NC).图1 转染miR-18a mimics 或inhibitor 后HAECs miR-18a 的表达水平
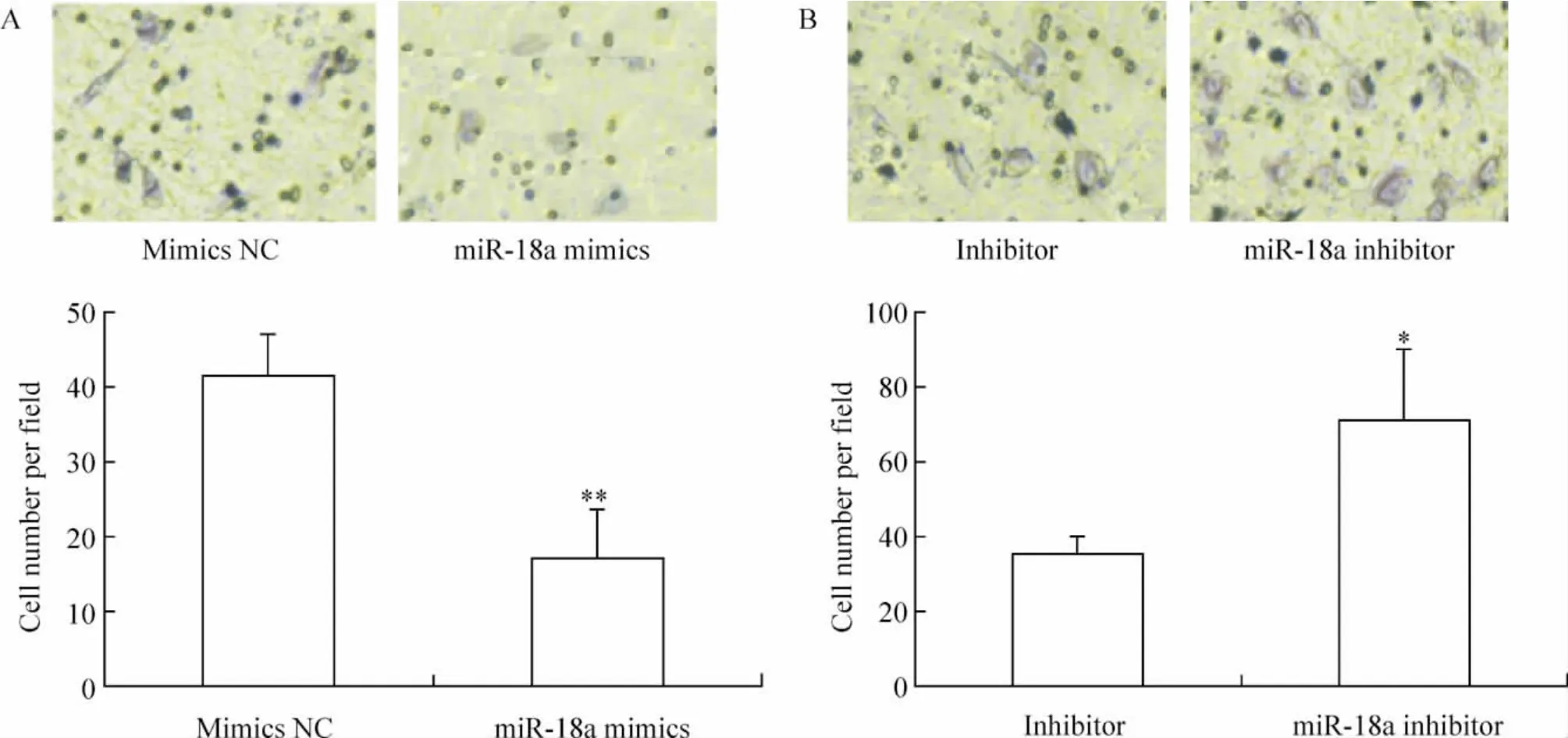
Figure 2. The migration capacity of human aortic endothelial cells after transfected with miR-18a mimics (A)or inhibitor (B)(hematoxylin staining,×200). ±s.n=5. * P <0.05,**P <0.01 vs negative control (mimics NC or inhibitor NC).图2 转染miR-18a mimics 或inhibitor 后HAECs 的迁移能力
2.2 体外黏附力实验 与对照组相比,miR-18a mimics 转染组黏附能力无明显变化,见图3A;miR-18a inhibitor 转染组黏附能力增加43%,见图3B,差异有统计学意义(P <0.05)。
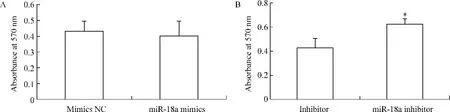
Figure 3. The adhesion capacity of human aortic endothelial cells after transfected with miR-18a mimics (A)or inhibitor (B). ±s.n=5. * P <0.05 vs inhibitor NC.图3 转染miR-18a mimics 或inhibitor 后HAECs 的黏附能力
2.3 体外毛细血管管腔样结构形成实验 转染miR-18a mimics 组管腔样结构数量比对照组减少52%,见图4A、C;miR-18a inhibitor 转染组管腔数量与对照组相比增加84%,见图4B、D,差异显著(P<0.01)。
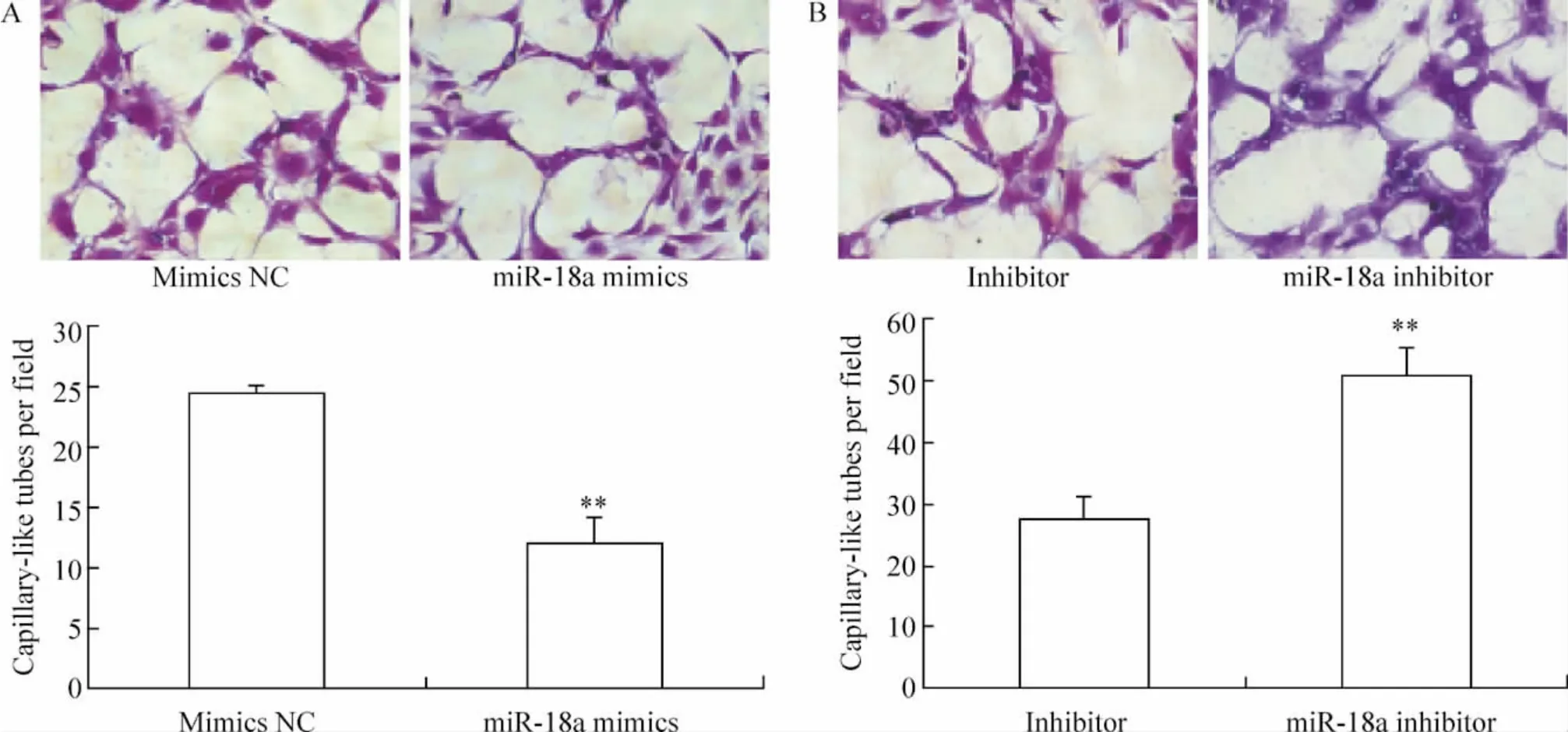
Figure 4. The capillary-like tube formation ability of human aortic endothelial cells after transfected with miR-18a mimics (A)or inhibitor (B)(crystal violet staining,×100). ±s.n=5. **P <0.01 vs negative control (mimics NC or inhibitor NC).图4 转染miR-18a mimics 或inhibitor 后HAECs 的毛细血管样结构形成能力
讨 论
本研究通过转染miR-17 ~92 家族中miR-18a 的mimics 和inhibitor 至人主动脉内皮细胞,观察miR-18a 对内皮细胞血管生成的影响。结果显示,miR-18a mimics 转染后可抑制内皮细胞迁移和管腔形成能力;而miR-18a inhibitor 则对内皮细胞血管形成有促进作用,尤其是对管腔形成能力作用明显。以上研究结果表明,对于主动脉内皮细胞而言,miR-18a过表达具有抑制血管生成的作用。目前关于miR-18a 对血管生成功能的研究报道较少,但Bonauer 等[4]关于miR-18a 同家族成员miR-92a 的研究结果支持我们的研究,他们在体内、体外实验中证实人内皮细胞中miR-92a 过表达可抑制血管生成,而在鼠肢端缺血模型和心梗模型中采用antagomir 抑制miR-92a 表达则可增加血管生成,促进受损组织的功能恢复。此外,Doebele 等[5]最新发表的数据亦显示,miR-17、-18a 及-20a 显著抑制体外三维细胞球状体萌芽模型的血管生成。
miR-18a 对动脉内皮细胞血管生成的作用机制目前尚不清楚,通过microRNA 靶基因预测软件筛选及相关文献的检索,我们认为在血管生成过称中参与细胞基质降解、内皮细胞增殖、迁移、管腔形成的多个细胞因子或者酶类都可能是包括miR-18a 在内的miR-17 ~92 家族潜在的直接分子靶或者靶信号通路下游的效应分子。如TGF-β/Smad 信号通路的上游受体及下游转录因子已被证实为miR-18a等miR-17 ~92 家族成员的分子靶[6-7]。此外,VEGF[8]、HIF-1A[9]、JAK1[5]、integrins[4]等这些促血管生成的关键分子也被证实是miR-18a 等miR-17 ~92 家族成员的直接靶分子。并且,miR-18a等miR-17 ~92 家族成员还广泛参与细胞周期、增殖和凋亡的调控[3]。究竟miR-18a 调控血管生成过程中哪些分子或者信号通路起关键性介导作用?尚有待进一步研究证实。
关于miR-17 ~92 家族对血管生成及对肿瘤发生和进展的影响,一直存在较大争议。miR-17 ~92家族曾一度被认为是促癌的microRNA,即oncomiR[3],因为最初的很多研究发现其在肿瘤中高表达并可促进肿瘤的增殖和血管生成,比如可通过下调抗血管生成因子TSP-1 及结缔组织生长因子的表达而促进肿瘤组织的血管生成[10]。最新几项研究证实,miR-17 ~92 家族成员对体外正常内皮细胞血管生成模型以及缺血或梗死整体的动物模型具有抑制血管生成作用[4-5]。我们推测这种完全相反的研究结果可能与所用研究模型即所采用的细胞或者血管生成所处的大环境密切相关。不同的病理、生理状况下miR-17 ~92 家族成员的活性及调控机制可能并不完全相同。有研究发现miR-17 ~92 家族中的miR-17 和miR-20a,对于生理性血管再生模型和病理性的肿瘤血管生成模型表现出不同的效应[5,11]。对于肿瘤细胞,miR-17 ~92 家族成员增加了其旁分泌的促血管生成物质的活性,这可能削弱了其对于正常内皮细胞的抗血管生成作用[5]。
血管生成过程是由促血管生成和抗血管生成信号平衡严格调控。而miR-18a 对血管生成的调控作用及其机制还并不十分清楚。现有的肿瘤血管生成模型与生理状况下的血管生成模型中miR-17 ~92 家族相反的调控效应需进一步深入研究。因为不同的背景下通过miR-18a 等miR-17 ~92 家族的靶向作用调节血管生成可能具有不同的意义,一方面诱导血管生成可改善血管闭塞性疾病引起的缺血性损伤;而另一方面,抑制血管生成被证明是抑制肿瘤生长的可行策略。
[1] Carmeliet P. Mechanisms of angiogenesis and arteriogenesis[J]. Nat Med,2000,6(4):389-395.
[2] Caporali A,Emanueli C. MicroRNA regulation in angiogenesis[J]. Vascul Pharmacol,2011,55(4):79-86.
[3] Mendell JT. MiRiad roles for the miR-17-92 cluster in development and disease[J]. Cell,2008,133(2):217-222.
[4] Bonauer A,Carmona G,Iwasaki M,et al. MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice[J]. Science,2009,324(5935):1710-1713.
[5] Doebele C,Bonauer A,Fischer A,et al. Members of the microRNA-17-92 cluster exhibit a cell-intrinsic antiangiogenic function in endothelial cells[J]. Blood,2010,115(23):4944-4950.
[6] Petrocca F,Vecchione A,Croce CM. Emerging role of miR-106b-25/miR-17-92 clusters in the control of transforming growth factor beta signaling[J]. Cancer Res,2008,68(20):8191-8194.
[7] Mestdagh P,Bostrom AK,Impens F,et al. The miR-17-92 microRNA cluster regulates multiple components of the TGF-beta pathway in neuroblastoma[J]. Mol Cell,2010,40(5):762-773.
[8] Shao ES,Lin L,Yao Y,et al. Expression of vascular endothelial growth factor is coordinately regulated by the activin- like kinase receptors 1 and 5 in endothelial cells[J]. Blood,2009,114(10):2197-2206.
[9] Taguchi A,Yanagisawa K,Tanaka M,et al. Identification of hypoxia-inducible factor-1 alpha as a novel target for miR-17-92 microRNA cluster[J]. Cancer Res,2008,68(14):5540-5545.
[10] Dews M,Homayouni A,Yu D,et al. Augmentation of tumor angiogenesis by a Myc-activated microRNA cluster[J]. Nat Genet,2006,38(9):1060-1065.
[11] Kuhnert F,Kuo CJ. miR-17-92 angiogenesis micromanagement[J]. Blood,2010,115(23):4631-4633.
