大孔吸附树脂纯化海红果黄酮工艺的研究
2012-12-22徐玉霞王华斌
徐玉霞,王华斌
宝鸡文理学院灾害监测与机理模拟陕西省重点实验室,宝鸡721013
海红果学名西府海棠(Malus micromalus Makino),属于蔷薇科(Rosaceae)梨亚科(Pomoideae)苹果属[1]。海红果又名海红子、子母海棠、小果海棠,在我国主要分布于晋、陕、蒙交界的三角地区,是一种稀有的地方果树资源[2]。赵亮[3]、梁泰刚[4]等人研究发现海红果富含黄酮类化合物。目前对海红果的研究只停留在成分分析上[3-5],而对海红果中黄酮的提取、纯化一直没有相关文献报道。
大孔吸附树脂具有选择性强、吸附容量大、吸附速度快、解吸容易、成本低等优点[6]。何琦[7]、王婷婷[8]、李超[9]等人分别用大孔吸附树脂纯化植物黄酮,均取得较好的效果。本研究在进行了提取海红果总黄酮的研究基础上,从10种大孔树脂中筛选出对海红果黄酮具有良好吸附和解吸性能的树脂,考察了该树脂对海红果黄酮的静态、动态吸附与解吸性能及主要影响因素,以期建立适宜的海红果黄酮纯化条件,为海红果黄酮的提取、开发利用和提高附加值提供参考。
1 材料与方法
1.1 材料与试剂
海红果(洗净,自然阴干,50℃恒温烘干,粉碎后过60目筛)产自陕西省府谷县哈镇。
芦丁对照品中国药品及生物制品检定所;无水乙醇、正丁醇分析纯,天津致远化学试剂有限公司;丙酮分析纯,天津永晟精细化工有限公司;氢氧化钠分析纯,天津市北辰方正试剂厂;甲醇、盐酸 分析纯,西安化学试剂厂;硝酸铝分析纯,天津化学试剂三厂;亚硝酸钠 分析纯,国药集团化学试剂有限公司;大孔吸附树脂LSA-10、LSA-800、XDA-1、XDA-5,西安蓝深公司;SP-207、SP-825,日本三菱化工; AB-8、D3520、NKA-9,南开大学化工厂;D-101,上海兰季科技发展有限公司。
1.2 仪器与设备
紫外可见分光光度计TU-1810,北京普析通用仪器有限责任公司;电子天平AL-104,梅特勒-托利多上海仪器有限公司;超声波药品处理机 JBT/CYCL400T/3P(D),济宁金百特工程机械有限公司;旋转蒸发器RE-85C,上海青浦沪西仪器厂;循环水式多用真空泵SHB-Ⅲ,郑州长城科工贸有限公司;高速台式离心机TGL-10C,上海安亭科学仪器厂;恒温振荡培养摇床BS-1E,常州菲普实验仪器厂;精密酸度计PHS-3C,上海虹益仪器仪表有限公司;电热恒温水浴锅HWS26,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 总黄酮浓度的测定方法
采用NaNO2-Al(NO3)3-NaOH体系络合化学吸光法[10],以芦丁为标准品。
1.3.1.1 标准曲线的绘制
绘制方法参考文献[11]和[12]。以吸光度(X)为横坐标,浓度(Y)为纵坐标,绘制标准曲线。其回归方程为:Y=13.571X-0.009,R2=0.9992表明在该浓度范围内线性良好。
1.3.1.2 海红果黄酮浓度的计算
将海红果提取液定容至100 mL后,取1 mL置于10 mL的具塞试管中,按标准曲线制作方法测定样品反应液在508 nm波长下测其吸光值,用回归方程计算黄酮浓度ρA。海红果黄酮浓度按(1)式计算:
黄酮浓度ρ(mg/mL)=ρA×n(1)
其中:ρA(mg/mL)—与提取液吸光度值对应的海红果黄酮浓度(mg/mL),n—稀释倍数。
1.3.2 海红果黄酮粗提液的制备
将新鲜海红果经过干燥、粉碎、过60目筛后称取20 g,加入60%的乙醇溶液500 mL,在40℃,功率为360 W,频率为42 kHz的超声波药品处理机中提取30 min,2500 rpm离心10 min,过滤后取上清液,旋转蒸发回收溶剂,即为海红果黄酮粗提液。
1.3.3 大孔吸附树脂的预处理
将1.1中10种大孔吸附树脂用无水乙醇室温下密封浸泡24 h,用蒸馏水洗至洗出液加蒸馏水不显浑浊为止。然后用l mol/L NaOH溶液浸泡8 h,蒸馏水洗至中性,再用l mol/L盐酸浸泡8 h,用蒸馏水洗至中性。
1.3.4 树脂的筛选
预处理好的10种大孔吸附树脂用滤纸吸干表面的水分,分别称取5.000 g置于250 mL三角瓶中,分别加入浓度为5.15 mg/mL的海红果黄酮粗提液100 mL,并调整溶液的pH值为5.0。将三角瓶用保鲜膜封口,放入30℃,150 rpm的摇床中振荡,每隔l h测一次三角瓶内上清液中黄酮浓度,持续测24 h。再将经静态饱和吸附后的树脂抽滤出,用滤纸吸干表面水分,加入80%乙醇100 mL,并放入相同环境下的摇床中振荡,同样每隔l h测一次三角瓶内洗脱液中黄酮浓度,持续测24 h。依下式分别计算吸附量、吸附率、解吸量、解吸率、黄酮收率和纯度。从中筛选出性能最优的大孔吸附树脂。

其中:ρ0—海红果黄酮粗提液中黄酮质量浓度(mg/mL),ρs—吸附后上清液的黄酮质量浓度(mg/ mL),V0—海红果黄酮粗提液的体积(mL),ρd—洗脱液的黄酮质量浓度(mg/mL),Vd—洗脱液的体积(mL),W—树脂质量(g),Wd—洗脱液液浓缩烘干后固形物的质量(mg)。
1.3.5 大孔树脂动态吸附条件的优化
将最优树脂按1.2.3方法先进行预处理,湿法装入Ф2.0 cm×30.0 cm的层析柱中,装柱高度约为20 cm。再分别考察上柱液pH值、上柱液浓度、上柱液流速和上样量对吸附效果的影响。
1.3.6 大孔吸附树脂洗脱条件的优化
分别考察不同种类和浓度的洗脱剂,洗脱液用量和洗脱流速对洗脱效果的影响。
1.3.7 树脂重复使用周期的考察
为了考察树脂的稳定性及抗污染性,按照最优的吸附和洗脱条件,取海红果黄酮粗提液反复进行上柱、吸附、洗脱,在同一根树脂柱上重复操作10次,分别测定吸附液和解吸液黄酮浓度,并计算吸附率、解吸率和黄酮收率。
1.3.8 验证试验
按照最优的吸附和洗脱条件,取海红果黄酮粗提液反复进行上柱、吸附、洗脱,分别测定吸附液和解吸液黄酮浓度,做五组平行试验,计算吸附量、吸附率、解吸量、解吸率、黄酮收率和纯度。
2 结果与分析
2.1 树脂的筛选
10种大孔吸附树脂的静态吸附和解吸试验各24 h后结果如表1所示。10种大孔吸附树脂对海红果黄酮的吸附量和解吸量均有不同。其中NKA-9、SP-825和SP-207的吸附量较大,分别为165.41、151.90和143.77 mg/g。这三种树脂的黄酮收率和纯度也较高,黄酮收率分别为68.31%、59.87%和61.73%。纯度分别为28.50%、25.65%和25.04%。这可能是因为海红果黄酮类化合物分子较大,NKA-9、SP-825和SP-207均具有较大的孔径。同时,由于大孔树脂的吸附原理主要为物理吸附,比表面积越大,表面张力随之增大,吸附量就会提高。

表1 10种大孔吸附树脂的静态吸附与解吸数据Table 1 Static adsorption-desorption properties of 10 resins
由表1可知,NKA-9大孔吸附树脂无论从吸附能力还是解吸能力都优于其他树脂,因此选择NKA-9大孔吸附树脂做为最优的海红果黄酮纯化树脂。
2.2 大孔树脂动态吸附条件的优化
2.2.1 上样液pH值的选择
将体积为4 BV,质量浓度为5.15 mg/mL的海红果黄酮粗提液的pH值分别调节为2.0、3.0、4.0、5.0、6.0、7.0,以约2.0BV/h的流速过柱。试验结果如图1所示,偏酸性环境有利于海红果黄酮的吸附。上样液pH值为4.0时NKA-9树脂的吸附率最大,达到了79.78%,这是由于在弱酸性条件下,具有酚羟基结构的黄酮均以分子状态存在,可以凭借范德华力与树脂发生物理吸附作用[13]。因此最优的上样液pH值为4.0。
2.2.2 上样液浓度的选择
将海红果黄酮粗提液初始浓度分别控制在2.85、4.00、5.15、6.30、7.45 mg/mL,其余条件按照2.2.1 进行动态吸附。结果如图2所示,浓度在低于5.15 mg/mL的区间内,海红果黄酮吸附率都随着上样液浓度增大而增大,但高于5.15 mg/mL后黄酮吸附率又有所降低。这是因为浓度过低,上柱液通过柱床速度大于传质速度。但上样液浓度过大时,海红果黄酮向树脂内部扩散速度减慢,而且容易使过饱和而成为糊状,堵塞树脂孔隙而影响吸附和解吸[14]。因此,上样液粗提液浓度为5.15 mg/mL是较适宜的浓度,吸附率可达79.48%。

图1 上样液pH值对吸附效果的影响Fig.1 Effects of sample pH value on adsorption

图2 样液浓度对吸附效果的影响Fig.2 Effects of sample concentration on adsorption
2.2.3 上样液流速的选择
设定上柱液流速分别为1、2、3、4、5 BV/h,其余条件按照2.2.1进行动态吸附。结果由图3可知,当上样液流速为1 BV/h时,NKA-9树脂的吸附率最高,为81.71%。随着流速的增加,吸附率逐渐降低。这主要是因为上样液流速越慢,海红果黄酮物质能充分扩散到树脂的内表面,从而吸附的越完全。而上样液流速过大时,海红果黄酮还未能扩散到树脂的内表面,就会冲出柱子,从而造成吸附量下降。在实际操作中,流速过低又会影响到生产效率,会使生产周期延长,提高生产的成本。综合考虑,上样液流速以2 BV/h较为适宜,吸附率为79.92%。

图3 流速对吸附率的影响Fig.3 Effect of flow rate on adsorption capacity
2.2.4 上样量的选择
加入大于30倍床体积的海红果黄酮粗提液上柱,其他条件同2.2.1,分步收集漏出液(每管收集1 BV),检测漏出液黄酮含量,以上样液的体积为横坐标,漏出液黄酮浓度为纵坐标,绘制动NKA-9树脂态穿透吸附曲线如图4所示。当流出液的黄酮质量浓度达到其上样液的10%时即认为黄酮已穿透。上样液浓度为5.15 mg/mL时的黄酮穿透点为3 BV,而漏出液体积为10 BV后NKA-9树脂达到了饱和吸附状态。从图4也可以看出,上样量越少,漏出液体积也会越小,漏出液黄酮浓度越低,吸附率越高。但上样量过多,不仅会使纯化周期将延长,工作效率降低,而且会影响黄酮总收率。综合考虑,选择上样量为4BV为宜。

图4 NKA-9树脂动态穿透吸附曲线Fig.4 Curve of dynamic breakthrough adsorption of NKA-9 resin
2.3 大孔吸附树脂洗脱条件的优化
2.3.1 洗脱剂的选择
分别将100 mL甲醇、无水乙醇、丙酮、正丁醇及体积分数为20%、40%、60%、80%的乙醇水溶液加入到含5.000 g饱和吸附树脂的三角瓶中,其他条件同1.2.4。24 h后测得不同的洗脱剂对海红果黄酮的洗脱效果如表2所示。其中丙酮的解吸率和黄酮收率最高为84.90%和70.38%,其次是体积分数为80%的乙醇水溶液,解析率和黄酮收率分别为82.74%和68.59%。考虑安全性和成本因素,选择80%乙醇溶液做洗脱剂。

表2 不同洗脱剂对海红果黄酮的洗脱效果Table 2 Desorption efficiency of different solvent on M.micromalus flavonoids
2.3.2 洗脱液用量的选择
按1.2.5中确定的最优吸附条件进行上柱,吸附之后,用1 BV蒸馏水快速淋洗树脂柱以除去蛋白质、多糖等水溶性杂质。用80%乙醇溶液,流速为1 BV/h进行洗脱。分部收集洗脱液(每管收集 1 BV),检测黄酮含量,以洗脱液体积为横坐标,解吸液黄酮浓度为纵坐标,绘制动态解吸曲线如图5所示。洗脱液用量在2 BV以内时,洗脱液中黄酮浓度随洗脱液用量增大而升高,用量大于2 BV后又随之降低,洗脱峰相对集中且无拖尾。考虑到生产成本,因此选择洗脱液的用量为3 BV,解析率达84.66%。

图5 NKA-9树脂动态解吸曲线Fig.5 Dynamic elution curve of NKA-9 resin
2.3.3 洗脱液流速的选择
洗脱液用量为3 BV,洗脱流速分别控制在0.5、1、1.5、2、2.5 BV/h,其他操作方法与条件同2.3.2。试验结果如图6所示,洗脱液流速越快,洗脱率越低。其中流速为0.5 BV时,解吸率达到86.95%,而流速为2.5 BV时,解吸仅有44.75%。但流速太慢会使操作时间延长,工作效率降低。因此本试验将洗脱液流速控制在1 BV/h为宜,解析率为84.36%。

图6 洗脱液流速对洗脱效果的影响Fig.6 Effect of elution rate on elution efficiency
2.4 树脂重复使用周期的考察
NKA-9树脂重复使用周期结果如表3所示。经过10个周期的反复吸附与洗脱,吸附率和黄酮收率逐渐降低,而解析率变化不大。其中第8次使用海红果黄酮的吸附率明显下降,从69.96%下降到62.87%。说明NKA-9树脂重复使用7次后,需要进行再生。再生时只需用丙酮和水交替洗涤多次即可[15]。
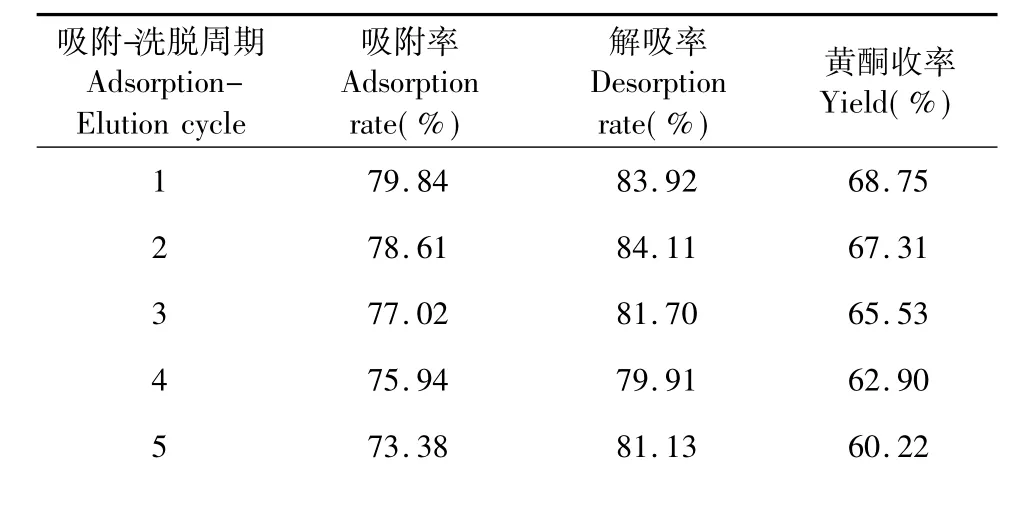
表3 NKA-9树脂重复使用9个周期的性能变化Table 3 Adsorption properties change of NKA-9 resin on repeat use 9 cycles
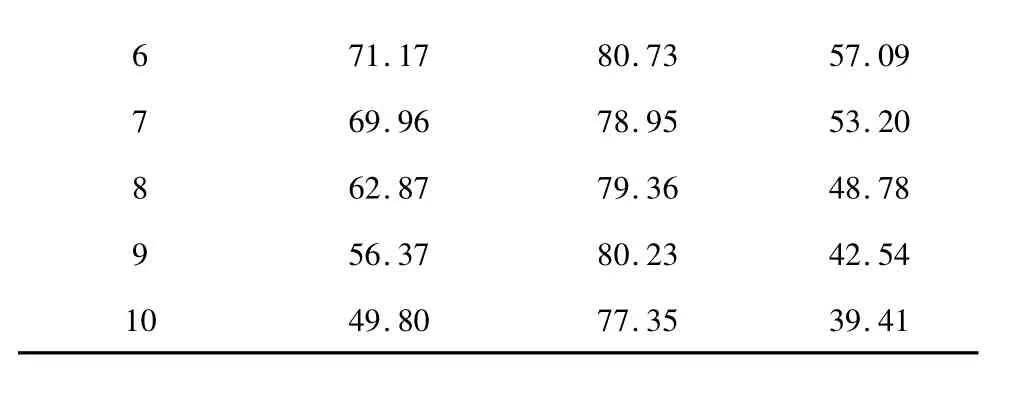
6 71.17 80.73 57.09 7 69.96 78.95 53.20 8 62.87 79.36 48.78 9 56.37 80.23 42.54 10 49.80 77.35 39.41
2.5 验证试验
按照上述所确定的最优的纯化海红果黄酮的吸附和洗脱条件,重复试验五次,测得海红果黄酮的吸附率、解析率、收率、纯度的平均值分别为(79.39± 0.13)%,(84.14±0.11)%,(68.20±0.15)%和(28.81±0.06)%。
3 结论
NKA-9树脂对海红果黄酮有很好的吸附和解吸性能,为海红果黄酮纯化的最优树脂,其最优的动态吸附工艺条件为:上样液pH值为4.0,浓度5.15 mg/mL,上样量为4 BV,流速为2 BV/h。最优的洗脱工艺条件为:洗脱剂为80%乙醇溶液,洗脱液用量为3 BV,洗脱流速为1 BV/h。在此优化条件下,海红果黄酮的吸附率、解析率、收率、纯度的平均值分别达到为(79.39±0.13)%,(84.14±0.11)%,(68.20±0.15)%和(28.81±0.06)%(n=5)。NKA-9树脂可重复使用7次。
1 Bao ZH(鲍智鸿),Hu XS(胡小松).Study on process and formula of Malus micromalus Makino tea(dried).Chin Agric Sci Bull(中国农学通报),1999,(4):34-36.
2 He XL(贺学林).The development and utilization of Malus micromalus Makino trees resources.Northern Horticulture(北方园艺),2003,1(4):32.
3 Zhao L(赵亮),Liu EL(刘恩荔),Li QS(李青山),et al.Content determination of total flavonoids in fruit of Malusmicromalus by ultraviolet spectrophotometry.J Shanxi Med Univ (山西医科大学学报),2006,37:169-171.
4 Liang TG(梁泰刚),Liu EL(刘恩荔),Zhao CX(赵承孝),et al.Simultaneous determ ination of four flavonoids in Malus prunifolia from Shanxi province by RP-HPLC.Chin J Chin Mater Med(中国中药杂志),2009,34:2217-2219.
5 Zhao L(赵亮).Preliminary study on pharmaceutical value of Malus micromalus Makino.Taiyuan:Shanxi Medical University(山西医科大学),PhD.2006.
6 He W,Li W.Application of macroporous absorbed resin in separation and purification of traditional Chinese medicine.J Nanjing Univ Trad Chin Med(南京中医药大学学报),2005,21:134-136.
7 He Q(何琦),Ji YQ(及元乔),Ding LS(丁立生),et al.Study on D140 macroreticular adsorbent adsorption properties for flavonoid glycosides from Ginkgo biloba L..Nat Prod Res Dev(天然产物研究与开发),2001,13:56-59.
8 Wang TT(王婷婷),Cao SW(曹树稳),Yu HY(余燕影),et al.Adsorption and Separation of Total Flavones from Millettla nitida var.hirsutissima by Macroporous Adsorption Resin.Nat Prod Res Dev(天然产物研究与开发),2008,20: 477-481.
9 Li C(李超),Wang NX(王乃馨),Zheng Y(郑义),et al.Using AB-8 macroporous adsorption resin for separation and purification of total flavonoids from Stenoloma chusana(L.) Ching.Food Sci(食品科学),2011,32(16):31-35.
10 Song LH(宋立华),Zheng YR(郑远荣),Sun XJ(孙向军),et al.Research on the extraction of flavone from cactus by ultrasonic.J Shanghai Jiao Tong Univ,Agric Sci(上海交通大学学报,农科版),2008,26(1):70-73.
11 Zhang B(张斌),Jiang LK(蒋立科),Wang HM(王红梅).Study on extraction technology of total flavonoids from Leaves of Magnclia Grandiflora.Chemistry&Bioengineering(化学与生物工程),2009,(5):32-34.
12 Zhang YJ(张意静).Food Analysis Technology.Beijing:China Light Industry Press,2001.
13 Li BT(李伯廷),Wang X(王湘),Li XJ(李小进).Application of macroporous absorbed resin in separation and purification of natural product.Chin Tradit Herb Drugs(中草药),1990,21(8):42-44.
14 Jing Y(景怡),Jing RQ(景荣琴),Ren Y(任远),et al.Study on the separation and purification the total flavonoids in the stigma maydis by AB-8 macroporous absorption resins.Acta Chin Med Pharm(中医药学报),2010,38:75-78.
15 Liang SL(梁少玲),Cai Y(蔡宇),Yang YX(杨燕霞).Application of macroporous absorbed resin in separation and purification of flavonoids and saponin.LiShiZhen Med Mate Med Res(时珍国医国药),2006,17:277-278.
