丹参酮ⅡA对正常和氧化损伤内皮细胞的保护作用研究
2012-12-22钟先锋刘小如邓泽元
罗 婷,钟先锋,李 静,刘小如,邓泽元
南昌大学食品科学与技术国家重点实验室,南昌330047
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的前期阶段,血管内膜附有一层内皮细胞,是非常光滑的,动脉粥样硬化发生常伴有内皮细胞损伤或脱落[1],血管内皮细胞的功能障碍是AS发生的始动因素[2]。故进行早期预防内皮细胞功能障碍对AS的发病具有积极的作用[3]。
丹参酮ⅡA(Tanshinone IIA,TIIA)具有明显的抗氧化应激作用[4],氧化应激通过产生氧自由基介导血管内皮细胞的损伤,与血管内皮功能障碍有着密切的关系。已有实验证实丹参酮ⅡA具有抗氧化的作用,并且能够抑制羟自由基引起的脂质过氧化[5]。本研究以培养的人脐静脉内皮细胞为材料,观察丹参酮ⅡA对内皮细胞增殖的影响,探讨丹参酮ⅡA保护损伤后的血管内皮细胞和抗动脉粥样硬化的作用。
1 材料与方法
1.1 材料与试剂
人脐静脉内皮细胞株(Human vascular endothelial cells,HUVECs)由南昌大学医学院提供;DMEM (Invitrogen corporation);胰蛋白酶(Sigma公司); MTT(Sigma公司);胎牛血清(Gibco公司);丹参酮ⅡA(中国生物制品检定所;批号:110766-200518;纯度:98%以上);DMSO(天津大茂公司);乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮合酶(nitrogen oxide synthase,NOS)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px),丙二醛(malondialdehyd,MDA)、一氧化氮(nitric oxide,NO)试剂盒(南京建成生物工程研究所)。
1.2 仪器与设备
CO2恒温恒湿培养箱(SanYo);生物安全柜(苏净集团安泰公司);倒置显微镜(上海光学仪器进出口有限公司);MK3型酶标仪(赛默飞世尔上海仪器有限公司);台式冷冻高速离心机(Heal Force)等。
1.3 方法
1.3.1 内皮细胞培养
人脐静脉内皮细胞的培养:取人脐静脉血管内皮细胞接种于50 mL培养瓶内,待细胞铺满80%~90%的瓶底表面积后,用0.25%的胰蛋白酶消化1 min,离心,分装于新的培养瓶中,置37℃、5%的CO2培养箱内培养。第二天换培养液,培养至第3天进行传代。如上述方法正常培养3代以上后,将内皮细胞分组进行实验。
1.3.2 MTT法测定丹参酮ⅡA对人脐静脉内皮细胞增殖的影响
离心收集对数期细胞,以2×104~5×104个/ mL的密度接种于96孔板中,5%CO2,37℃培养箱中培养24 h后,弃去培养液,用PBS洗去未贴壁细胞。换用无血清的培养基继续培养8 h,使细胞同步化。然后换用含5%胎牛血清和不同浓度丹参酮ⅡA的DMEM培养液培养,其中丹参酮ⅡA分6个浓度,分别是400、200、100、40、20、10 μmol/L,每组设6个复孔,同时设置调零孔和对照孔。24 h后终止培养,每孔加入MTT(5 mg/mL)20 μL,在37℃体积分数5%CO2孵育4 h。弃去上清液,每孔加入150 μL二甲基亚砜(DMSO),置摇床上低速振荡10 min,使结晶物充分溶解,并用酶标仪OD490nm处测定各孔的吸光值。
1.3.3 MTT法测定丹参酮ⅡA对人脐静脉内皮细胞损伤的保护作用
将细胞分为对照组(在细胞培养体系中不施加任何干预因素)、H2O2组(在细胞培养体系中加入100 μmol/L的 H2O2)和药物干预组(10~100 μmol/L丹参酮ⅡA+100 μmol/L H2O2)[7]。前期实验操作同1.3.2,加入丹参酮ⅡA后,培养24 h,加入100 μmol/L H2O2作用内皮细胞6 h,换入无血清DMEM培养液100 μL/孔,并于每孔加入MTT(5 mg/mL)10 μL。继续培养4 h后,加入DMSO使结晶物溶解,并用酶标仪OD490nm处测定各孔的吸光值。
1.3.4 测定丹参酮ⅡA对内皮细胞LDH、SOD、MDA、NOS、NO和GSH的影响
使用试剂盒,按照试剂盒说明书测定每组内皮细胞中LDH释放率,MDA、NOS、NO、SOD和GSHPx的变化。
1.3.5 流式细胞术检测内皮细胞凋亡
实验分组同1.3.2,内皮细胞用胰酶消化后,PBS洗涤2遍,离心(1000 rpm,5 min)获取细胞,加入100 μL的Binding Buffer悬浮细胞,使用5 μL FITC和5 μL PI在室温避光反应10~15 min,离心加入500 μL的Binding Buffer悬浮细胞,在1 h内进行流式细胞仪的检测。
1.3.6 统计学处理
采用SPSS 17.0统计软件处理实验数据,单因素方差分析进行显著性检验,并用LSD-t进行了组间差异性比较;所得数据用±s表示,P<0.05表示差异显著,具有统计学意义。
2 结果
2.1 丹参酮ⅡA对正常内皮细胞生长的影响
如图1所示,低剂量添加丹参酮ⅡA对正常内皮细胞的生长没有影响,但在浓度达到200 μmol/L时,对内皮细胞生长产生抑制作用,可能过量的丹参酮ⅡA会对内皮产生细胞毒性。图1显示,丹参酮ⅡA添加浓度于10~100 μmol/L之间时,内皮细胞的存活率没有明显影响,但当上升到400 μmol/L,内皮细胞的存活率也于100%下降到57.4%,随着丹参酮ⅡA添加浓度的升高,丹参酮ⅡA对血管内皮细胞生长抑制作用越来越明显,呈现浓度依赖关系。
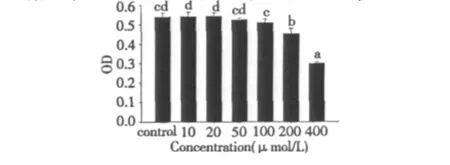
图1 丹参酮ⅡA对内皮细胞增殖的影响Fig.1 The effect of Tanshinone IIA on the proliferation of HUVECs
2.2 丹参酮ⅡA对内皮细胞损伤的保护作用
根据2.1的实验结果,本实验选择了较低浓度(5~100 μmol/L)的丹参酮ⅡA来保护内皮细胞,以排除细胞毒性的影响。从图2可以看到,丹参酮ⅡA对内皮细胞的保护作用显浓度依赖关系。比较药物添加各组和H2O2组,添加5、10 μmol/L的丹参酮ⅡA对内皮细胞的保护作用不明显(P<0.05),而添加量上升到20 μmol/L,则有显著的保护作用。

图2 丹参酮ⅡA对内皮细胞损伤的保护作用Fig.2 Protective effects of Tanshinone IIA on HUVECs from oxidative injury
2.3 丹参酮ⅡA对内皮细胞 LDH、SOD、MDA、NOS、NO和GSH的影响
从表1可以看到,H2O2组的LDH释放率和MDA与对照组相比显著上升,LDH释放率从36.28%上升到54.89%,MDA从23.78 nmol/mg prot上升到45.70 nmol/mg prot。加入丹参酮ⅡA处理后,LDH释放率和MDA有不同程度下降,如100 μmol/L丹参酮ⅡA预处理组与H2O2组比较,LDH释放率下降为44.75%,MDA下降为33.57 nmol/mg prot,说明内皮细胞经丹参酮ⅡA预处理,可以抵御氧自由基损伤,降低细胞脂质过氧化物,维护生物膜的完整性。
NOS是维持内皮细胞生理功能的重要活性物质,能清除体内自由基。NO可促进血管舒张,并抑制增生作用[6]。H2O2组与对照组相比,内皮细胞NOS表达减少,其产物NO水平也随之降低,随着丹参酮ⅡA加入,NO水平回升。
细胞内同时存在清除过量氧自由基的系统,如SOD和GSH-Px,这些抗氧化酶可以保护内皮细胞,维持细胞膜结构和正常生理功能的作用。本研究表明:与对照组相比,H2O2组SOD和GSH-Px活性显著降低。与H2O2组相比,50和100μmol/L丹参酮ⅡA均可增强内皮细胞的SOD、GSH-Px活性,SOD活力分别为112.51 U/mgprot和131.37 U/mgprot (P<0.05);GSH-Px活力分别为176.52 U/mgprot和212.96 U/mgprot(P<0.05)。且随浓度的增加,细胞的SOD和GSH-Px活性也逐渐提高,表明丹参酮ⅡA可增强内皮细胞的抗氧自由作用,具一定的量效关系。

表1 丹参酮ⅡA对人脐静脉内皮细胞LDH、MDA、NOS、NO、SOD和GSH-PX的影响Table 1 Effects of Tanshinone IIA on LDH,MDA,NOS,NO,SOD,GSH-PX in HUVECs
2.4 丹参酮ⅡA对内皮细胞凋亡的影响
从图3可以看到,人脐静脉内皮细胞经H2O2氧化损伤后,41.7%的细胞进入早期凋亡,2.1%的细胞进入晚期凋亡或者坏死,而丹参酮ⅡA预处理组(50 μmol/L),有23.2%的细胞进入早期凋亡,0.6%的细胞进入晚期凋亡或者坏死,提示丹参酮ⅡA可以保护内皮细胞免受氧化损伤,降低细胞凋亡率,维持正常生理功能防止AS的形成。
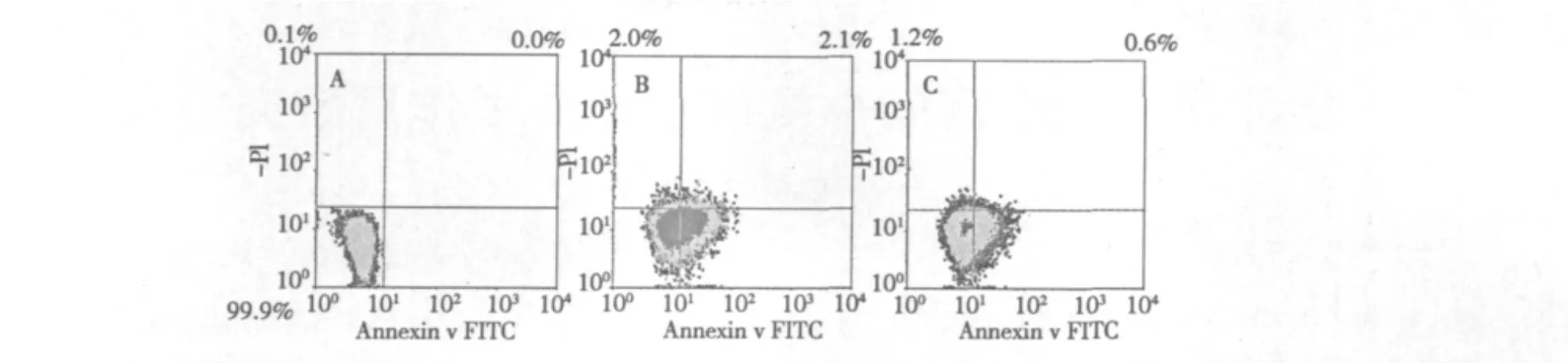
图3 FITC-PI通道的二维散点图Fig.3 Bivariate graphs illustrate the FITC-PI fluorescent resolution of HUVECs
3 讨论
人体内多种因素导致血管内皮细胞损伤,如炎症因子、失去平衡的调节因子、活性氧、脂肪氧化酶等,其中活性氧产生的氧化损伤是其中重要的因素之一[7]。人体正常生理活动过程伴有氧化性物质参与,主要为氧自由基。氧自由基可以参与人体的物质代谢和信号传导,对细胞发挥正常生理功能起着重要作用。但是人体产生过量氧自由基或者清除能力下降时,则对人体内各种细胞产生不可逆的氧化损伤。
实验室为了建立氧化损伤模型,多采用H2O2、乙醇和ox-LDL等试剂,本研究利用H2O2产生O来建立HUVECs损伤模型,因为该系统经济科学,方便易行,适于快速诱导损伤建立模型,进而大量筛选药物。综合文献和预实验数据分析,本文采用200 μmol/L的H2O2诱导内皮细胞损伤。
从自然界中提取的部分植物化合物对细胞有细胞毒性,在研究各种化合物对细胞的保护作用时,实验设计的药物浓度应在不产生细胞毒性的范围内。在本研究中,当丹参酮ⅡA添加浓度上升到200μmol/L,对HUVECs的增殖产生抑制作用,有显著性差异(图1)。所以本研究的实验方案设计的药物浓度为5~100 μmol/L。
氧自由基损伤细胞膜上的脂质,使其过氧化分解生成脂质过氧化物,如MDA。MDA能与蛋白质、氨基酸及其它细胞成分作用,最终使磷脂结构发生变化,生物膜受到严重的损害,致使细胞活力下降,同时细胞内的LDH外漏[8]。丹参酮ⅡA也促进了NOS和NO的生成量(表1),为了应对氧化应激,恢复平衡状态,相对正常分泌水平过量产生的NOS和NO能清除体内自由基,维持血管正常生理功能。随着丹参酮ⅡA加入,NO水平回升。丹参酮ⅡA也促进了SOD和GSH-PX的分泌,SOD和GSH-PX是体内清除过量氧自由基的系统,能消除人体在吸收代谢过程中生成的有毒有害物质,如超氧阴离子自由基,体内依靠SOD和GSH-PX系统可以维持细胞内的氧化还原状态的平衡。
研究证实在动脉粥样硬化的斑块中存在着血管内皮细胞的凋亡现象。而且血管内皮细胞位于血管最内层,直接与循环血液接触,因此较易受到血液中活性物质及血液剪切力的影响,在心脑血管疾病的发生过程中处于关键环节[9]。细胞凋亡导致细胞核内的DNA因漏出而减少,加入丹参酮ⅡA预处理后,大大减少了凋亡率,保持了内皮细胞的正常活力和生理功能。
综合上述,丹参酮ⅡA在10~100 μmol/L浓度下,无细胞毒性;加入丹参酮ⅡA预处理后,减弱了因H2O2引起的细胞的过度脂质过氧化,维持细胞膜结构,减少了LDH释放率和MDA生成量,增加了NOS、NO、SOD和GSH等抗氧化物质的分泌量,阻碍了细胞凋亡和在血管表皮上形成动脉粥样硬化斑块,阻止AS的发生和发展。
1 Avriam M.Modified forms of low density lipoprotein and atherosclerosis.Atherosclerosis,1993;98:1-9.
2 Fu H,Li J,Li QX,et al.Protective effect of ligustrazine on accelerated anti-glomerular basement membrane antibody nephritis in rats is based on its antioxidant properties.Eur J Pharmacol,2007:197-202.
3 Ross R.The pathogenesis of atherosclerosis:a perspective for the1990s.Nature,1993,362:801-809.
4 Tang F,Wu X,Wang T,et al.Tanshinone II A attenuates atherosclerotic calcification in rat model by inhibition of oxidative stress.Vasc Pharmacol,2007,46:427.
5 Wang L(王兰),Li XR(李新荣),Deng XL(邓湘蕾),et al.The effect of Tanshinone IIA on oxygen free radicals in type diabetes.J Clin Exp Med(临床和实验医学杂志),2007,6(7):8-11.
6 Song LW(宋良文),Wang DW(王德文),Wang TL(王泰龄),et al.Expression and antagonist role of endothelin and nitric oxide synthase in atherosclerotic plaque.Chin J Pathol (中华病理学杂志),1997,26:12-15.
7 Csiszar A,Smith KE,Koller A,et al.Regulation of bone morphogenetic protein-2 expression in endothelial cells:role of nuclear factor-kappaB activation by tumor necrosis factor-alpha,H2O2,and high intravascular pressure.Circulation,2005,111:2364-2372.
8 Peng L(彭亮),Li ZM(李知敏).The protective effect of Spirodela polyrrhiza(L).Schleid extract on ECV-304 injury induced by hydrogen peroxide.Lishizhen Med Mater Med Res (时珍国医国药),2009,20:996-998.
9 Mei JJ(梅家俊),Cai DY(蔡大勇),Zhao TX(赵婷秀),et al.Study of the effective mechanism which Chinese herb Ligusticum chuanxiong Hort prevents and cures the pathological changes of rabbit atherosclerosis.J Hubei Coll Tradit Chin Med(湖北中医学院学报),2004,6:5-7.
