葡萄籽原花青素提取物对糖尿病小鼠血糖的影响
2012-12-22张桂芳徐炳政张东杰
王 颖,张桂芳,徐炳政,姚 笛,张东杰*
1黑龙江八一农垦大学食品学院;2黑龙江省农产品加工工程技术研究中心,大庆,163319
糖尿病是由遗传因素、免疫功能失调、自由基毒素等多种致病因子作用于机体导致胰岛功能减退、胰岛素抵抗等而引发的糖、蛋白质、脂肪、水和电解质等一系列代谢紊乱综合症。近年来,糖尿病发病率急速上升,据世界卫生组织统计,糖尿病已成为继恶性肿瘤和心脑血管疾病之后的第三大严重威胁人类健康的慢性非传染性疾病[1]。目前对于糖尿病的根治尚无有效方法,临床上常用于糖尿病治疗的西药虽然对血糖有较好的控制作用,但毒副作用较大。因此,寻找安全、廉价、有效降糖的天然产物及成分对于糖尿病治疗具有重要意义。葡萄籽原花青素提取物是从葡萄籽中分离出的多酚类混合物,现代研究表明,GSPE具有极强的抗氧化活性[2,3],并且具有调节血脂[4]和预防心血管疾病[5,6]等作用。目前,抗氧化活性成为GSPE研究的热点,但其降糖作用及作用机制却鲜有报道,本实验旨在研究GSPE的降血糖作用及其作用机制,为新型降糖药物和功能性食品的深入开发提供药理学依据。
1 材料与方法
1.1 动物材料
昆明种小鼠,雄性,体重(20~25)g,购自长春生物制品厂,小鼠饲料为标准鼠饲料。
1.2 实验材料及试剂
葡萄籽原花青素提取物(GSPE,纯度>95%,购自天津尖蜂天然产物有限公司,实验前用蒸馏水溶解,配制成所需浓度);格列本脲(国药准字H11020883,北京太洋药业有限公司);四氧嘧啶(ALX,上海亿欣生物科技有限公司);怡成血糖测试仪及测定试纸(北京怡成生物电子技术有限公司);超氧化物歧化酶(SOD)试剂盒与丙二醛(MDA)试剂盒(南京建成生物工程研究所);碘[125I]胰岛素放射免疫分析药盒(上海瑞齐生物科技有限公司);KDC-40低速离心机(科大创新股份有限公司);氯化钠(国产分析纯)等。
1.3 糖尿病模型的建立方法
健康小鼠50只,适应性喂养一周,称重。随机选取10只作为正常对照组,其余分为四个模型组(Ⅰ、Ⅱ、Ⅲ、Ⅳ),每组10只。模型组小鼠禁食不禁水12 h后,腹腔注射ALX生理盐水溶液(浓度2%,新鲜配制),其余四组分别按80、70、60和50 mg/kg四个剂量连续腹腔注射4 d。模型建立期间,采用小鼠尾部静脉取血法,每天测定给药8 h后的小鼠空腹血糖值,观察小鼠血糖变化。按文献方法[7,8],选用血糖值≥14.5 mmol/L的小鼠作为糖尿病成功模型。
1.4 实验动物分组与饲养
取健康小鼠70只,随机抽取10只为正常对照组(BD),其余按ALX诱导糖尿病最佳作用浓度腹腔注射,建立糖尿病模型。将成功造模糖尿病小鼠随机分为5组,每组10只,分别标记为模型对照组(MoD)、格列本脲处理组(GD)、GSPE低剂量组(LD)、GSPE中剂量组(MD)和 GSPE高剂量组(HD)。
每组小鼠(10只)饲养在塑料饲养笼中,饲养笼底部垫有碎纸屑,顶部为钢丝网盖,配有自动饮水器,室温(20±1)℃,相对湿度50%±5%,喂食标准饲料,自由饮水。
1.5 给药剂量和方法
每天同一时间灌胃给药1次,连续给药21 d。具体药物剂量见表1。
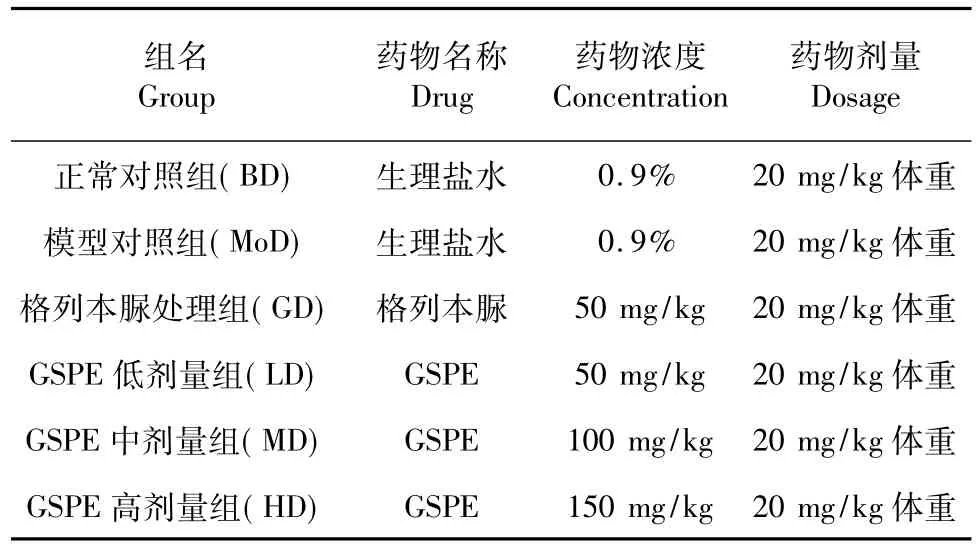
表1 实验动物的药剂分配Table 1 Reagent distribution of experimental animals
1.6 血糖值及体重测定方法
实验期间每天观察小鼠体态特征变化,记录死亡率;分别于给药0、7、14和21 d的同一时间,测定空腹血糖值及体重。
1.7 口服糖耐量试验
糖尿病模型小鼠各组于末次给药后禁食8 h,口服葡萄糖2.5 g/kg,分别于0、0.5、1.0、2.0 h进行尾部静脉取血,测定血糖值。
1.8 血清指标检测
小鼠灌胃实验结束后,摘取眼球,取血,离心,取血清,按照试剂盒方法测定血清中胰岛素含量、MDA含量和SOD活性[9]。
1.9 数据统计学分析
2 结果
2.1 糖尿病小鼠模型的建立
如图1、图2所示,与正常对照组比较,腹腔注射四氧嘧啶能明显提高小鼠血糖值,且具有稳定性。在注射的第1、2 d高剂量注射组的死亡率低于低剂量注射的死亡率,而第3、4 d,高剂量注射组的死亡率明显上升。由此可知,四氧嘧啶注射第2 d适合药物筛选,选择第1 d 80 mg/kg ALX溶液,第二天追加80 mg/kg ALX溶液,糖尿病小鼠模型成功率最高,死亡率<10%。
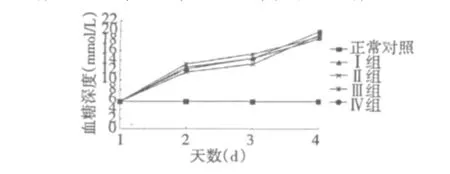
图1 不同浓度ALX处理后小鼠血糖浓度变化Fig.1 Blood glucose change of mice treated by ALX in different concentrations

图2 不同浓度ALX处理小鼠后的死亡率Fig.2 Mortality rate of mice treated by ALX in different concentrations
2.2 一般情况
小鼠造模成功后,明显出现多饮、多食、多尿症状,小鼠活动率降低,精神萎靡,皮毛粗糙。灌喂给药后,格列本脲处理组、GSPE试验组小鼠糖尿病症状缓解,精神状态良好。
2.3 GSPE对ALX糖尿病小鼠体重的影响
图3为GSPE对ALX糖尿病小鼠体重的影响。小鼠造模成功后,分别记录0、7、14、21 d体重。给药0~7 d,糖尿病小鼠体重下降明显。连续21 d给药,GSPE各剂量组小鼠体重均有所上升,GSPE高剂量组对糖尿病小鼠体重影响与格列苯脲作用效果相似,体重增加明显(P<0.05)。表明GSPE能够有效缓解糖尿病小鼠消瘦症状,对糖尿病小鼠体重下降具有一定的治疗与恢复作用。
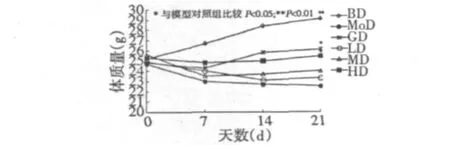
图3 GSPE对ALX糖尿病小鼠体重的影响Fig.3 Effect of GSPE on the body weights of ALX diabetic mice
2.4 GSPE对ALX糖尿病小鼠空腹血糖的影响
图4为GSPE对ALX糖尿病小鼠空腹血糖的影响。由图可以看出,与正常对照组比较,腹腔注射ALX后,所有糖尿病小鼠空腹血糖值均明显升高,且具有显著性,表明糖尿病小鼠模型造模成功。小鼠灌胃给药21 d后,模型对照组血糖仍处于较高水平。与模型对照组比较,格列本脲处理组小鼠血糖显著降低(P<0.01),GSPE中、高剂量组血糖显著降低(分别为P<0.05,P<0.01)。结果提示,GSPE可以降低ALX诱导糖尿病小鼠血糖,降糖效果与药物剂量成正相关。

图4 GSPE对ALX糖尿病小鼠空腹血糖的影响Fig.4 Effect of GSPE on fasting blood glucose of ALX diabetic mice
2.5 GSPE对ALX糖尿病小鼠葡萄糖耐受量的影响
图5为GSPE对ALX糖尿病小鼠葡萄糖耐受量的影响。由图可以看出,给予葡萄糖0.5 h后,各组小鼠血糖值升至最大值后逐渐下降。与模型对照组比较,0.5 h时,GSPE低、中、高剂量组均可抑制四氧嘧啶高糖小鼠葡萄糖负荷后血糖的升高;与模型对照组比较,2 h后,GSPE中、高剂量组血糖下降显著(分别为P<0.05,P<0.01)。表明GSPE有提高糖尿病小鼠对葡萄糖的耐受能力作用,且高剂量作用效果较好。
图5 GSPE对ALX糖尿病小鼠葡萄糖耐受量的影响Fig.5 Effect of GEPE on glucose tolerance of ALX diabetic mice
2.6 GSPE对ALX糖尿病小鼠胰岛素水平的影响
图6为GSPE对ALX糖尿病小鼠胰岛素水平的影响。与正常对照组比较,模型对照组小鼠胰岛素含量下降显著(P<0.01);与模型对照组比,GSPE低、中剂量组胰岛素水平上升明显(P<0.05);格列本脲处理组和GSPE高剂量组胰岛素水平上升显著(P<0.01)。结果提示,GSPE降低糖尿病小鼠的血糖值与其能够提高胰岛素水平有关。


2.7 GSPE对ALX糖尿病小鼠血清MDA含量和SOD活性的影响
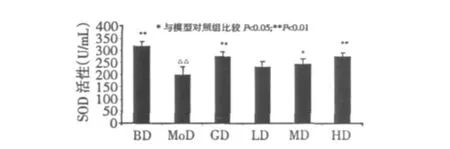
图8 GSPE对ALX糖尿病小鼠血清SOD活性的影响Fig.8 Effect of GSPE on serum SOD activity of ALX diabetic mice
图7和图8分别为GSPE对ALX糖尿病小鼠血清MDA含量和血清SOD活性的影响。血清MDA含量与SOD活性是评价机体抗氧化能力的重要指标。由图可以看出,与正常对照组比较,模型对照组小鼠血清MDA含量显著升高(P<0.01),SOD活性显著降低(P<0.01),表明模型组小鼠机体抗氧化能力明显低于正常对照组小鼠,提示四氧嘧啶注射对小鼠抗氧化能力具有减弱作用。但经灌胃给药GSPE以及腹腔注射格列苯脲后,ALX糖尿病小鼠血清MDA含量和SOD活性有不同程度的改善。与模型对照组小鼠比较,GSPE中、高剂量组糖尿病小鼠的血清MDA含量明显下降(P<0.05),血清SOD活性明显提高(中剂量组P<0.05,高剂量组P<0.01);结果提示,GSPE具有恢复糖尿病小鼠抗氧化能力的效果,中、高剂量组作用效果较好。
3 讨论
四氧嘧啶是一种特异性的β-细胞毒剂,其在体内可被胰岛β-细胞有效吸收,在细胞内产生过量自由基,改变β-细胞的结构,导致胰岛β-细胞的损伤和坏死,胰岛素水平降低而出现高血糖等糖尿病症状[10,11],同时糖尿病引起的高血糖可使体内脂质代谢紊乱,引起氧化应激升高,破坏机体的抗氧化能力,引起β-细胞损伤持续恶化[12],这种作用机制与临床上Ⅱ型糖尿病相似[13]。四氧嘧啶能够有效引起血糖升高,且让其长时间处于较高水平。因此,本实验采用ALX为诱导剂构建糖尿病模型,在此模型上研究GSPE对糖尿病小鼠的影响。
本实验在ALX诱导小鼠糖尿病摸索过程中,与正常小鼠比较,四个模型组血糖均显著上升,小鼠精神萎靡,体重下降,出现“三多”典型糖尿病特征,说明四氧嘧啶诱导糖尿病小鼠成功,但是诱导后期,小鼠出现大量死亡,可能是由于四氧嘧啶导致小鼠β-细胞严重受损,体内糖代谢与脂质代谢严重紊乱[4]。检查死亡小鼠,部分出现腹部肿胀,可能是由于胰岛及脏器受损充水肿胀破裂。由此,本实验诱导小鼠模型采用追加药物法,第一天注射四氧嘧啶溶液为80 mg/kg,第二天注射四氧嘧啶溶液为80 mg/kg,采用本方法,小鼠造模成功率高,死亡率较低。
本实验发现,ALX引起小鼠体重下降,空腹血糖值上升,血清MDA含量升高,SOD活性降低,血清胰岛素水平下降等,与文献报道相似[14,15]。实验结果显示,GSPE能够降低糖尿病小鼠的空腹血糖、提高糖耐量,增加体重,提升机体胰岛素水平,试验期间小鼠皮毛出现光泽,饮食、饮水量趋于正常,活动量增加,提示GSPE降糖作用机制可能与修复受损胰岛β-细胞,提升胰岛素水平有关。SOD是机体清除氧自由基的重要酶类,高血糖可使SOD活性下降,减弱其对自由基的清除。机体大量自由基是导致糖尿病并发症的主要因素。GSPE可以改善糖尿病小鼠SOD活性,降低MDA含量,表明GSPE可以通过提高机体抗氧化能力,清除体内自由基来预防和治疗糖尿病及其并发症。
1 Cockram C.Type 2 Diabetes Practical Targets and Treatments.Asian-pacific type 2 diabetes policy group,2005.1-6.
2 Wu YJ(吴英俊),Liang YF(梁忆非),Dong JN(董嘉楠).Advances in research of grape seed proanthocyanidin.J Trop Med(热带医学杂志),2010,10:1025-1028.
3 Zhu ZQ(朱振勤),Zhai WY(翟万银),Chen JW(陈季武),et al.Studies on the antioxidation effects of grape seed procyanidins extract.J East China Normal Univ(Nat Sci) (华东师范大学学报,自科版),2005,(1):98-102.
4 Yan SF(闫少芳),Li Y(李勇),Wu J(吴娟),et al.Study of the effect of grape seed extract procyanidin on blood lipid regulation and mechanism.Chin J Food Hyg(中国食品卫生杂志),2003,15:302-304.
5 Xue YW(薛燕潍),Wang F(王峰).Anti-atherosclerosis of procyanidin on experimental rat and its mechanisms.Chin Prac Med(中国实用医药),2010,13:44-45.
6 Bi L(毕玲),Fu BP(傅柏平).Advances in research of grape seed proanthocyanidin extracts.Chin New Drugs J(中国新药杂志),2008,17:1478-1481.
7 Chen HY(陈红艳),Yang XB(杨新波).Diabetic model induced by alloxan in mice and its affecting factors.Bull Acad Mil Med Sci(军事医学科学院院刊),2005,29:535-542.
8 Xiao XH(肖小华),Xu LY(徐丽瑛),Zhu LY(朱令元),et al.Study on the model of diabetic mice and rat induced by alloxan.Sci Mosaic(科技广场),2010,10:112-114.
9 Li JZ(李记争),Yang G(杨光).Studies of the hypoglycemic effect of Sonchus oleraceus extract on experimental diabetic mice.Lishizhen Med Mater Med Res(时珍国医国药),2011,22:419-421.
10 Wang LP(王柳萍),Yang B(杨斌),Zhou L(周丽).Studies on the factors affecting the diabetic model induced by alloxan in mice.J Guangxi Med Univ(广西医科大学学报),2004,21:33-35.
11 Sharma B,Viswanath G,Salunke R,et al.Effects of flavonoid-rich extract from seeds of Eugenia jambolana(L)on carbohydrate and lipid metabolism in diabetic mice.Food Chem,2008,110:697-705.
12 Wang XL(王晓凌),Jiang LL(姜玲玲),Ma J(马静),et al.Changes of very long-chain free fatty acids in serum and liver tissues of rats with diabetes induced by high fat food.Chin Gen Pract(中国全科医学),2008,11:306-308.
13 Liu D(刘丹),Lan QQ(蓝青强),Ren M(任明),et al.Insulin resistance syndrome and treatment research of type 2 diabetes mellitus for machine.The 1st Academic Congress Specialty Committee of Geriatric Medicine,The World Federation of Chinese Medicine Societies(世界中医药学会联合会老年医学专业委员会成立大会暨第一届学术会议),2008.407-410.
14 Shi LX(施利仙),ShangGuan XC(上官新晨),Wang WJ (王文君),et al.Effects of polysaccharide of Cyclocarya paliurus on alloxan-induced diabetic mice.Acta Nutr Sin(营养学报),2009,3:263-266.
15 Yin SL(殷松楼),Zhou DM(周冬梅),Liu CM(刘春梅),et al.The effects of pioglitazone on oxidative stress of the hearts of diabetic rats.Shandong Med J(山东医药),2010,37:21-22.
