乳腺癌中AKT激活与耐药蛋白表达相关性
2012-12-15王鲁建孙丽梅
王鲁建 孙丽梅
乳腺癌中AKT激活与耐药蛋白表达相关性
王鲁建1孙丽梅*
(中国医科大学基础医学院病理学教研室;1人体解剖学教研室,沈阳110001)
目的 明确乳腺癌中Akt的过度表达与P-gp、GST-π、TopoⅡ三种耐药蛋白的相关性。方法 采用免疫组织化学方法检测260例乳腺癌中Akt和P-gp、TopoⅡ、GST-π的表达情况。结果 乳腺癌中Akt、GST-π和TopoⅡ的表达与肿瘤大小相关,随着肿瘤体积增大,AKT、GST-π和TopoⅡ的阳性表达率增高;Akt和P-gp在伴有淋巴结转移的病例中高表达,且随着淋巴结的数目增多Akt表达越来越高;Akt、P-gp和GST-π的阳性表达患者预后差;Akt与P-gp、GST-π、Topo-Ⅱ阳性表达之间均呈显著相关性。结论 信号转导途径中Akt的激活与P-gp、GST-π、TopoⅡ三种耐药蛋白有相关性,AKT有可能在乳腺癌多药耐药的发生机制中起到一定的作用。
Akt;P-gp;GST-π;TopoⅡ;乳腺癌
抑癌基因的失活导致信号传导途径中Akt通过磷酸化被激活,激活的Akt失去对肿瘤细胞增殖、分化的正常调控,细胞癌变;同时活化的Akt是一个细胞存活因子,帮助细胞逃避程序化死亡;而细胞逃避自身防御性死亡正是肿瘤发生的关键环节。我们推测Akt的激活抑制肿瘤细胞的凋亡,而多种化疗药物正是通过损伤DNA而促发肿瘤细胞凋亡来达到治疗目的[1],所以Akt的激活会导致临床化疗疗效差。因此,Akt作为细胞生存的一个关键性因子,对于肿瘤的形成模式及其诊断与治疗具有十分重要的意义。
材料和方法
1.材料
选取中国医科大学病理教研室1994年1月-1998年12月间乳腺良性增生标本10例,原发性乳腺癌手术切除标本中挑选有完整随访记录和TNM分期的病例260例,并以远离肿块5-7c m乳腺组织10例作为正常对照。所有标本经病理确诊,均为女性,年龄在28-78岁之间。其中乳腺浸润性导管癌175例,乳腺导管内癌29例,乳腺导管内癌伴早期浸润45例,其它11例。临床分期按2010年第七版年国际抗癌联盟TNM分期,0期Ⅰ期111例,Ⅱ期48例,Ⅲ期101例,Ⅳ期0例。有淋巴结转移114例,无淋巴结转移146例。预后的计算是考虑术后五年时病人为无瘤生存还是为复发或死亡等情况。
2.免疫组织化学染色
采用福州迈新公司生产的S-P即用型试剂盒及即用型3种鼠源性单克隆抗体(磷酸化Akt/PKB,P-Glycoprotein,GST-π,Topoiso meraseⅡ)。石蜡包埋组织切片4μm厚,常规脱蜡至水,0.3%过氧化氢室温下10 min,以阻断内源性过氧化物酶;充分水洗,于p H6.0的柠檬酸缓冲液中高压锅处理10 min,室温冷却;非免疫羊血清封闭10 min后,加入即用型鼠单抗磷酸化 Akt/PKB,P-gp,GST-π和TopoⅡ,4℃冰箱过夜,再加入生物素化羊抗鼠Ig G和S-P复合物。以DAB液显色,苏木素复染,常规脱水,透明,封片。阳性对照采用购自福州迈新公司的阳性片,阴性对照采用PBS液代替一抗。
3.阳性判定标准
Akt、P-gp和GST-π在细胞膜、细胞质中,TopoⅡ在细胞核中出现黄至棕黄色颗粒为阳性显色,以染色强度和阳性细胞比例评定阳性表达。光镜下每张切片中选取癌细胞较多的5个高倍视野,每个视野计数100个细胞。阳性细胞率及染色反应分为2级:阴性(-)为细胞不着色或阳性细胞率<10%;阳性(+)为细胞着色呈棕黄色或阳性细胞率≥10%。本组HE切片和免疫组织化学切片由两名病理科医师阅读完成。
4.统计学方法
采用SPSS13.0统计分析软件,两样本率的比较采用四格表资料的χ2检验;多样本率的比较采用行χ列表资料的χ2检验;参数间的相关性采用spear man等级相关分析;多个样本均数比较采用单因素方差分析。以P<0.05为有显著性差异。
结 果
1.P-gp的表达
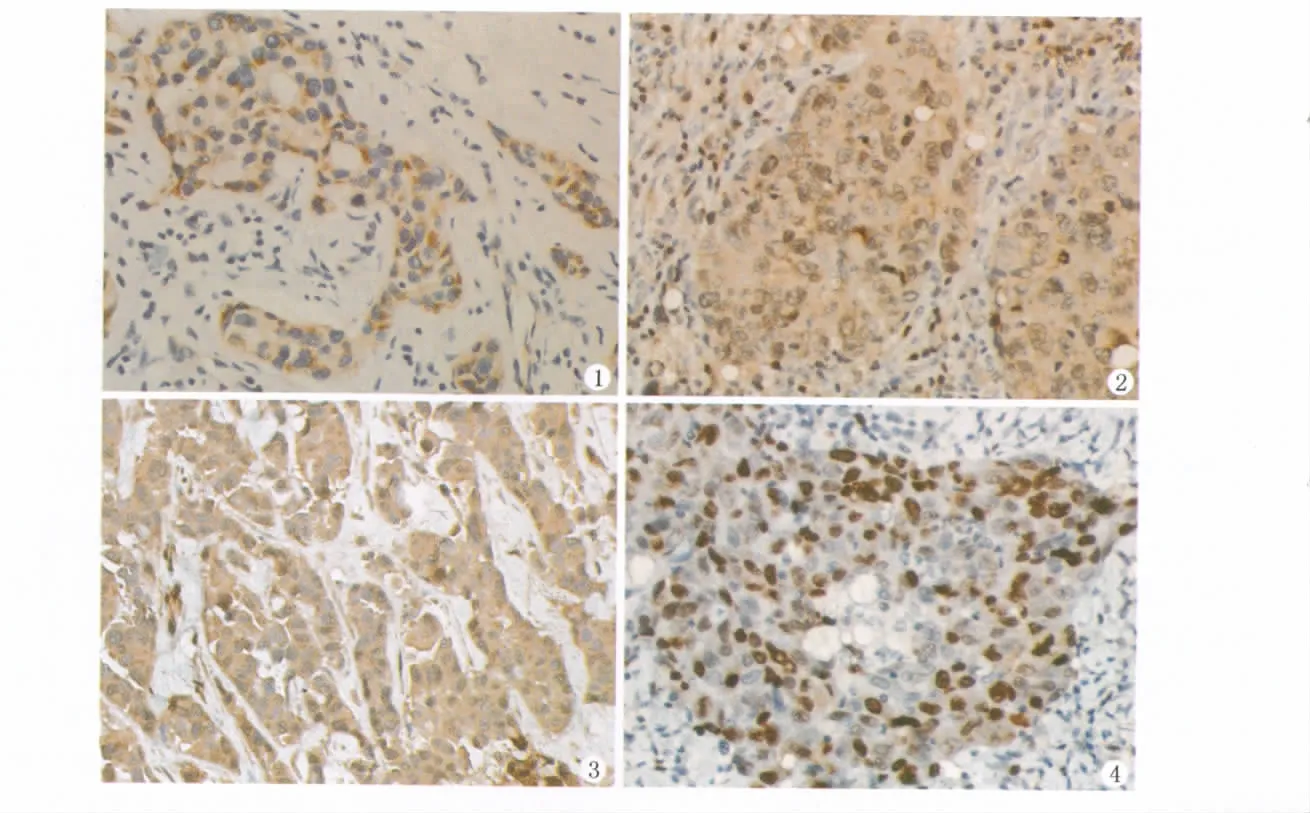
正常乳腺小叶腺上皮及增生的腺上皮未见P-gp蛋白的阳性表达,P-gp在癌组织中为棕黄颗粒呈簇状或弥漫分布于细胞质及细胞膜上,常可见整个癌巢着色(图2)。乳腺癌中P-gp的总阳性率为58.08%(151/260)。P-gp在良性病变不表达,随着癌变动态过程P-gp的表达在逐渐升高,在乳腺导管内癌伴早期浸润和乳腺浸润性导管癌中的表达均明显高于乳腺导管内癌,差异显著(χ2=3.98;χ2=3.84)(P<0.05)。P-gp在伴有淋巴结转移的病例中高表达,其中有1-3个淋巴结转移与无淋巴结转移之间差异显著(χ2=5.09,P<0.05);临床Ⅱ、Ⅲ期P-gp阳性表达高于临床Ⅰ期,Ⅱ期与Ⅰ期差异显著(χ2=6.53,P<0.05);P-gp阳性表达患者的术后五年无瘤生存率48.34%明显低于P-gp阴性表达患者的术后五年无瘤生存率76.15%,差异有显著性(χ2=19.25,P<0.01)(表1)。
2.GST-π的表达
正常乳腺小叶腺上皮也未见GST-π蛋白的阳性表达,增生的腺上皮只有一例表达弱阳性;在癌组织中GST-π呈棕黄色颗粒分布于胞质,常伴有核染色,并可见整个癌巢着色(图3)。乳腺癌中GST-π的总阳性率为49.23%(128/260)。GST-π在良性病变弱表达,随着癌变动态过程GST-π的表达也在逐渐升高,在乳腺导管内癌伴早期浸润和乳腺浸润性导管癌中的表达也高于乳腺导管内癌,但差异并不显著(χ2=2.14;χ2=3.58)。GST-π在肿瘤体积大于5c m的病例中表达率高,与小于2c m或2-5c m相比,差异显著(χ2=3.97;χ2=4.86)(P<0.05);GST-π阳性表达患者的术后五年无瘤生存率(52.34%)也低于GST-π阴性表达患者(67.42%),差异有显著性(χ2=5.55,P<0.05)(表1)。
3.TopoⅡ的表达
TopoⅡ阳性表达定位于细胞核,核呈深棕黄色颗粒状;阳性细胞分布无规律,呈灶状或单个细胞散在分布(图4)。癌旁及增生的乳腺小叶内可见一些阳性表达的细胞。乳腺癌中TopoⅡ的总阳性率为51.15%(133/260)。TopoⅡ在良性病变中弱表达,随着癌变动态过程TopoⅡ的表达在逐渐升高,在伴有早期浸润的乳腺导管内癌和乳腺浸润性导管癌中的表达明显高于乳腺导管内癌,差异显著(χ2=7.75;χ2=7.88)(P<0.01)。TopoⅡ在年龄小于40岁患者中表达率较低,与40-50岁之间的患者相比差异显著(χ2=4.70,P<0.05);且随着肿瘤体积增大,TopoⅡ阳性表达率增高,体积大于5c m的达到100%阳性,差异显著(T≤2c m与 T=2-5c m:χ2=7.52;T=2-5c m与T>5c m:χ2=11.28;T≤2c m与T>5c m:χ2=37.10)(P<0.01);TopoⅡ从临床Ⅰ期到Ⅲ期的阳性表达率也越来越高,其中Ⅰ期与Ⅲ期差异显著(χ2=4.28,P<0.05);TopoⅡ的表达与预后无关(χ2=3.42)(表1)。
4.Akt的表达
乳腺癌中Akt阳性信号主要存在于胞膜、胞质中,呈棕黄色颗粒(图1)。癌旁及乳腺病的乳腺组织及间质中未见阳性表达。乳腺癌中Akt的总阳性率为50.00% (130/260)。其中乳腺导管内癌Akt的阳性率为31.03% (9/29)、乳腺导管内癌伴早期浸润为51.11%(23/45)、乳腺浸润性导管癌为53.14%(93/175)。Akt的表达随着癌变动态变化过程在逐渐增高,在乳腺浸润性导管癌中的表达高于乳腺导管内癌中的表达,差异有统计学意义(χ2=4.02,P=0.0450);Akt表达和肿瘤大小相关,肿瘤体积越大Akt阳性表达率越高,其中体积<2c m的肿瘤和体积≥5c m的相比差异有统计学意义(χ2=11.66,P=0.0006);Akt在伴有淋巴结转移的病例中高表达,无淋巴结转移的病例与伴有1-3个或3个以上淋巴结转移情况相比差异均有统计学意义(χ2=23.78,P=0.0000;χ2=31.61,P=0.0000)。Akt阳性表达患者的术后五年无瘤生存率49.23%低于Akt阴性表达患者的术后五年无瘤生存率70.77%,差异有有统计学意义(χ2=11.68,P=0.0006)(表1)。
5.Akt与p-gp、GST-π、TopoⅡ表达的相关性
AKT、GST-π、TopoⅡ的表达均与肿瘤大小相关,随着肿瘤体积增大,AKT和GST-π、TopoⅡ的阳性表达率增高;AKT和P-gp在伴有淋巴结转移的病例中高表达;AKT、P-gp、GST-π阳性表达的患者预后差。AKT 与 P-gp、GST-π、Topo-Ⅱ阳性表达之间均呈显著相关性 (表2)。

表1 P-gp、GST-π、TopoⅡ和AKT在乳腺癌中阳性表达与临床病理参数的关系Table 1 Relationship bet ween clinical para meters and expression of P-gp、GST-π、TopoⅡand AKT in breast cancer
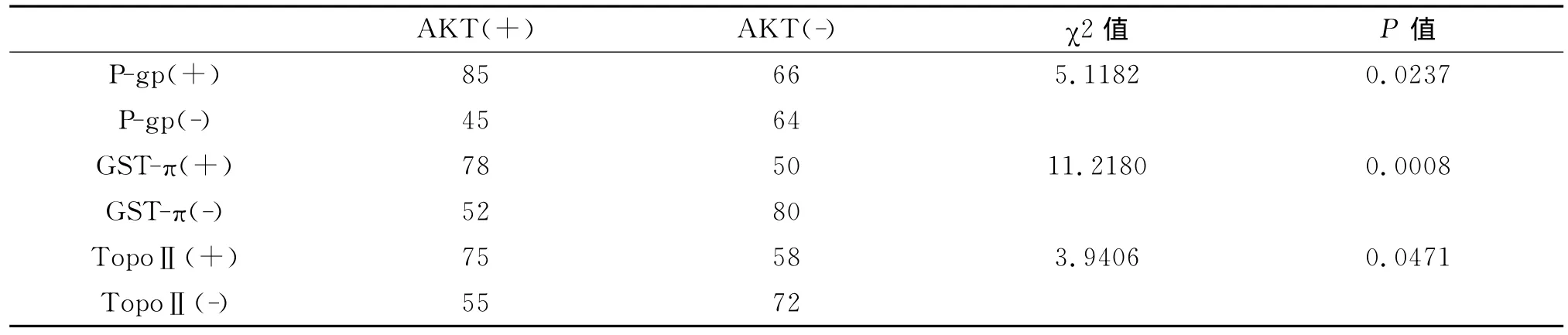
表2 AKT与P-gp、GST-π、TopoⅡ在乳腺癌中表达相关性Table 2 Correlation of AKT and P-gp、GST-π、TopoⅡin breast cancer
讨 论
乳腺癌是危害女性健康的恶性肿瘤之一,尽管常规采取的外科手术治疗及术后的放化疗已经有了多次的改良,但是乳腺癌仍具有很高的死亡率。乳腺癌耐药相关基因的产生是困扰临床的一大难题。肿瘤细胞产生耐药性是多方面的,其中以多药耐药性(multidr ug resistance,MDR)最为常见[2]。MDR基因的过度表达或扩增往往导致肿瘤患者化疗的失败,并伴随病情的发展或肿瘤复发及转移[3]。P-gp是由MDRl基因编码的相对分子质量为170 000的膜糖蛋白,P-gp跨膜结构具有能量依赖性"药泵"功能,在ATP提供能量时能使细胞内药物转出细胞外,造成细胞内药物浓度下降,细胞毒作用降低或完全丧失,从而使细胞产生耐药[4-5]。1979年,Mar nervik等[6]从胎盘中纯化、分离出谷胱甘肽S转移酶-π(gl utathione s transferase-π,GST-π)。GST-π以催化方式降解药物,它不但可催化亲电物质与谷胱甘肽结合,还可以和亲脂性细胞毒物结合增加其水溶性,促进其代谢,降低抗肿瘤药物的细胞毒作用而产生耐药[7]。不典型多药耐药(atypical MDR)出现可以是由于药物识别(结合)部位、ATP消耗、TopoⅡ数量和分布、磷酸化等的改变所引起的。其中TopoⅡ在耐药中的作用更为突出。Topo II又称旋转酶(gyrase),具有磷酸二酯酶活性,能与DNA形成稳定的共价复合物,在细胞增殖期含量增高,在体细胞核中TopoⅡ对DNA解链、断裂和DNA复制后断端连接和复位起关键作用,是真核细胞内重要的核酶,对真核细胞中DNA转录、复制和重组过程中发挥重要作用[8],TopoⅡ表达降低使肿瘤细胞对多种抗癌药产生耐药,Topo II含量的高低,可作为判定各种肿瘤对抗癌药物的敏感性或抗药性的指标,也是目前抗癌药物替尼泊苷的一个重要作用靶点[9],被广泛用于乳腺癌的治疗[10,11]。
Akt又称蛋白激酶B(protein kinase B),是一种丝氨酸/苏氨酸蛋白激酶,被认为与肿瘤发生有关,被逆转录病毒癌基因PI3K变构的细胞可表现出持续的Akt活性而易发生癌变,而用显性失活Akt等位基因转染的这些细胞却能逆转其致癌的变构,提示Akt与肿瘤的发生相关[12]。Akt信号转导途径在肿瘤形成过程中起关键调节作用,包括恶性转化细胞的增殖、抑制凋亡、增强端粒酶活性、促进肿瘤新生血管形成以及增加肿瘤细胞的侵袭力,p-Akt过表达可能是乳腺癌预后重要的预测指标[13]。总之,致癌基因可能通过高度激活的Akt来阻断生理性的细胞凋亡,使细胞失去正常增殖与分化的能力从而导致癌变。Akt通过磷酸化被激活,活化的Akt是一个细胞存活因子,帮助细胞逃避程序化死亡;而细胞逃避自身防御性死亡正是肿瘤发生的关键环节。我们推测Akt的激活抑制肿瘤细胞的凋亡,而多种化疗药物正是通过损伤DNA而促发肿瘤细胞凋亡来达到治疗目的[1],所以Akt的激活会导致临床化疗疗效差。本实验中Akt、GST-π和TopoⅡ的表达与肿瘤大小相关,随着肿瘤体积增大,AKT、GST-π和TopoⅡ的阳性表达率增高,说明三者在肿瘤的生长中可能具有协同促进作用;Akt的表达与肿瘤细胞增殖能力有一定关系,激活的Akt会失去对肿瘤细胞增殖、分化的正常调控;Akt和P-gp在伴有淋巴结转移的病例中高表达,且随着淋巴结的数目增多Akt表达越来越高,提示Akt和P-gp的表达情况可以作为乳腺癌是否发生淋巴结转移的一个预测指标。Akt、P-gp和GST-π的阳性表达患者预后差,表明 Akt、P-gp和GST-π的表达情况可作为评估乳腺癌患者预后的可参考指标之一。Akt与P-gp、GST-π、Topo-Ⅱ阳性表达之间均呈显著相关性,表明信号转导途径中Akt的激活不仅在肿瘤的发生中,而且在肿瘤耐药的发生中也起到了一定的作用。Akt作为细胞生存的一个关键性因子,对于肿瘤的形成模式及其诊断与治疗具有十分重要的意义。
[1]Hitoshi T,Chinami S,Shoichiro T,et al.Aprospective study of the significance of t he gene and chr o moso me alteration as prognostic indicators of breast cancer patients with ly mphnode metastases.Breast Cancer Res Treat,1998,48(1):21-32
[2]Rolff J,Dor n C,Mer k J,et al.Response of Patient-Derived Non-Small Cell Lung Cancer Xenografts to Classical and Tar geted Therapies Is Not Related to Multidr ug Resistance Mar kers.J Oncol,2009,814140
[3]Shi H,Lu D,Shu Y,et al.Expression of multidrug resistance-related proteins p-glycoprotein,glutathione-stransferases,topoiso merase-lI and lung resistance pr otein in pri mary gastric cardiac adenocarcino ma.Hepatogastr oenterology,2008,55(86-87):1530-1536
[4]de Figueiredo-Pontes LL,Pintao MC,Oliveira LC,et al.Deter mination of P-glycoprotein,MDR-related pr otein 1,breast cancer resistance protein,and lung-resistance protein expression in leuke mic stem cells of a cute myeloid leukemia.Cyto metry B Clin Cyto m,2008,74(3):163-168
[5]Gangemi R,Paleari L,Orengo AM,et al.Cancer stem cells:a new paradig m for understanding tu mor growth and progression and dr ug resistance.Curr Med Chem,2009,16(14):1688-1703
[6]Jakobson I,War hol m M,Mannervik B.The binding of substrates and a product of the enzy matic reaction to glutathione S-transferase A.J Biol Che m.1979,254(15):7085-7089
[7]Ki m SU,Lee K M,Par k SK,et al.Genetic poly morphis m of glutathione S-transferase P1 and breast cancer risk.J Biochem Mol Biol.2004,37(5):582-585
[8]Kantidze OL,Razin SV.Che motherapy-related secondary leukemias:A role f or DNA repair by error-prone non-ho mologous end joining in topoiso merase II -Induced chromosomal rearrangements.Gene.2007,391(1-2):76-79
[9]Perr y MC.The chemotherapy source Book.3th ed.Phila delphia:Lippincott Willia ms and Wilkins,2002:278-289
[10]Pusztai L.Current 8tat us of pr ognostic pr ofiling in breast cancer.Oncologist,2008,13:350-360
[11]Hajduk M.Topoiso menase 11 alpha f unda mental pr og nostic factor in breast carcino ma.Pol J Pathol,2009,60:67-75
[12]Ki m D,Cheng GZ,Lindsley CW,et al.Targeting the phosphatidylinositol-3 kinase/Akt path way for t he treat ment of cancer.Curr Opin Investig Drugs,2005,6(12):1250-1258
[13]Faratian D,Bartlett J.Predictive mar kers in breast cancer--the f uture.Histopathology,2008,52(1):91-98
图 版 说 明
图1 乳腺癌中AKT阳性表达(SP×400)
图2 乳腺癌中P-gp阳性表达(SP×400)
图3 乳腺癌中GST-π阳性表达(SP×400)
图4 乳腺癌中TopoⅡ阳性表达(SP×400)
EXPLANATION OF FIGURES
Fig.1 Positive expression of AKT protein in breast carcinoma(SP mothod×400)
Fig.2 Positive expression of P-gp protein in breast carcino ma(SP mothod×400)
Fig.3 Positive expression of GST-πprotein in breast carcinoma(SP mothod×400)
Fig.4 Positive expression of TopoⅡ protein in breast carcino ma(SP mothod×400)
Correlation of AKT activation with drug resistance protein expression in breast cancer
Wang Lujian1,Sun Li mei*
(Depart ment of Pathology and College of Basic Medical Sciences,1Depart ment of Hu man Anato my,China Medical University,Shenyang 110001,China)
Objective To explain whether over-expression of the Akt gene is correlated to the expressions of P-gp,GST-πand TopoⅡin breast cancer.Methods SP i mmunohistochemical method was used to examine the expressions of Akt,P-gp,GST-πand TopoⅡin 260 sa mples of pri mary breast cancer.Results Akt,GST-πand TopoⅡexpressions in breast cancer were positively associated with tu mor size.High expression of Akt and P-gp were seen in t he cases with l y mph node metastasis,and t he expression of Akt beca me higher and higher wit h t he increase in the nu mber of ly mph nodes.The positive expressions of Akt,P-gp and GST-πindicated poor prognosis.There were significant correlations bet ween Akt and positive expressions of P-gp,GST-πand Topo-Ⅱ.Concl usion Activation of Akt in t he signal transduction pat h way is correlated wit h resistance pr oteins P-gp,GST-π,and Topo Ⅱ.AKT may play a certain r ole in t he mechanis m of multidrug resistance in breast cancer.
Akt;P-gp;GST-π;TopoⅡ;Breast Cancer
R737.9
A
10.3870/zgzzhx.2012.04.019
2012-02-10
2012-05-23
王鲁建,男(1971年),汉族,硕士。
*通讯作者(To who m correspondence should be addressed)
