提高细胞学标本阳性检出率的制片技术探讨
2012-12-15田玉旺朱红艳朱培双李红霞
田玉旺 朱红艳 邢 宜 朱培双 李红霞
提高细胞学标本阳性检出率的制片技术探讨
田玉旺 朱红艳 邢 宜 朱培双 李红霞
(北京军区总医院病理科,北京100700)
细胞学标本;阳性检出率;制片技术;探讨
细胞学检查以其简便、快速、经济实用等优势,对肿瘤的早期发现发挥着重要的作用。细胞学的正确诊断对指导临床诊断及治疗也起到决定性作用。细胞学标本包括痰、尿、胸腹水、妇科标本等。高质量的细胞学涂片及染色是获得准确诊断的重要环节。多数细胞学的漏诊与误诊始于低劣的制片和染色技术。重视细胞学的制作质量无疑是提高细胞学阳性检出率的重要保证。
材料和方法
1.材料选取我院2010年10月至2011年10月临床送检的各种细胞学标本。包括痰125例、胸腹水55例、尿50例及妇科标本238例。
2.仪器液基薄层制片系统由震荡仪,Shandon Cytospin4离心制片机和Shandon专用制片盒组成,购于北京弘泰嘉业科技发展有限公司。
3.试剂
3.1 涂片固定液的配制95%酒精100 ml+冰醋酸1 ml混合液。
3.2 痰液溶解剂的配制 N-乙酰-L-半胱氨酸10g+无水酒精50 ml+蒸馏水50 ml。
3.3 溶血剂的配制50 ml无水酒精+50 ml蒸馏水。
3.4 宫颈细胞保存液购于北京弘泰嘉业科技发展有限公司。
4.方法
制片方法包括手工涂片和液基制片技术;染色方法包括HE染色和巴氏染色。
4.1 胸腹水、尿液手工制片方法
将临床送检的体液标本上半部轻轻倒掉,保留底部沉淀物20 ml,摇均后注入50 ml锥形离心管中,平衡后,2000转/分,离心5-10 min。若体液标本含血量较多,需加入适量溶血剂后再进行离心。离心后将上清液吸出弃掉,留少许上清液与离心管底部的沉淀物混匀,采用推片涂片法进行制片。涂片微干后,进行固定,染色,脱水,透明,封片。
4.2 痰标本和宫颈标本的液基细胞学制片方法
4.2.1 痰标本制片方法
用眼科镊子挑取灰白色带血丝样病变痰标本2-4 ml,置于盛有4-8毫升痰液溶解剂的锥形离心管内,充分振荡10-20min,对痰液标本进行消化处理,然后取出处理后的痰液0.5-4 ml,放入专用的制片盒中,同时在每个制片盒内各放一张载玻片,然后将制片盒放入离心制片机内,2250转/分,离心5min,取出载玻片,待涂片微干后,固定,染色,脱水,透明,封片。
4.2.2 宫颈标本制片方法
妇科取材后的宫颈细胞刷直接放入盛有宫颈细胞保存液的瓶中,充分振荡10-20 min,混匀后,取出0.5-4 ml,放入专用的制片盒中,同时在每个制片盒内各放一张载玻片,然后将制片盒放入离心制片机内,2250转/分,离心5 min,取出载玻片,待涂片微干后,固定,染色,脱水,透明,封片。
结 果
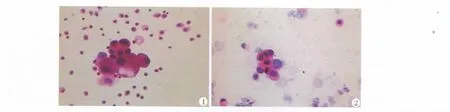
在胸腹水和尿标本手工制片及痰和宫颈标本液基制片过程中,注意文中所述细节后,制片质量明显提高。各种细胞结构显示清晰,核浆对比分明。血性胸水标本,经溶血剂处理后,背景较干净,癌细胞结构显示清楚(图1);痰标本:经痰液溶解剂处理后,背景较干净,癌细胞结构显示清晰(图2)。
讨 论
根据多年的工作经验,细胞学标本在制片过程中,注意以下细节能够显著提高细胞学的阳性检出率。
1.标本取材的质量决定诊断的准确性
脱落细胞是指正常或病理情况下,自然脱落下的细胞,随分泌物、排泄物排出体外。恶性肿瘤的组织细胞之间粘合力下降,加上常有出血坏死等情况,致使肿瘤细胞更易脱落。这是脱落细胞学用以临床诊断的理论依据。
细胞学标本的正确采集是细胞学诊断的先决条件,是后续工作的基础。只有采集到合格的标本,才能做出可靠的细胞学病理诊断。
1.1 痰液细胞学标本
痰液采集通常采用自然咳痰法。嘱咐病人早晨咳痰前,应用清水先漱口、刷牙,以避免食物残渣和细菌的污染。务必要从肺部深处用力咳出痰液。方法:指导病人做几次深呼吸后,用力咳痰。若开始无痰或少痰,可反复咳痰4-5次,直到咳出肺深部的痰液。关于留痰时间多主张留晨痰,因为患者经一夜睡眠后,异常分泌物常积聚在呼吸道内,细胞来源较广泛。但晨痰有如下缺陷:①晨痰在体内停留时间较长,细胞往往发生不同程度的退变,细胞结构不清,影响诊断。②老年人尤其是慢性咽炎、鼻咽炎的人,清晨的头几口痰往往是上呼吸道的分泌物,使诊断的准确性降低。因此,我们认为晨痰并非最佳的检材。如患者痰量较多或留痰并不困难的病例,我们主张最好在早晨排痰以后,留取上午8-9时的新鲜痰比较适宜。此痰细胞退变较少,利于细胞学检查。某些患者很少或没有自然排痰,嘱咐患者叩击患侧胸背部,深呼吸,用力咳新鲜痰,或可采用高渗盐水薄荷雾化吸入法促进排痰,由于高渗盐水稀释痰液,薄荷引起刺激性咳嗽,使无痰者有痰,另外剧烈咳嗽病变部癌细胞有机会随痰咳出。
1.1.1 痰液是从各支气管所汇集的分泌物,其中包括从病变处来源的痰液。病变处痰液有特有的形状,应仔细挑选。若痰内混有大量的食物残渣或唾液的标本,呈口水样应立即通知临床及患者,建议重新采集。从肺部咳出的痰液一般是粘稠的,或有黏液丝。痰的性状一般分为5种①粘液痰:多见于慢性支气管炎的缓解期、支气管哮喘或肺癌病例。痰液透明、无色、粘稠,用镊子可牵拉成很长的细丝。如果其中有乳白色的颗粒状物,往往提示有肺癌的可能,尽量取这部分痰液做涂片检查。②黏液脓性痰:是在黏液痰的基础上混有一部分脓液。必须仔细挑选粘液丝的部分做检查,以提高癌细胞的检出率。③脓性痰:为黄色或黄绿色的黏液,因细菌种类的不同,痰的粘稠度和颜色可有不同。常见于气管、支气管和肺化脓性感染。其中有大量中性粒细胞和核碎片。对这种痰最好经抗感染治疗后再送检。④泡沫痰:即痰呈泡沫状,除去泡沫后,取其中的粘液丝做涂片检查。⑤血丝痰:即痰内带有少量的血液,是支气管粘膜某个局部小血管破裂出血或肺泡内出血所致。常见于肺癌或支气管结核,有时也见于支气管炎。为了明确出血的原因,应将带血丝的及其附近部分的痰全部制成涂片,进行细胞学检查。
1.1.2 痰液直接吐入痰盒或塑料杯内,容器不得污染。采痰时应采用内面涂蜡的痰盒,可防止痰液被吸收而难于挑痰制片。
1.1.3 痰标本应尽快涂片,室温下可以保存2-4小时,冰箱内可保存2天。痰液量一般以2-3口痰为宜。
1.1.4 痰液细胞学检查建议应连送3次以上,这样可明显提高痰检阳性率。
1.1.5 支气管镜活检后痰检法可明显提高痰检阳性率,其原因是由于支气管原来被肿物阻塞,活检后可能再通,脱落癌细胞也可随痰咳出;二是活检后肿瘤粘膜为一创面,癌细胞脱落机会较多,可随痰排出。
1.2 尿液细胞学标本
由于尿液往往量较大,而且稀薄,不含蛋白,细胞成分较少等原因,制片过程中容易发生细胞丢失或得不到有诊断意义的成分。为此,标本的采集及细胞收集方法是尿细胞学最关键的步骤。标本采集方法:①一般常规留尿,留取一次新鲜全尿即可。留尿前患者可适当活动,留尿后即时送检。②运用叩击肾区,按摩膀胱,按摩前列腺等处后留取全尿,促使瘤细胞脱落。③膀胱冲洗及输尿管导尿和肾盂导尿,留尿后即时送检,要特别注意分清左右侧,分别离心制片,千万不可混淆。女性病人应避免阴道分泌物的污染,最好导尿,或者留取中段或后段尿送检。
1.2.1 尿液标本检查以非晨尿的中段尿为佳,晨尿中的上皮细胞因在体内停留时间较长容易退变。
1.2.2 尿液标本要新鲜。采集后应立即送检,一般勿超过2小时,4℃冰箱可保留48h。标本中加入适量10%福尔马林或50%酒精作为防腐剂,可延长数小时到数天。
1.2.3 尿液采集量应充足,一般尿液不应少于50 ml为宜。
1.2.4 女性尿液病理检查应避开月经期。
1.2.5 对一次尿检呈阴性者,最好连续送检尿液3次以上,以提高阳性检出率。
1.2.6 因尿液中蛋白含量较少,沉淀不易粘附于载玻片上,使用胶片以防掉片。
1.3 浆膜腔积液标本
1.3.1 首先要观察标本的性状,若标本是淡黄色清澈液,则在最底部分吸取30-40 ml于清洁的干燥试管内,进行离心。若沉淀物为淡红色血性液时,底部取样离心,取沉淀后涂片;若为纯血性液如心包积液等,则在其中间部分取样。这是因为淡黄色与淡红色胸腹水的有形细胞受重力影响多沉于底部;而纯血性液中大量红细胞沉于底部,粒细胞及肿瘤细胞一般浮于红细胞上层,故取中间部分离心可提高其阳性检出率。离心后吸弃上清液,取沉淀物上面呈灰白色的细胞层制片。如看不见细胞层,轻轻吸弃上清液,仔细选取沉淀物最表面物制片;沉淀物极少,血与细胞成分混合,呈粉红色,吸弃上清液后取所有沉淀物制片。
1.3.2 积液标本送检量一般为200-500 ml较好[1]。标本送检三次以上,肿瘤细胞的检出率会明显提高[2,3]。多涂片用于多种染色有助于明确诊断。
1.3.3 标本抽吸后立即送检,且立即进行离心处理,以保持标本的新鲜性。标本无需加固定剂和防腐剂,因为经这样处理的标本离心沉淀后蛋白质凝固与载玻片的粘着度降低,染色中易掉片,尤其在免疫组化染色时更易掉片。
1.3.4 标本制作前首先观察有无凝固物质,如有凝固物,将其挑出,制成细胞蜡块。离心后的标本,如有块状、颗粒状的沉淀物,将其固定,亦制成细胞蜡块进行切片,这样可明显提高癌细胞的检出率。
1.4 女性生殖道脱落细胞
宫颈外口刮片是诊断宫颈癌的重要标本来源。
1.4.1 妇科刮片取材部位至关重要:宫颈癌多数好发于宫颈口柱状上皮和鳞状上皮交界处,因此宫颈刮片应该从宫颈口两种上皮的移形带处采集,在涂片中除有鳞状上皮细胞外,还应见到柱状上皮或化生的鳞状上皮细胞等。故要求临床妇科医生必须认真准确地取材,否则容易漏诊。在液基细胞学制片技术工作中,亦强调妇科医生要将宫颈刷深入宫颈管内口转5-8圈以上,不留死角,刷头全部进入细胞保存液。
1.4.2 细胞涂片前24h内不能同房、盆浴、阴道冲洗和药浴。器械要干净清洁;颈管刮片之前,必须严格消毒,以防感染。
2.要保证细胞学标本的制片质量
细胞学涂片质量与诊断质量密切相关。质量好的涂片是细胞学诊断的基础,其中标本的细胞数量是诊断质量的决定性因素。细胞数量必须在一定范围以上,传统涂片最低8000个或液基制片约为5000个细胞以上保存完好和形态清晰的鳞状细胞。质量好的涂片应该是:涂片厚薄适当,分布均匀,过厚的涂片相互重叠;过薄的涂片,细胞数量少,难以做出准确的诊断。涂片范围要适当,范围过大封片不全,透明不佳,镜下涂片模糊不清。范围过小细胞量少,易漏诊,一般涂面为标签以外1/3-1/2为好。
2.1 手工涂片法
手工涂片方法较多,认为对拉式涂抹方法简便,快捷,细胞分布也均匀。此法在标本采集和处理方面较原始,镜下背景污秽,细胞核结构模糊不清,且厚薄不均,细胞重叠,受检细胞稀疏。加之传统涂片面积较大,由于涂片为自然干燥,致使其不能湿性固定,细胞易变性,着色不清,观察时间较长,易产生视觉疲劳、粗心和漏诊。玻片上常有大量血细胞、黏液等杂质干扰对肿瘤细胞观察,但有时涂片的背景也有助于细胞诊断,如血性背景、脏的背景伴有高度病变时,提示有可疑病变的可能。手工涂片具有简单、成本低、易学等特点。涂片时,勿用力挤压或摩擦,防止细胞挤压损伤或变形。
2.2 液基细胞学制片法
液基细胞技术有2种即新柏氏液基薄层细胞学检查(TCT)和自动细胞学检查(LCT)[4]。目前所用的液基制片装置都是被用来制作细胞学涂片的,其在原理上有所不同。一般分为自然沉降法、膜式法、垂直离心法和水平离心法等四种。共同点是均可以将液基里的细胞标本转移到在薄片上,然后加以染色,制成涂片标本。近年应用于临床的液基细胞学检查技术有效解决了手工涂片中存在的许多弊端,如细胞丢失严重,制片质量不好,细胞常相互重叠,或被炎细胞、血细胞覆盖而难以识别。涂片也会因固定不及时,致细胞干燥、退变,影响诊断。液基细胞学制片的主要优点:变革了标本采集和处理方法,缩小了细胞涂膜面积,红细胞大多破坏消失,粘液丝溶解,炎细胞明显减少,异常细胞清楚可见,不易漏诊。细胞图像清晰,层次分明,核膜、核仁及染色质等细微结构清晰可见,三维立体感好,因此缩短了阅片时间,明显提高了工作效率,有效提升了细胞病理学诊断价值。细胞多,细胞保存液可及时并长期保存细胞,可反复多次制作涂片,方便用于免疫组化等进一步的检查。离心沉降液基技术对于细胞量少的标本作用是传统涂片不可替代的。如脑脊液、尿等细胞数量少的标本,我们利用离心沉降式液基技术能够充分保留细胞的数量。
2.3 痰液的前期处理
制片前使用痰液溶解剂对痰液进行前期处理,使痰标本液化后进行液基制片,可提高痰检阳性率。我们采用N-乙酰-L-半胱氨酸化学溶解粘液的方法制片效果很好[5],主要作用机理为断裂黏液中糖蛋白的二硫键,使蛋白质分解破坏,将粘液中的细胞游离出来。
2.4 标本中血细胞的处理方法
日常工作中常会遇到血性细胞学标本,如血尿、血性胸腹水等,因大量红细胞的存在,不但影响了癌细胞的检出,而且涂片不易制作,常致涂片在染色水洗过程中脱片,使观察结果受到限制和影响。我们经大量实验采用50%酒精做为溶血剂对血性标本进行前期处理,制片效果较好。由于红细胞对低渗的耐受性较肿瘤差,血性液体与低渗液充分混合后,红细胞即肿胀破坏溶解,因此血性胸腹水等标本经低渗浓集后无红细胞及细胞碎片,癌细胞集中,常形成大团;又由于癌细胞对低渗耐受性好,同时低渗液中的酒精对癌细胞有保护作用,因此低渗浓集后的癌细胞结构保存完好,染色清晰,结构完整,细胞多类似组织切片,加之无红细胞背景,有利于诊断与分类。
3.及时固定至关重要,是决定细胞染色质量好坏的关键
细胞学标本经制片后要及时固定,涂片及时固定染色后细胞结构清晰,胞核胞质色泽分明。涂片湿固定较佳,因为干燥的涂片会使细胞胀大变形,导致细胞核染色较差,镜下染色质结构不清晰而影响诊断。我们发现离体的脱落细胞,可以发生不同程度的退化变性,表现为细胞核的大小、形态、染色等改变,如细胞面积随时间的延长会逐渐增大,这些退变细胞很容易与肿瘤细胞相混淆。实验提示,细胞学标本送检最宜时机一般要求离体后30分完成送检、标本处理和固定,15分内完成送检、处理、固定最佳,此时脱落细胞退变程度最小。对路途较远不能及时送往者,不能及时制片、固定或不能低温保存时,可加入适量的40%甲醛或50%酒精固定,以防胸腹水变质退变。
3.1 选择良好的固定剂对提高涂片质量尤为重要。常用的固定液有95%酒精、10%福尔马林、95%酒精50毫升+乙醚50毫升+冰醋酸1毫升混合液及95%酒精100毫升+冰醋酸1毫升混合液。
95%酒精固定剂在日常工作中应用较多,但它使细胞收缩严重,核染色不良,核深染,核内结构不清,可能由于酒精穿透力强,固定速度快,同时有脱水作用引起。10%福尔马林是优良的固定液,但胸腹水中脱落的细胞本身浸泡在体液中而肿胀,涂片后直接固定,福尔马林又无脱水作用,所以用它固定的涂片染色后细胞肿胀,核浆模糊,结构模糊,胞浆深染,核显示不清,当细胞密集时更为突出。乙醚可溶解脂肪,使细胞容易着色,当与酒精混合时,延缓了酒精的快速穿透作用,克服了单独用酒精固定时细胞收缩的缺点,具有固定兼脱水作用,使细胞固定后染色更加清晰。95%酒精冰醋酸混合液与95%酒精和10%福尔马林比较,它使细胞结构清晰,核浆分明,特别是核仁核膜尤为清楚,该混合固定液中,冰醋酸能沉淀核蛋白,使细胞膨胀,能抵消经过酒精固定引起细胞核的收缩,具有固定兼脱水作用。我们经实际应用认为,95%酒精冰醋酸混合液和酒精乙醚冰醋酸混合固定液是胸腹水等细胞涂片的优良固定剂。
3.2 固定液要定期进行过滤和更换,以防细胞脱落造成交叉污染。
4.要正确选择染色方法
细胞学染色方法较多,许多医院习惯应用HE染色,巴氏染色并不很普及。在宫颈涂片方面国内外推荐使用巴氏染色,它是细胞学唯一的正规染色方法。
4.1 重视染液的使用期限
配制后的染液,如苏木素、伊红、EA50染液等,在染缸上要标记上配制时间,以保证染液的新鲜度及控制好染色时间。
4.2 避免染液交叉污染
因细胞学标本容易脱落,最好染液每天用前过滤,以避免染液内残留细胞粘附于玻片上,造成污染。
5.封片
5.1 染色后的涂片必须封片
其目的是使涂片长期保存,镜下细胞的微细结构清晰,且便于诊断时在涂上做标记,减少读片时的空气污染。
5.2 避免盖玻片的污染
被霉菌污染的盖玻片,要禁止使用,以防造成误诊。
6.阅片要耐心细致
细致阅片是诊断的关键。由于脱落细胞学是在大量正常的细胞中寻找数量相对较少的异常细胞或癌细胞,有时癌细胞数量很少或只局限于涂片的某一区域,因此观察涂片必须全面细致、耐心,不漏掉一个视野,不放过一个可疑的细胞。由于薄层制片方法与传统涂片方法及原理有所不同,液基法是先固定后涂片,致使细胞收缩变小,镜下细胞形态也有差异,在阅片时要注意二者区别。
7.加强学习,不断总结经验,提高细胞学诊断的准确性
由于细胞学本身的局限性,缺乏组织结构的改变,因此,细胞学工作者必须对各器官、各系统的各种正常细胞、良性病变细胞、放疗后细胞的形态变化有全面深刻的了解,才能做出准确的判断。在遇到疑难病例难以确诊时,应重复检查,进行动态观察,亦可建议做病理活检,最后确定诊断。遇到下列情况应重复检查:①细胞学诊断与临床诊断明显不符合的病例。②涂片中只有少数异常细胞,难以做出结论性诊断的病例。③标本中细胞坏死或变性严重,难以肯定诊断或分型的病例。④取材不当或制片技术不佳涂片。
8.重视各种检测技术的联合应用
常规HE染色是细胞学诊断的基础,但对分化较差的肿瘤细胞,由于细胞的特征不明显,常规染色往往很难判断。遇到疑难病例建议借助如特殊染色、免疫组化、电镜及分子生物学等技术,最后做出明确诊断。
[1]张树平,李立宏.浆膜腔积液细胞学检查质量控制.河北北方学院学报,2010,27(1):73
[2]樊英,李龙芸.良恶性胸腔积液的鉴别诊断.癌症进展杂志,2005,3(2):134-136
[3]李桂宾,孙玉红,高颖.良恶性胸水的实验室检查新进展.临床肺科杂志,2005,10(3):361-362
[4]王庆国,叶见波,韦荣干.液基细胞学技术在宫颈癌病变筛查中效果的研究进展.广西医学,2005,27(11):1800-1802
[5]娄铮,吕纯凯.影响结核分枝杆菌涂片镜检和培养结果的几项重要因素.上海医学检验杂志,2000,15(1):60
图 版 说 明
图1 血性胸水标本:经溶血剂处理后,背景较干净,癌细胞结构显示清楚 ×400.
图2 痰标本:经粘液溶解剂处理后,背景较干净,癌细胞结构显示清晰 ×200.
EXPLANATION OF FIGURES
Fig.1 Bloody hydrothorax speci men:Hemolysis agent treatment,clear background,str ucture of cancer cell were clarity×400
Fig.2 Sputu m speci men:Mucus dissolve agent treat ment,clear background,structure of cancer cell were clarity×200
361
B
10.3870/zgzzhx.2012.04.023
2012-02-10
2012-04-01
田玉旺,男(1962年),汉族,主任技师。
