化学镀镍规律及机理探讨
2012-12-07谢洪波陈华三张来祥
谢洪波, 江 冰, 陈华三, 张来祥
(1.青岛大学 应用技术学院,山东 青岛 266061;2.青岛市环境保护科学研究院,山东 青岛266003;3.中国电子科技集团43所,安徽合肥 230022)
化学镀镍规律及机理探讨
谢洪波1, 江 冰2, 陈华三3, 张来祥1
(1.青岛大学 应用技术学院,山东 青岛 266061;2.青岛市环境保护科学研究院,山东 青岛266003;3.中国电子科技集团43所,安徽合肥 230022)
基于化学反应所遵循的物质守恒原理,在已知主要反应物、生成物条件下,利用化学方程式配平法,探讨了不同条件下化学镀镍的基本规律,首次提出了与目前经典化学镀镍理论不同的反应方程式;在此基础上找出了次磷酸利用率规律;利用P—H键断裂理论分析探讨了化学镀镍溶液成分及工艺条件,如稳定剂、pH、装载量、加速剂及络合剂等对化学镀镍的影响机理;总结提出了提高化学镀镍速度的措施。
化学镀镍;次磷酸钠利用率;反应方程式;化学镀镍机理;反应速度
引 言
化学镀镍问世以来,有关反应机理问题就一直进行着研究探讨。但由于化学镀镍机理的复杂性、还原剂氧化过程、中间态粒子的复杂和难以检测等问题,化学镀镍的机理一直无法获得定论,只是根据少量、局部实验结果进行推测[1]。鉴于理论对于实践具有重要指导意义,持续不断的开展化学镀镍机理研究很有必要。本文将利用化学反应式初步探讨化学镀镍的原理及规律;找出次磷酸的利用率规律;总结阐述化学镀镍的基本规律,并利用P—H键断裂机理分析探讨化学镀镍机理,进而提出提高化学镀镍速度的措施。
1 确定化学反应方程式
化学镀镍经典理论中引用了如下(或无配合剂)的反应方程式:

根据这个反应方程式,金属镍离子、次磷酸钠消耗量以及镀层中磷含量是一定的。这显然与实验结果和生产现实不符。因此,化学反应式应该是由不同工艺条件,不同反应消耗物和Ni-P合金镀层磷的质量分数确定的。化学反应方程式是化学科学中一项基础原理。
虽然现代科技飞速发展,各类尖精端科研仪器不断用于化学镀镍研究,但这项从本质上反映宇宙基本规律—物质不灭定律的化学反应式所具有的价值仍不能忽略。化学反应物的消耗与生成物的产出两者存在着必然的联系,测量化学镀镍生产中反应物的减少及生成物的增加,在目前研究条件下是比较容易实现的。因此,在不同工艺条件下,根据测试结果或生产消耗数据,确定化学反应中主要反应物和生成物,化学反应方程式两端配平后,可以找出化学镀镍的一些规律。
1.1 确定反应方程式应考虑的因素
1)主要反应物。首先是化学镀镍投料比。化学镀镍工艺配方中,n(镍盐)∶n(次磷酸钠)一般在0.25~0.60之间。生产中的控制方法是通过分析镍离子含量,次磷酸钠按一定比例添加。因此,确定化学镀镍反应方程式时,n(镍盐)∶n(次磷酸钠)应该是已知条件。
2)主要生成物。化学镀镍镀层磷的质量分数为1% ~16%,相当于磷的摩尔分数3% ~50%。在这个范围中数个典型摩尔比值进行化学方程式配平。
3)增减反应式两端水分子数量。反应式两端镍、磷确定后,增减反应式两端水分子数量,水、氧和氢可根据计算确定。
1.2 化学镀镍反应方程式
n(镍盐)∶n(次磷酸根)分别取 1∶3 和 1∶2。镀层中磷的质量分数在1%~15%。据此在不同情况下配平化学镀镍反应方程式。
1.2.1 n(镍盐)∶n(次磷酸根)为 1∶3
1)镀层中磷的摩尔分数为33%时(磷质量分数为 10.6%):
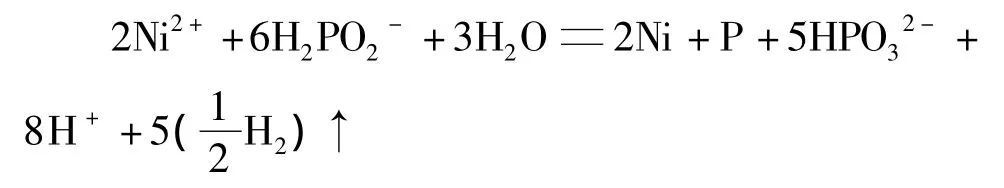
2)镀层中磷的摩尔分数为16.7%时(磷质量分数为 5.3%):

3)镀层中磷的摩尔分数为9.1%(磷质量分数为 3.2%)时:
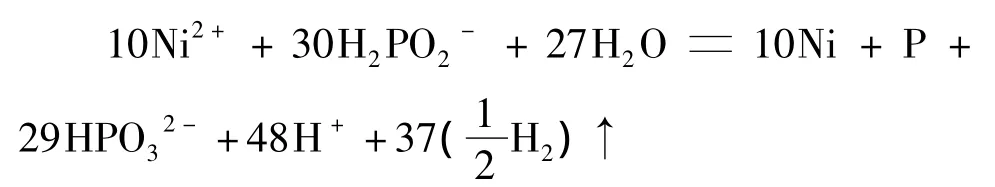
4)镀层中磷的摩尔分数为4.8%时(磷质量分数为 1.6%):

1.2.2 n(镍盐)∶n(次磷酸根)为 1∶2
1)镀层中磷的摩尔分数为33%时(磷质量分数为 10.6%):
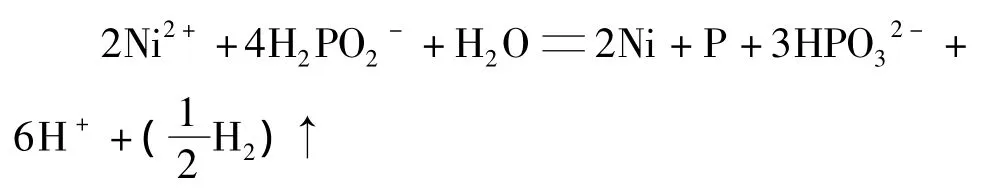
2)镀层中磷的摩尔分数为16.7%时(磷质量分数为 5.3%):
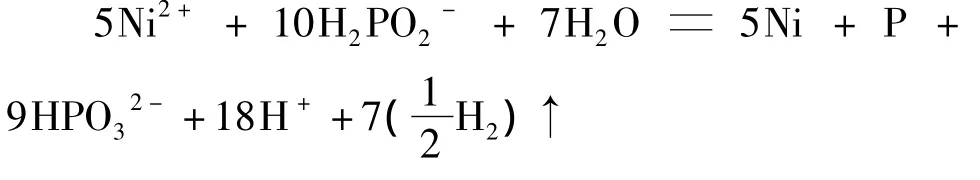
3)镀层中磷的摩尔分数为9.1%(磷质量分数为 3.2%)时:
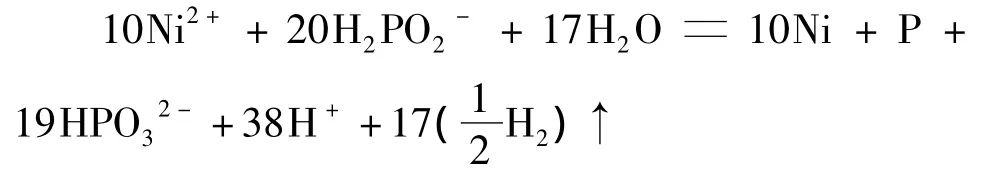
4)镀层中磷的摩尔分数为4.8%时(磷质量分数为 1.6%):
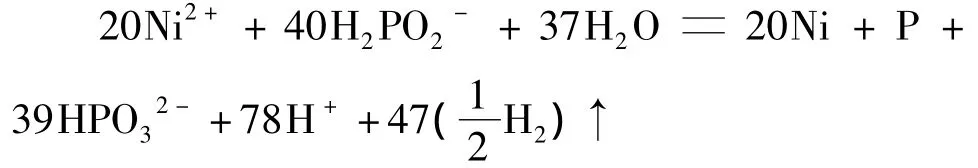
2 探讨次磷酸的利用率规律
2.1 次磷酸钠利用率定义
次磷酸还原镍离子的同时,部分单质磷与镍共沉积,同时产生氢气。化学镀镍中镀层的有效成分是金属镍及磷。因此,次磷酸钠利用率可以根据产生的镍及磷的总质量进行计算,定义式如下:
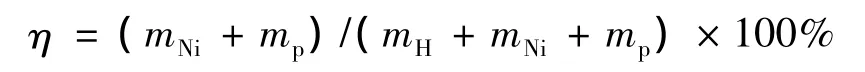
式中:η为次磷酸钠利用率,%;mNi为反应方程式金属镍摩尔质量;mp为反应方程式单质磷摩尔质量;mH为反应方程式氢气摩尔质量。
2.2 次磷酸钠利用率规律探讨
根据化学镀镍反应方程式和次磷酸的利用率定义式,可计算出次磷酸利用率如表1所示:
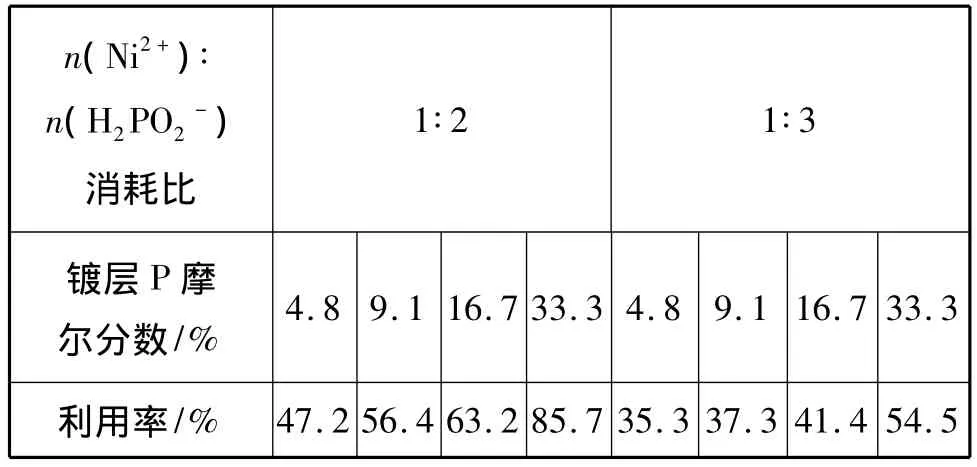
表1 次磷酸利用率
分析其数据可发现如下规律:
1)镀液中n(镍盐)∶n(次磷酸钠)高时,次磷酸钠利用率也高。n(镍盐)∶n(次磷酸钠)为1∶2时,次磷酸利用率最高可达 85.7%。n(镍盐)∶n(次磷酸钠)为1∶3时,次磷酸利用率最高才达54.5%。
2)次磷酸钠利用率随镀层磷的质量分数升高而提高。n(镍盐)∶n(次磷酸钠)为1∶2及1∶3时均如此。
3 化学镀镍规律及解释
3.1 现有化学镀镍机理[2]
1)原子氢析出机理。原子氢析出机理是1946年提出的,核心是还原镍的物质是原子氢,其反应过程如下:
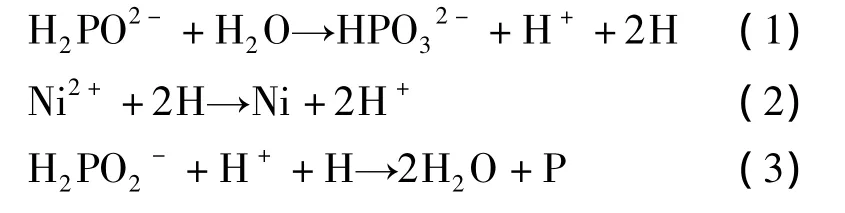

水和次磷酸根反应产生了吸附在催化表面上的原子氢,吸附氢在催化表面上还原镍离子。同时,吸附氢在催化表面上也产生磷的还原过程。原子态的氢相互结合也析出氢气。
2)电子还原机理(电化学理论)。电子还原机理反应过程如下:
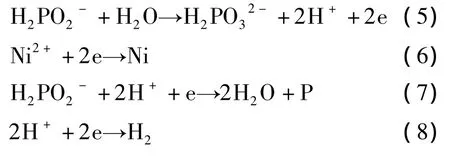
酸性溶液中,次磷酸根与水反应产生的电子使镍离子还原成金属镍。在此过程中电子也同时使少部分磷得到还原。
3)正负氢离子机理。该理论最大特点在于,次磷酸根离子与磷相连的氢离解产生还原性非常强的负氢离子,还原镍离子、次磷酸根后自身分解为氢气。
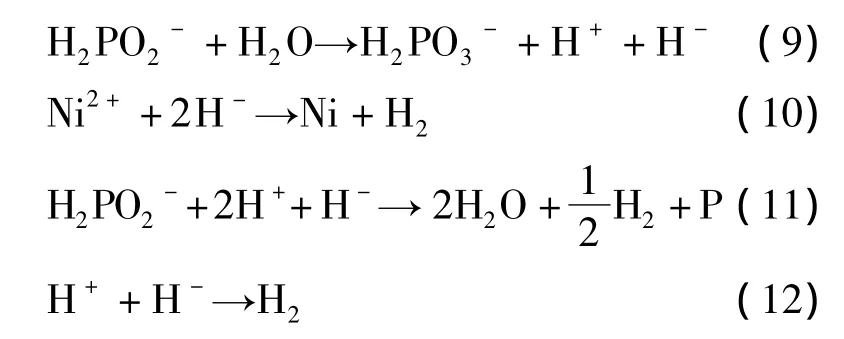
此后也有人提出了反应历程经历氢氧化镍为过渡体的理论,但究其实质,应属于原子氢析出机理的范畴,就不再详细介绍。
分析上述机理,可以发现核心在于次磷酸根的P—H键。次磷酸根的空间结构是以磷为中心的空间四面体。空间四面体的4个角顶分别被氧原子和氢原子占据,其分子结构式为:[3]。

各种化学镀镍反应机理中共同点是P—H键的断裂。P—H键吸附在金属镍表面的活性点上,在镍的催化作用下,P—H键发生断裂。如果次磷酸根的两个P—H键同时被吸附在镍表面的活性点上,键的断裂难以发生,只会造成亚磷酸盐缓慢生成。对于P—H键断裂后,P—H间共用电子对的去向,各种理论具有不同的解释。如电子在磷、氢之间平均分配,这就是原子氢析出理论;如果电子都转移至氢,则属于正负氢理论;而电子还原机理则认为电子自由游离出来参与还原反应。因此,可以根据化学镀镍机理的核心对各种宏观工艺问题进行分析解释。
3.2 金属的催化作用
化学镀镍的基体金属材料分为有催化活性和无催化活性两类。前者为元素周期表中的第八副族铁系元素,如镍、钌、铑、钯、锇、铱和铂等。本身无催化作用的材料需在表面沉积有催化活性的金属核。催化核的形成可通过置换反应获得,如锌、铝、铍和钛等;另一些金属如铜、银、金和碳,可以通过与一些比镍活泼的金属接触,利用原电池原理获得金属催化核。钴仅在碱性溶液中具有催化活性。
基体金属材料对次磷酸根氧化催化理论尚不明确。但根据P—H键断裂机理,可以认为是由于不同金属对于氢的吸附能力不同。吸附能力强,P—H键断裂的几率高,则金属具有的催化活性就好。金属对于P—H键吸附能力强弱的机理尚需进一步研究。如果能找到可以提高吸附能力的物质,对于提高化学镀镍发展无疑具有重大意义。
3.3 络合剂的影响
络合剂在化学镀镍溶液中络合镍离子,避免产生亚磷酸镍沉淀。从络合理论而言,络合剂的加入增加了镍离子的稳定性,使得镍离子难以被还原,化学镀镍的沉积速度应该降低。但实验研究及生产实践都证实,化学镀镍溶液中存在少量络合剂时,化学镀速度随着络合剂浓度的提高而增加,镀速与浓度的变化曲线存在一个最大值,达到最大值以后,络合剂浓度继续提高,传统经典理论解释为[3]:其一,浓度低时,络合剂在催化表面上吸附量少,加速了沉积反应。浓度高时,因吸附量增大,毒化了反应。其二,络合剂的金属离子缓冲行为加速了反应。认为镍离子不饱和络合时才出现最大速率。由于部分络合的镍离子保留着游离的水化镍离子的某些特性,在浓度达到最大镀速以前,缓冲作用是各络合剂的主要作用。达到最大值后速度随浓度提高而降低的原因则是由于游离镍离子减小的缘故。络合剂影响沉积速度的原因是络合物的稳定常数不同,游离镍离子浓度的不同造成的。
根据P—H键断裂机理,可以对这个现象另作解释,化学镀镍络合剂分子结构中含有大量羧基、羟基等含氧成分。一方面由于氧的电负性较强,水溶液中氢可以与之形成缔合键。缔合键的形成降低了P—H键间的稳定性,使之易于开裂,从而加速了镍的沉积速度。另一方面,高含量络合剂镍络合物的稳定性提高,镍离子的还原难以进行。两种趋向进行竞争,络合剂少的时候,P—H键的活性为主,化学镀镍反应加速;络合剂过高时络合效应主导,镍沉积速度降低。
3.4 加速剂的影响
化学镀镍溶液中的络合剂和稳定剂往往会使沉积速率下降,因此常在镀液中添加少量的能提高沉积速率的物质,即所谓促进剂,也称为加速剂,氨基羧酸类,如α氨基丙酸、α氨基丁酸、天冬氨酸;羧酸及羟基羧酸类,如丁二酸,苹果酸、乳酸或琥珀酸等;氟离子,如氟化钠也应具有加速作用。
同样可以根据P—H键断裂机理,解释少量加速剂可提高沉积速度;过量则由于络合作用降低沉积速度。但对于无络合能力的氟离子,由于其具有强电负性,同样可以作用于P—H键,减弱次磷酸盐分子中氢和磷原子之间稳定性,活化次磷酸根离子,由于无络合性,过量氟离子不会降低反应速度,这与实验数据相一致[4]。
3.5 装载量的影响
装载量对镀层磷含量有非常显著的影响。载量提高,镀速下降,镀层磷含量提高。装载量提高到一定值后,磷含量增长变慢,镀液更容易自分解。
根据P—H键断裂机理作如下解释:随着装载量的提高,催化金属表面积增大,形成单P—H键吸附的几率增多,次磷酸根分解加快。但溶液中镍离子浓度不变,因此,分解的次磷酸根还原成单质磷的机会也增多,镀层磷含量提高。由于零件总面积大,单位表面积所接触的镍离子数量减少,因此反应速度降低。
3.6 pH 的影响
酸性化学镀镍中,镀层沉积速度随溶液pH升高而提高;磷含量随溶液pH升高而降低,次磷酸盐利用率随pH变大而增加。
从络合角度而言,溶液pH升高,络合剂对镍离子的络合能力提高,镍离子更难于沉积,反应速度应该降低,磷含量应该提高。这显然与实验及生产结论截然相反。但从P—H键断裂角度分析可得出,酸度高,具有正电荷的氢离子在活性金属表面吸附,对镍离子产生排斥作用导致镍的还原困难;反之,pH高,氢离子浓度降低,对镍离子的排斥作用小,金属表面具有更多的镍离子,更利于P—H键断裂后产生的活性还原物质对镍的还原沉积,因此反应速度提高,次磷酸的利用率也提高。镍的顺利还原降低了单质磷的还原速率,镀层磷含量相应降低。
但随着pH的不断提高,沉积速度和镀层磷含量变化趋于平缓。如资料[2]表明,pH 在 4.0 ~5.0范围内沉积速度增加了90% ~120%,而 pH在5.0~6.0范围内,沉积速度只增加了10% ~20%。这可用镍离子的络合效应与P—H键活性竞争加以解释。pH过高时,镍离子浓度已增加到了极限,而络合剂的络合性则随pH的提高不断增强。高pH下络合效应占主导,沉积速度增加缓慢。
3.7 稳定剂的影响
化学镀镍溶液在受到污染、存在催化活性的固体颗粒、装载量过大或过小及pH过高等异常情况均会导致溶液非催化分解。分解初期产生的大量金属镍的微粒又会导致溶液快速催化分解,使镀液在很短时间即失效。判断化学镀镍溶液稳定剂有效性的方法是将含有稳定剂的化学镀镍溶液加热到工作温度,向其中加入100 mg/L的氯化钯溶液1~2 mL,测量生成黑色沉淀的时间,根据时间来判断其稳定性,如果超过60 s,则认为它是稳定的。
稳定剂一般分四类[3],主要是不饱和有机酸,如马来酸、甲叉丁二酸等;无机含氧酸根,如钼酸、碘酸或亚砷酸根等;重金属离子,如镉、铅等;第六主族负二价离子,如硫、硒等。稳定剂用量一般在0.1mg/L 以上。
稳定剂对于化学镀镍的影响是当含量较低时提高反应速度,降低镀层磷含量;含量过高影响反应速度,以至于反应停滞。目前的吸附理论只能解释具有稳定作用的原因,但对于可以提高沉积速率的解释过于牵强,尚无法根据P—H键机理解释稳定剂的影响规律。
3.8 提高化学镀镍反应速度的措施
综上所述,采取如下措施可以提高化学镀镍反应速度[5]:
1)采用合适的络合剂。一是络合剂浓度要保持在某一适宜数值;二是采取混合配体。羧酸及其同系的醇酸(如苹果酸和琥珀酸、乳酸和丙酸)作为混合配体,可得到稳定的镍离子多齿混合配体。而多齿混合配体在镍离子被还原的过程中,可以避免单一配体在镍离子解离过程中须逐级放电才加速反应的进行。因此,尽管混合配体的镍稳定常数大,但是它却同时具有提高镍离子的还原速度的作用。此外,利用醇酸含有两个或两个以上能参与氢键形成的官能团,降低P—H键在镍的强烈吸附下均裂所需要的能量,加快P—H均裂的速度,加速初生态氢的生成,提高镍离子沉积速度。
2)添加适当种类的稀土。稀土具有特殊的电子结构,可以在一定的化学镀镍络合体系下,与镀镍液中的羧基氧原子形成双齿桥联配体。如镧离子和铈离子的5d轨道为空轨道且能量又与4f轨道接近,所以易于接受初生态氢释放的自由电子;离子接受电子后能级升高,会尽快地通过双齿桥联配体将电子传递给镍离子。由于电子的桥传递,电极反应的活化能显著降低,加快了镍的沉积速度。添加适当种类和剂量的稀土,可增加催化表面的活性点数目,提高镍离子的沉积速度。当催化表面的活性点数目增加到一定程度时,继续增加稀土的含量,催化活性点的数目不再增加;此时过量的稀土反而阻止次磷酸根离子的吸附,降低沉积速度。
3)加入适量的促进剂。加人适量的促进剂,如电负性大的氟离子或含有多个能参与氢键形成的官能团的有机酸,如丁二酸、苹果酸及乳酸等,降低P—H键在镍的吸附下开裂所需要的能量,增大镀层沉积速度。
4)添加适量的表面活性剂。可增加镍表面的浸润性,促使氢气较快地离开镍层表面,提高反应速度,同时也降低镀层的孔隙率。但表面活性剂分子会阻碍次磷酸根离子在镍表面的吸附,抑制阴极反应。因此,镀液中表面活性剂不可添加过量。
5)镀前预浸。钢铁制件活化后在pH为9~11的热稀氨水或碳酸钾溶液中预浸,可增加镍核生成数,增大镀层的致密度。
4 结论
1)针对经典化学镀镍理论反应方程式的不足,完善了不同的工艺条件下的化学镀镍反应方程式。
2)利用化学反应方程式对化学镀镍次磷酸钠利用率进行了分析探讨,找出了其中的规律。
3)阐述了络合剂、加速剂、pH及装载量等对于化学镀镍影响规律,并根据P—H键断裂机理对其进行了分析解释。
4)根据机理提出了提高化学镀镍速度的措施。
本文撰写时试图利用P—H键断裂机理对稳定剂对化学镀镍的影响规律作出合理解释,但未果。尚需以后继续努力。也希望电镀同仁共同研究,合作探讨。
[1]刘永健,王印培.次亚磷酸钠体系化学镀镍沉积机理探讨[J].华东理工大学学报,2001,27(3):301-306.
[2]王美媛,旷亚非.次亚磷酸钠体系化学镀镍的研究进展[J].腐蚀与防护,1999,20(12):534-535.
[3]李宁,袁国伟,黎德育.化学镀镍基合金理论[M].哈尔滨:哈尔滨工业大学出版社,2000:5.
[4]韩克平,方景礼.氟离子对化学镀镍的加速机理[J].电镀与环保,1996,16(3):21-23.
[5]孙景庄,薛惠如.提高化学镀镍层含磷量的研究[J].电镀与环保,1995,15(3):1-4.
Discussion on the Mechanism of Electroless Nickel Plating
XIE Hong-bo1,JIANG Bing2,CHEN Hua-san3,ZHANG Lai-xiang1
(1.School of Applied Science and Technology,Qingdao University,Qingdao 266061,China;2.Qingdao Institute of Environmental Science,Qingdao 266003,China;3.No.43 Research Institute,China Electronic Science and Technology Group Company,Hefei 230022,China)
With the known reactant and resultant,the basic mechanism on electroless nickel plating under different conditions was discussed by using chemical equations based on the law of mass conservation.The new reaction equation different from classic theory of electroless nickel plating was proposed.And then the efficiency behavior of sodium pypophosphite was found.The effect of electrolyte composition and plating parameters such as stabilizer,pH value,loadage,promoter and complexing agent on the mechanism was discussed by P—H chemical bond breaking theory.Finally the solutions on improving the rate of nickel plating were put forward.
electroless nickel plating;efficiency of sodium pypophosphite;chemical equations;nickel plating mechanism;rate of reaction
TQ153.12
B
1001-3849(2012)02-0026-05
2011-04-06
2011-08-21
