阿托伐他汀对内皮细胞微粒诱导的人脐静脉内皮细胞ERK、p38MAPK、NF-κB p65蛋白及ICAM-1mRNA表达的影响*
2012-12-07陆永光符春晖陈湘桂黄军章陈丽媛
陆永光,符春晖,严 华,陈湘桂,黄军章,陈丽媛
钦州市第二人民医院心内科钦州 535099
△男,1977年10月生,博士,副主任医师,研究方向:冠心病的诊治,E-mail:evershine_lu@hotmail.com
阿托伐他汀对内皮细胞微粒诱导的人脐静脉内皮细胞ERK、p38MAPK、NF-κB p65蛋白及ICAM-1mRNA表达的影响*
陆永光△,符春晖,严 华,陈湘桂,黄军章,陈丽媛
钦州市第二人民医院心内科钦州 535099
△男,1977年10月生,博士,副主任医师,研究方向:冠心病的诊治,E-mail:evershine_lu@hotmail.com
内皮细胞微粒;脐静脉内皮细胞;丝裂素活化蛋白激酶;细胞间黏附分子-1;阿托伐他汀
目的:探讨阿托伐他汀干预对内皮细胞微粒(EMPs)诱导的人脐静脉内皮细胞(HUVEC)ERK/MAPK和NF-κB信号通路及细胞间黏附分子-1(ICAM-1)表达的影响。方法:将体外培养的HUVEC细胞系ECV-304分组培养:①EMPs不同作用时间组用EMPs(终浓度105mL-1)分别刺激细胞0、3、6、12和24 h。②EMPs不同作用剂量组分别用终浓度为0、102、103、104及105mL-1的EMPs刺激细胞24 h。③抑制剂预处理组在EMPs刺激前,分别用ERK、p38MAPK及NF-κB抑制剂PD98059、SB203580、PDTC进行预处理。④阿托伐他汀预处理组在EMPs刺激前,用阿托伐他汀进行预处理。然后,用实时荧光定量PCR测定细胞中ICAM-1 mRNA的表达,Western blot法测定磷酸化ERK(p-ERK)、p-p38MAPK、NF-κB p65蛋白的表达。结果:随EMPs作用时间的延长和作用剂量的增加,细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达均逐渐增加(P均<0.001)。用上述抑制剂及阿托伐他汀预处理后,EMPs诱导的细胞ICAM-1 mRNA表达均降低(P<0.05)。结论:阿托伐他汀可能通过ERK/MAPK和NF-κB信号通路下调EMPs诱导的内皮细胞ICAM-1的表达。
内皮细胞微粒(endothelial microparticles, EMPs)是内皮细胞激活、损伤或凋亡后从细胞膜释放出来的小微粒[1]。近年来研究[2]表明,EMPs不仅可以作为内皮损伤和功能障碍的标志物,而且携带有大量的生物活性物质,可以发挥明显的生物学效应。细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)主要由内皮细胞合成和分泌,在介导单核细胞等炎性细胞黏附于内皮细胞并进入内膜的过程中发挥重要作用[3]。ERK/MAPK和NF-κB是介导内皮细胞炎性反应和炎性因子表达的重要信号转导通路[4]。阿托伐他汀除了具有调脂作用外,还具有抑制内皮炎症,保护内皮细胞的作用[5]。作者用阿托伐他汀干预EMPs诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC),观察ERK、p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA表达的变化。
1 材料与方法
1.1 材料 HUVEC细胞系ECV-304(美国ATCC公司);胎牛血清及RPMI 1640培养基(美国Gibco公司);TNF-α(英国PeProtech公司);异氰酸荧光素(FITC)标记的CD42单克隆抗体、藻红蛋白(PE)标记的CD31单克隆抗体(美国Proteintech Group公司);0.8、3.0 μm标准微粒(美国Duke公司);阿托伐他汀(美国辉瑞公司);ERK抑制剂PD98059、p38MAPK抑制剂SB203580、NF-κB抑制剂二硫代氨基甲酸吡咯烷(PDTC)(美国Sigma公司);PCR引物(上海生工生物工程有限公司);第一链cDNA合成试剂盒、All-in-OneTMQ-PCR Mix(美国GeneCopoeia公司);核蛋白提取试剂盒、ECL化学发光试剂盒(美国Pierce公司);辣根过氧化酶(HRP)标记羊抗兔IgG和DAB染色试剂盒(丹麦DAKO公司);兔抗人磷酸化ERK(p-ERK)、磷酸化p38MAPK(pp38MAPK)单克隆抗体,兔抗人ERK、p38MAPK、NF-κB p65单克隆抗体和兔抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(美国Santa Cruz公司)。
1.2 EMPs的制备及鉴定 参照Terrisse等[6]的方法,在37℃下,用终质量浓度为100 μg/L的TNF-α与ECV-304共孵育48 h,制备EMPs。取制备好的EMPs样品100 μL分成2管,一管加入FITC标记CD42单克隆抗体和PE标记CD31单克隆抗体各10 μL,另一管加入等量的对照抗体,在室温下孵育15 min,洗涤2次后,加入100 μL PBS后上流式细胞仪检测。用0.8 μm的标准微粒设门,以3 μm标准微粒对EMPs进行定量。上流式细胞仪前,样品中分别加入105个0.8 μm和3.0 μm标准微粒,测定直径0.8~3.0 μm的细胞膜微粒,当收集到2×104个3 μm标准微粒后即停止计数,并以此作为参照标准计算EMPs浓度。EMPs定义为直径<1.0 μm且CD31+/CD42-的微粒。
1.3 ECV-304的培养及实验分组 用含体积分数10%胎牛血清、青霉素100 kU/L、链霉素100 kU/L的RPMI 1640培养基,在37℃、体积分数5%CO2条件下培养ECV-304,待细胞生长达亚融合状态时,用2.5 g/L胰蛋白酶消化、传代,取2~5代增殖旺盛的细胞,用含体积分数10%胎牛血清的RPMI 1640培养基调整为105mL-1的细胞悬液,接种于24孔板,待细胞生长至对数生长期时,用无血清培养基培养24 h,使其同步化,随后按以下分组进行干预。①EMPs不同作用时间组:用EMPs(终浓度105mL-1)分别刺激细胞0、3、6、12、24 h。②EMPs不同作用剂量组:分别用终浓度为0、102、103、104、105mL-1的EMPs刺激细胞24 h。③抑制剂预处理组:在EMPs刺激前,分别将细胞与PD98059(终浓度为10 μmol/L)、SB203580(终浓度为10 μmol/L)和PDTC(终浓度为10 μmol/L)共同孵育30 min。④阿托伐他汀预处理组:在EMPs刺激前,用阿托伐他汀(终浓度为10 μmol/L)孵育细胞30 min。
1.4 观测指标
1.4.1 p-ERK、p-p38 MAPK、NF-κB p65蛋白的Western blot检测 收集上述各组细胞,采用Bradford法进行蛋白定量,电泳和转膜后封闭2 h,滴加一抗(按500倍稀释),4℃孵育过夜,然后加相应的二抗(按5 000倍稀释),室温下孵1 h。ECL化学发光显影、曝光。用图像分析系统进行图像扫描及灰度分析。用p-ERK或p38MAPK与同管内参照总ERK或 p38MAPK灰度值的比值表示 p-ERK或 pp38MAPK的相对表达量,用NF-κB p65与同管内参照PCNA条带灰度值的比值表示NF-κB p65的相对表达量。
1.4.2 ICAM-1 mRNA的Real Time-PCR检测 收集各组细胞,Trizol一步法提取总RNA,按试剂盒说明进行逆转录反应得 cDNA,以此为模板,进行PCR。引物序列:ICAM-1上游为5’-CCGGAAGGT GTATGAACTG-3’,下游为5’-TCCATGGTGATCTCT CCTC-3’;β-actin上游为5’-TGACGTGGACATCCG CAAAG-3’,下游为5’-CTGGAAGGTGGACAGCGA GG-3’。PCR反应体系20 μL:2×All-in-OneTMQPCR Mix 10 μL,上、下游引物各2 μL,cDNA 2 μL,ddH2O 4 μL。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火20 s,72℃延伸31 s;40个循环。反应结束后进行扩增曲线和熔解曲线分析,采用2-ΔΔCt法计算 ICAM-1 mRNA表达量,ΔΔCt= (Ct目的基因- Ct内参基因)实验组- (Ct目的基因-Ct内参基因)对照组。
1.5 统计学处理 用SPSS 13.0处理数据。EMPs不同作用时间、不同作用剂量各组p-ERK、p-p38 MAPIL、NF-κB p65蛋白及ICAM-1 mRNA相对表达量组间比较方差不齐,采用Kruskal-Wallis秩和检验,两两比较采用Bonferroni法;采用析因设计的方差分析评价抑制剂预处理对EMPs诱导的ECV304细胞以及阿托伐他汀对EMPs诱导的HUVECs细胞ICAM-1 mRNA表达的影响,检验水准α=0.05。
2 结果
2.1 EMPs作用不同时间 ECV-304细胞中 p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达 见图1和表1。可以看出,随EMPs作用时间的延长,ECV-304细胞 p-ERK、pp38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达均逐渐增加。
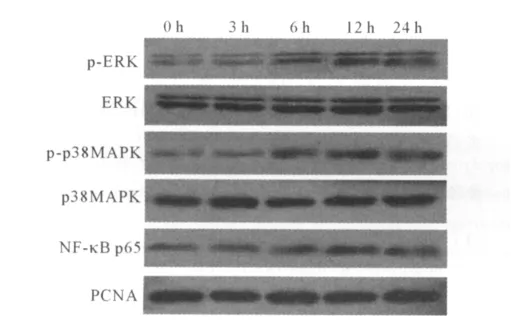
图1 EMPs作用不同时间后ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白Western blot电泳图
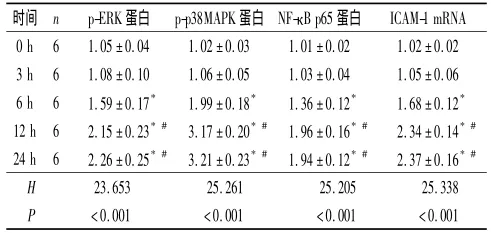
表1 EMPs作用不同时间后ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达
2.2 不同剂量EMPs作用后ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达 见图2和表2。可以看出,随EMPs剂量的增加,ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达均逐渐增加。
2.3 抑制剂对 EMPs诱导的 ECV-304细胞ICAM-1 mRNA表达的影响 ERK、p38MAPK和NF-κB抑制剂显著下调ECV-304细胞ICAM-1 mRNA的表达,见表3。

图2 不同剂量EMPs作用后ECV-304细胞p-ERK、p-p38MAPK及NF-κB p65蛋白的表达

表2 EMPs不同剂量作用后ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA的表达
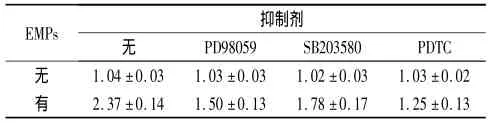
表3 抑制剂预处理后EMPs诱导的ECV-304细胞ICAM-1 mRNA的表达(n=6)
2.4 阿托伐他汀对EMPs诱导的ECV-304细胞p-ERK、p-p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA表达的影响 见表4。可以看出,10 μmol/L阿托伐他汀可显著抑制EMPs诱导的ECV-304细胞p-ERK、p-p38MAPK和NF-κB p65蛋白及ICAM-1 mRNA的表达。
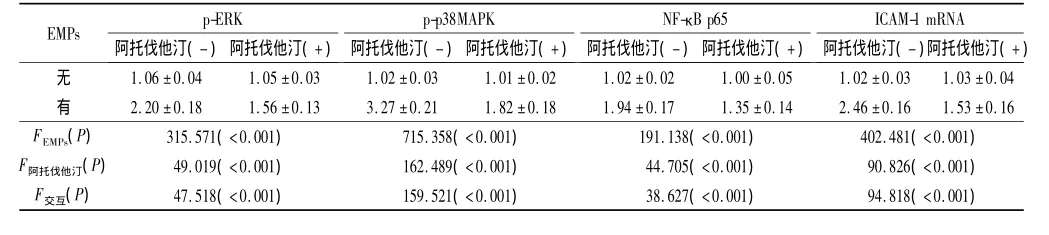
表4 阿托伐他汀预处理后EMPs诱导的ECV-304细胞ICAM-1 mRNA的表达(n=6)
3 讨论
EMPs是血管内皮细胞在各种刺激作用下激活或凋亡后释放的小囊泡[1]。在动脉粥样硬化血栓形成疾病中,EMPs可以作为血管损伤的标志物,是心血管疾病死亡率和主要不良心血管事件的潜在预测指标[7]。更为重要的是,EMPs表面携带有起源细胞的膜蛋白类和磷脂类物质,具有一定的内皮细胞抗原特性,因此EMPs也是一种生物活性物质和信息携带体,可发挥生物效应和参与细胞信号的转导[8]。研究[9]表明,EMPs通过抑制NO的合成,损害血流介导性血管扩张,增加脉搏波速度。此外,EMPs也可以促进局部细胞凋亡,导致新的EMPs的形成和释放,从而导致恶性循环。
动脉粥样硬化是慢性炎性和免疫性疾病,单核细胞等炎性细胞通过黏附分子的介导,黏附于内皮细胞并进入动脉内膜,是动脉粥样硬化形成的始动环节。ICAM-1则是这些黏附分子中最重要的一种。EMPs不但可以作为动脉粥样硬化内皮功能障碍的标志物,还可进一步导致内皮损伤,上调黏附分子的表达,促进动脉粥样硬化的发展[8]。该研究结果也证实,EMPs可以刺激HUVEC细胞ICAM-1 mRNA的表达,且呈剂量和时间依赖性。因此,EMPs作为一种效应物质,可能参与动脉粥样硬化的发生和发展过程。
ERK、p38MAPK和NF-κB是介导内皮细胞炎性反应和炎性因子表达的重要信号转导通路[4]。通常认为NF-κB是ERK和p38MAPK的下游信号分子,它是将信息从胞质转导至胞核,引起相应基因表达的最终信号通路和重要转录因子。既往众多研究[4]表明,多种刺激物可通过上述信号通路诱导HUVEC上调ICAM-1表达。该研究结果显示,单独应用ERK、p38MAPK及NF-κB特异性抑制剂均可部分地抑制EMPs诱导HUVEC ICAM-1的表达,提示EMPs诱导HUVEC上调ICAM-1的表达需要ERK和p38MAPK信号转导通路的参与,同时在EMPs诱导的HUVEC活化和炎性反应过程中NF-κB介导的细胞信号转导也发挥了重要作用。
既往研究[5]表明,阿托伐他汀除了具有调脂作用外,还具有抑制内皮炎症,保护内皮细胞,延缓动脉粥样硬化发展,稳定斑块的作用。该研究结果表明,阿托伐他汀可以明显抑制EMPs诱导的HUVEC细胞 ICAM-1mRNA表达上调,下调 ERK、p38MAPK、核蛋白NF-κB p65的磷酸化水平。提示阿托伐他汀抑制内皮炎症,延缓动脉粥样硬化发展和稳定斑块的作用可能与抑制EMPs对血管内皮的损伤和刺激有关。
综上所述,EMPs通过ERK、p38MAPK和NF-κB信号转导通路诱导HUVEC表达ICAM-1。阿托伐他汀主要通过上述信号通路抑制EMPs诱导的内皮炎症。
[1]Chironi GN,Boulanger CM,Simon A,et al.Endothelial microparticles in diseases[J].Cell Tissue Res,2009,335 (1):143
[2]Dignat-George F,Boulanger CM.The many faces of endothelial microparticles[J].Arterioscler Thromb Vasc Biol,2011,31(1):27
[3]Frank PG,Lisanti MP.ICAM-1:role in inflammation and in the regulation of vascular permeability[J].Am J Physiol Heart Circ Physiol,2008,295(3):H926
[4]Roh HC,Yoo do Y,Ko SH,et al.Bacteroides fragilis enterotoxin upregulates intercellular adhesion molecule-1 in endothelial cells via an aldose reductase-,MAPK-,and NF-kappaB-dependent pathway,leading to monocyte adhesion to endothelial cells[J].J Immunol,2011,187(4):1931
[5]Walter T,Suselbeck T,Borggrefe M,et al.Effect of atorvastatin on cellular adhesion molecules on leukocytes in patients with normocholesterolemic coronary artery disease[J].In Vivo,2010,24(2):189
[6]Terrisse AD,Puech N,Allart S,et al.Internalization of microparticles by endothelial cells promotes platelet/endothelial cell interaction under flow[J].J Thromb Haemost,2010,8(12):2810
[7]Amabile N,Guerin AP,Tedgui A,et al.Predictive value of circulating endothelial microparticles for cardiovascular mortality in end-stage renal failure:a pilot study[J].Nephrol Dial Transplant,2012,27(5):1873
[8]Rautou PE,Vion AC,Amabile N,et al.Microparticles,vascular function,and atherothrombosis[J].Circ Res,2011, 109(5):593
[9]Feng B,Chen Y,Luo Y,et al.Circulating level of microparticles and their correlation with arterial elasticity and endothelium-dependent dilation in patients with type 2 diabetes mellitus[J].Atherosclerosis,2010,208(1):264
Effects of atorvastatin on expressions of ERK,p38MAPK,NF-κB proteins and ICAM-1 mRNA in HUVECs induced by endothelial microparticles
LU Yongguang,FU Chunhui,YAN Hua,CHEN Xianggui,HUANG Junzhang,CHEN Liyuan Department of Cardiology,the Second People’s Hospital of Qinzhou,Qinzhou 535099
endothelial microparticle;human umbilical vein endothelial cell;mitogen-activated protein kinase;intercellular adhesion molecule 1;atorvastatin
Aim:To observe the effects of atorvastatin on ERK,p38MAPK and nuclear factor-κB(NF-κB)and intercellular adhesion molecule 1(ICAM-1)expressions in endothelial microparticles(EMPs)-induced human umbilical vein endothelial cells(HUVECs).Methods:The cultured HUVECs were cultured with EMPs of 105mL-1for 0,3,6,12,and 24 h.The HUVECs were cultured with 0,102,103,104,105mL-1EMPs for 24 h.The HUVECs were pretreated with ERK inhibitor(PD98059),p38 inhibitor(SB203580),NF-κB inhibitor(PDTC),or atorvastatin,then were treated with EMPs.The ICAM-1 mRNA level was detected by Real-time-PCR.Western blot was performed to determine the expression levels of phospho-ERK(p-ERK),p-p38MAPK and NF-κB p65 proteins.Results:With the increase of dose and exposure time of EMPs,the expression levels of ICAM-1 mRNA,p-ERK,p-p38MAPK and NF-κB p65 protein in HUVECs obviously increased(P<0.001).After the pretreatment of the inhibitors mentioned above and atorvastatin,the ICAM-1 mRNA expression decreased(P<0.05).Conclusion:Atorvastatin could downregulate ICAM-1 expression in EMPs-induced HUVECs by blocking ERK/MAPK and NF-κB signaling pathway.
R543.3
10.3969/j.issn.1671-6825.2012.06.006*广西自然科学基金青年基金资助项目 2012GXNSFBA053113;广西卫生厅自筹经费科研项目 Z2011103
(2012-02-05收稿 责任编辑王 曼)
