罗格列酮对帕金森病模型小鼠中脑黑质iNOS和IL-6表达的抑制作用及其意义
2012-12-06魏子峰秦丽娟周洪霞张宇新
张 田,魏子峰,秦丽娟,周洪霞,张宇新
(1.河北联合大学基础医学院生理学教研室,河北 唐山063000;2.河北联合大学基础医学院解剖学教研室,河北 唐山063000)
罗格列酮对帕金森病模型小鼠中脑黑质iNOS和IL-6表达的抑制作用及其意义
张 田1,魏子峰2,秦丽娟1,周洪霞2,张宇新2
(1.河北联合大学基础医学院生理学教研室,河北 唐山063000;2.河北联合大学基础医学院解剖学教研室,河北 唐山063000)
目的:探讨罗格列酮对帕金森病(PD)模型小鼠中脑黑质中诱导型一氧化氮合酶(iNOS)和白细胞介素-6(IL-6)的调控作用,并阐明其机制。方法:45只雄性小鼠随机分为对照组、模型组和罗格列酮处理组,每组15只。采用爬杆实验法观察各组小鼠行为学变化;采用免疫组织化学染色和Western blotting法观察小鼠中脑黑质酪氨酸羟化酶(TH)、iNOS和IL-6的表达。结果:模型组小鼠出现震颤、步态迟缓等PD样症状;小鼠转身(T-turn)及爬杆时间(T-LA)较对照组显著延长(P<0.05);黑质区TH阳性神经元缺失,炎症因子iNOS和IL-6阳性细胞明显增多,蛋白表达水平高于对照组(P<0.05);罗格列酮处理组小鼠PD样症状较模型组减轻,T-turn和T-LA少于模型组(P<0.05),iNOS、IL-6和TH阳性细胞数及蛋白表达水平与模型组比较差异有统计学意义(P<0.05)。结论:罗格列酮可能通过抑制炎症因子iNOS和IL-6表达,对多巴胺能神经元起到保护作用。
帕金森病;酪氨酸羟化酶;诱导型一氧化氮合酶;白细胞介素-6;罗格列酮
目前,帕金森病(Parkinson’s disease,PD)的治疗多采用多巴胺(dopamine,DA)替代疗法,但DA替代疗法只能起到改善症状的作用,不能延缓疾病进程和多巴胺能神经元退变,长期应用DA可能会导致疾病恶化,因此急需找到其他有效的治疗药物。近年研究[1-2]显示:神经炎症可能是导致PD多巴胺能神经元丢失的重要因素,炎症因子引起了多巴胺能神经元变性丢失,因此抗炎治疗可能成为PD的重要治疗策略之一。罗格列酮是一种常用的治疗糖尿病药物,文献[3]报道:其在神经系统变性疾病中对神经元有保护作用,而罗格列酮对PD是否有治疗作用目前国内外尚无报道。为明确这一问题,本实验以1-甲基-4-苯基-1,2,3,6四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahyd - ropyridine,MPTP)制备PD小鼠模型,探讨罗格列酮能否可以减少PD模型小鼠黑质中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和白细胞介素-6(interleukin-6,IL-6)的表达,从而对多巴胺能神经元产生保护作用,以期为PD的治疗寻找新的途径。
1 材料与方法
1.1 实验动物及主要试剂 45只雄性健康C57BL/6N小鼠,12~14周龄,体质量25~30 g,清洁级,购于北京维通利华公司[SCXX(京)2002-2003],小鼠均自由进食、饮水,在室温(25±2)°C单笼喂养。MPTP(Sigma公司,USA);兔抗鼠iNOS单克隆抗体、UltraSensitive SP超敏试剂盒(福州迈新公司,中国);兔抗大鼠IL-6单克隆抗体(Eptomics公司,USA);预染蛋白 Marker(天津灏洋生物公司,中国);大鼠抗TH单克隆抗体(Chemicon公司,USA);罗格列酮(葛兰素史克公司,英国)。
1.2 动物分组及给药 小鼠随机分为模型组、罗格列酮处理组和对照组,每组15只。模型组:小鼠腹腔注射 MPTP(25 mg·kg-1,生理盐水溶解),每天1次,连续7 d;罗格列酮处理组:在MPTP注射前4 h给予小鼠罗格列酮灌胃预处理(4 mg·kg-1),每天1次,连续7 d;对照组:注射与模型组小鼠等量的生理盐水。
1.3 组织固定、取材和切片 MPTP第7次注射后12 h,每组随机取9只小鼠。小鼠腹腔麻醉后,经左心室插管用生理盐水(室温)灌注,再用4%多聚甲醛磷酸盐缓冲液缓慢灌注固定,迅速切取小鼠中脑黑质部位脑块,置于4%多聚甲醛中固定48 h(4°C),固定好的脑组织经蒸馏水冲洗、梯度乙醇脱水、二甲苯透明、浸蜡和包埋处理,石蜡切片机做连续冠状切片,片厚5 m,4°C保存备用。每组15只小鼠中,随机取6只进行Western blotting分析。小鼠麻醉后,迅速断头取脑,分离小鼠中脑黑质部分,置入细胞裂解液中,低温匀浆,4°C震荡30 min后,12000 min-1、4°C离心15 min,取上清液,-80°C保存备用。
1.4 小鼠行为学检测 采用爬杆实验测定各组小鼠行为学改变。在MPTP注射7 d后,将1根长55.0 cm、直径0.8 cm的木杆上端缠以纱布以防止打滑,作为实验爬杆。测试时将被测小鼠头向上置于木杆顶端,分别记录小鼠转身时间(T-turn)和完全爬到杆底所需要的时间(T-LA)。每只小鼠测3次,取平均值。爬杆时间参数延长反应小鼠运动功能损害的程度。
1.5 免疫组织化学SP法检测各组小鼠酪氨酸羟化酶(TH)、iNOS和IL-6阳性神经元数量 切片经二甲苯脱蜡、梯度乙醇脱水后,用TBS缓冲液p H(7.4±0.2)洗3次,每次5 min;组织切片进行水浴法抗原修复;降至室温;每张切片加入过氧化氢25μL,阻断内源性过氧化物酶;每张切片滴加10%正常山羊血清25μL,室温孵育15 min,同一组织相邻切片分别加入兔抗鼠iNOS单克隆抗体(1∶150)、兔抗大鼠IL-6单克隆抗体(1∶150)和大鼠抗TH单克隆抗体(1∶300),4°C过夜;加入二抗(生物素标记羊抗兔IgG,1∶150),室温孵育20 min;加入链霉菌抗生物素蛋白-过氧化酶溶液25μL,室温孵育20 min,DAB显色,自来水冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下观察。用多巴胺能神经元特异性标志酶TH判定模型小鼠黑质区多巴胺能神经元变化以及炎症因子iNOS和IL-6的表达变化。采用CMIAS真彩医学图像自动分析系统进行阳性细胞计数。各组每只动物取3张脑片,数值相加后取平均值。
1.6 免疫荧光组织化学染色法观察各组小鼠TH、iNOS和IL-6的表达部位 脑组织切片常规脱蜡至水后,PBS洗3次,每次15 min,正常非免疫动物血清室温孵育30 min,同一组织相邻切片分别加入兔抗鼠iNOS单克隆抗体(1∶100)与小鼠抗人TH单克隆抗体(1∶300)的一抗混合液和小鼠抗人TH单克隆抗体(1∶300)与兔抗大鼠IL-6单克隆抗体(Ser63,1∶100)的一抗混合液,4℃过夜,PBS振洗3次,每次15 min,加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗兔IgG(1∶60)和四甲基若丹明异硫氰酸盐(tetramethyl rhodamine isothiocyanate,TRITC)标记山羊抗小鼠IgG(1∶100)荧光二抗混合液,37℃、60 min,PBS振洗3次,每次15 min,双蒸水振洗10 min,甘油缓冲液封片,荧光显微镜观察照相。绿色荧光为iNOS和IL-6表达,红色荧光为TH表达,橘黄色为双重荧光染色。
1.7 Western blotting法检测各组小鼠 TH、iNOS和IL-6蛋白表达量 蛋白定量后取4倍体积样品缓冲液,95℃变性10 min。蛋白上样量为每孔30 g,10%SDS-PAGE电泳,将蛋白电转移至硝酸纤维膜上,依相对分子质量大小切取条带,加入封闭液,室温下震荡2 h后,取相应条带分别加入兔抗鼠iNOS单克隆抗体(1∶300)、兔抗大鼠IL-6单克隆抗体(1∶200)和大鼠抗TH单克隆抗体(1∶400),4℃过夜。室温孵育1 h后分别加入二抗(生物素标记羊抗兔IgG,1∶500),室温孵育1 h;加入链霉菌抗生物素蛋白-过氧化酶溶液室温下孵育0.5 h;DAB显色,扫描蛋白印迹条带,作定量分析。
1.8 统计学分析 采用SPSS 13.0统计学软件进行数据分析。各组小鼠T-turn、T-LA、小鼠中脑黑质iNOS、IL-6和TH阳性细胞数及蛋白表达量以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 3组小鼠行为学表现 MPTP注射7 d后,模型组小鼠出现典型PD样症状,表现为竖毛、翘尾、震颤和运动变缓等特征。爬杆实验中,与对照组小鼠比较,模型组小鼠出现爬杆能力下降,爬杆所需时间显著延长。罗格列酮处理后,小鼠运动功能得到一定程度改善,表现为爬杆时间明显缩短。见表1。
表1 3组小鼠转身时间和爬杆时间的比较Tab.1 Comparisons the time of T-turn and T-LA between various groups (n=9,±s,t/s)

表1 3组小鼠转身时间和爬杆时间的比较Tab.1 Comparisons the time of T-turn and T-LA between various groups (n=9,±s,t/s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group T-turn T-LA Control 2.2±0.6 5.3±1.5 Model 4.9±1.3* 13.8±3.7*Rosiglitazone 3.1±0.9△ 7.7±2.8△
2.2 iNOS、IL-6和TH免疫荧光双重染色 模型组小鼠中脑黑质区可见TH免疫荧光单标记细胞为红色(图1 A和B,见插页二),iNOS和IL-6免疫荧光单标记细胞为绿色(图1 C和D,见插页二),融合图像可见橘黄色荧光,表明iNOS和IL-6与TH有部分共定位(图1 E和F,见插页二),黑质区大多数表达iNOS和IL-6的神经元均为多巴胺能神经元。
2.3 3组小鼠iNOS、IL-6和TH阳性细胞形态和数量 对照组小鼠中脑黑质区偶见iNOS和IL-6阳性细胞,第7次注射MPTP后12 h模型组小鼠中脑黑质区iNOS和IL-6阳性细胞显著增多,胞质呈棕黄色;罗格列酮处理组iNOS和IL-6阳性细胞较模型组减少。图像分析,模型组和罗格列酮处理组iNOS和IL-6阳性细胞数比较差异具有统计学意义(P<0.05),见图2(插页三)和表2。对照组小鼠黑质区TH阳性神经元排列整齐密集,与对照组比较,模型组小鼠中脑黑质区TH阳性神经元大量丢失,罗格列酮处理组TH阳性神经元丢失程度明显减轻。模型组和罗格列酮处理组TH阳性细胞数比较差异具有统计学意义(P<0.05),见图3(插页三)和表2。
2.4 3组小鼠IL-6、iNOS和TH蛋白表达水平免疫印迹,对照组小鼠中仅有微量IL-6、iNOS蛋白表达,模型组小鼠中IL-6、iNOS表达水平较对照组显著升高(P<0.05);罗格列酮处理组IL-6、iNOS蛋白表达水平较模型组明显下降(P<0.05);模型组 TH 表达较对 照组降低(P<0.05),模型组和罗格列酮处理组TH表达量比较差异具有统计学意义(P<0.05),而罗格列酮处理组与对照组IL-6、iNOS和TH表达量比较差异无统计学意义(P>0.05)。见图4和表3。
表2 3组小鼠中脑黑质iNOS、IL-6和TH阳性细胞数Tab.2 The numbers of iNOS,IL-6 and TH positive cells in the substantia nigra of the midbrain of mice in three groups(n=9,±s)
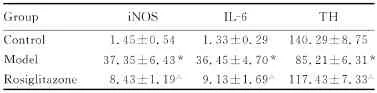
表2 3组小鼠中脑黑质iNOS、IL-6和TH阳性细胞数Tab.2 The numbers of iNOS,IL-6 and TH positive cells in the substantia nigra of the midbrain of mice in three groups(n=9,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group iNOS IL-6 TH Control 1.45±0.541.33±0.29140.29±8.75 Model 37.35±6.43* 36.45±4.70* 85.21±6.31*Rosiglitazone 8.43±1.19△ 9.13±1.69△ 117.43±7.33△

图4 3组小鼠中脑黑质IL-6、iNOS和TH蛋白表达电泳图Fig.4 Electrophoregram of expressions of IL-6,iNOS and TH in the substantia nigra of the midbrain of mice in three groups
表3 3组小鼠中脑黑质IL-6、iNOS和TH蛋白表达水平Tab.3 Expression levels of IL-6,iNOS and TH in the substantia nigra of the midbrain of mice in three groups(n=9,±s)

表3 3组小鼠中脑黑质IL-6、iNOS和TH蛋白表达水平Tab.3 Expression levels of IL-6,iNOS and TH in the substantia nigra of the midbrain of mice in three groups(n=9,±s)
*P<0.05 vs control group;△P<0.05 vs model group.
Group IL-6 iNOS TH Control 4.24±0.282.17±0.2419.78±3.13 Model 26.33±3.01* 25.32±3.98* 11.89±1.47*Rosiglitazone 7.28±1.42△ 9.10±1.35△ 16.14±1.32△
3 讨 论
PD是一种常见于中老年人中枢神经系统的退变性疾病,主要病理特征为黑质致密部多巴胺能神经元进行性变性丢失,使黑质-纹状体通路DA释放减少,从而出现静止性震颤、肌肉强直和运动迟缓等临床症状。尽管目前PD的发病机制仍不是十分清楚,但越来越多的证据[4]表明:炎症反应可能在PD 发病中起重要作用。研究[5-7]显示:应用MPTP、6-羟 多 巴 胺(6-hydroxydopamine,6-OHDA)和鱼藤酮建立PD动物模型,能显著刺激炎症因子如iNOS和IL-6的表达,造成多巴胺能神经元变性丢失。国外学者研究[8]发现:在脂多糖(lipopolysaccharide,LPS)建立的PD体外模型中,抑制iNOS和IL-6表达,可对多巴胺能神经元起到保护作用。另有研究[9]显示:PD患者中脑黑质区变性神经元周围炎症因子水平显著升高。本实验采用MPTP制备PD小鼠模型,于MPTP注射后第7天观察小鼠黑质区炎症因子iNOS和IL-6蛋白表达和TH神经元丢失情况,结果显示:模型组小鼠黑质区TH阳性神经元丢失明显,同时伴有炎症因子iNOS和IL-6大量表达,而对照组小鼠未出现上述变化,Western blotting检测结果也显示了同样趋势。免疫荧光双标记检测结果显示:iNOS、IL-6和TH神经元存在共定位。上述现象表明:多巴胺能神经元丢失可能与炎症反应存在密切联系。
目前,PD的治疗仍然是控制症状为主。左旋多巴是治疗PD的首选药物,但其并不能阻止PD的病程进展,而且长期服用会产生严重的副作用。越来越多的研究[10]显示:炎症反应可能在PD发病中起了重要作用,因此抗炎治疗有望成为治疗PD的重要手段之一。米诺霉素能有效地降低炎症反应,在PD治疗中已取得了较好疗效。国外学者研究[11]发现:罗格列酮可减少神经系统损伤疾病中神经元的丢失,对神经元起到保护作用。最近文献[12]报道:在 MPTP所致PD慢性动物模型中,罗格列酮可以减少小胶质细胞PPAR-γ表达,减轻多巴胺能神经元变性丢失。本研究结果显示:与模型组小鼠比较,罗格列酮处理组小鼠中脑黑质区iNOS和IL-6阳性细胞大幅减少,蛋白水平亦下降,同时TH阳性神经元丢失程度得到明显减轻。由于MPTP选择性破坏黑质多巴胺能神经元,导致黑质细胞体、纹状体神经末梢DA递质大量减少,从而出现PD样症状。本实验采用爬杆试验对小鼠运动功能进行动态评估[13]结果显示:模型组小鼠产生类似PD样症状体征,肢体协调能力差,表现为爬杆所需时间延长,经罗格列酮处理后运动功能增强,爬杆时间明显缩短。
综上所述,在本实验条件下,MPTP可诱导模型小鼠中脑黑质炎症介质iNOS和IL-6的高表达,多巴胺能神经元显著丢失;罗格列酮可抑制iNOS和IL-6表达,使多巴胺能神经元变性丢失现象有所减轻,从而发挥一定的神经保护作用。
[1]Tian L,Zhang S,Xu L,et al.Selenite benefits embryonic stem cells therapy in the animal models of Parkinson’s disease through inhibiting inflammation[J]. Mol Neurodegener,2012,7(Suppl 1):L25.
[2]Collins LM,Toulouse A,Connor TJ,et al.Contributions of central and systemic inflammation to the pathophysiology of Parkinson’s disease[J]. Neuropharmacology,2012,62(7):2153-2167.
[3]Escribano L,Simón AM,Gimeno E,et al.Rosiglitazone rescues memory impairment in Alzheimer’s transgenic mice:mechanisms involving a reduced amyloid and tau pathology[J].Neuropsychopharmacology,2010,35(7):1593-1604.
[4]Garrido-Gil P,Joglar B, Rodriguez-Perez AI, et al.Involvement of PPAR-γ in the neuroprotective and antiinflammatory effects of angiotensin type 1 receptor inhibition:effects of the receptor antagonist telmisartan and receptor deletion in a mouse MPTP model of Parkinson’s disease[J].J Neuroinflammation,2012,9:38.
[5]Broom L,Marinova-Mutafchieva L,Sadeghian M,et al.Neuroprotection by the selective iNOS inhibitor GW274150 in a model of Parkinson’s disease[J].Free Radic Biol Med,2011,50(5):633-640.
[6]Tsai SJ,Chao CY, Yin MC,et al.Preventive and therapeutic effects of caffeic acid against inflammatory injury in striatum of MPTP-treated mice[J].Eur J Pharmacol,2011,670(2/3):441-447.
[7]Hernández-Romero MC,Delgado-Cortés MJ,Sarmiento M,et al.Peripheral inflammation increases the deleterious effect of Cns inflammation on the nigrostriatal dopaminergic system[J].Neurotoxicology,2012,33(3):347-360.
[8]Kim IS,Ko HM,Koppula S,et al.Protective effect of Chrysanthemum indicum Linne against 1-methyl-4-phenylpridinium ion and lipopolysaccharide-induced cytotoxicity in cellular model of Parkinson’s disease[J].Food Chem Toxicol,2011,49(4):963-973.
[9]Tansey MG, Goldberg MS. Neuroinflammation in Parkinson’s disease:its role in neuronal death and implications for therapeutic intervention[J].Neurobiol Dis,2010,37(3):510-518.
[10]Fan L,Wang TL,Xu YC,et al.Minocycline may be useful to prevent/treat postoperative cognitive decline in elderly patients[J].Med Hypotheses,2011,76(5):733-736.
[11]Verma R,Mishra V,Gupta K,et al.Neuroprotection by rosiglitazone in transient focal cerebral ischemia might not be mediated by glutamate transporter-1[J].J Neurosci Res,2011,89(11):1849-1858.
[12]Carta AR,Frau L,Pisanu A,et al.Rosiglitazone decreases peroxisome proliferator receptor-gamma levels in microglia and inhibits TNF-alpha production: new evidences on neuroprotection in a progressive Parkinson’s disease model[J].Neuroscience,2011,194:250-261.
[13]Yacoubian TA,Standaert DG.Targets for neuroprotection in Parkinson’s disease[J].Biochem Biophys Acta,2009,1792(7):676-687.
Inhibitory effects of rosiglitazone on expressions of iNOS and IL-6 in substantia nigra of mice with Parkinson’s disease and their significances
ZHANG Tian1,WEI Zi-feng2,QIN Li-juan1,ZHOU Hong-xia2,ZHANG Yu-xin2
(1.Department of Physiology,School of Basic Medical Sciences,Hebei United University,Tangshan 063000,China;2.Department of Anatomy,School of Basic Medical Science,Hebei United University,Tangshan 063000,China)
Objective To investigate the regulation of rosiglitazone on iNOS and IL-6 in substantia nigra of the mice with Parkinson’s disease(PD),and to clarify the mechanism.Methods 45 male mice were randomly divided into control group(n=15),model group(n=15)and rosiglitazone group(n=15).The behavioral changes of the mice in various groups were observed by pole climbing experiment;immunohistochemistry and Western blotting methods were used to observe the expressions of iNOS,IL-6 and TH in substantia nigra of the mice.Results The model mice exhibited typical PD-like behaviors,such as tremor,gait retardation;compared with control group,the time of T-turn and T-LA in model group was prolonged,the differences between two groups were significant(P<0.05);Compared with control group,TH-positive neurons lost obviously,the numbers of iNOS,IL-6 and TH immunoreactive cells and the expression levels in substantia nigra of the midbrain were increased markedly,and the differences were statistically significant(P<0.05).After treated with rosiglitazone,the changes mentioned above were reduced significantly;there were significant differences of the numbers of iNOS,IL-6 and TH positive cells and their protein expression levels compared with model group(P<0.05).Conclusion Rosiglitazone may protect the dopaminergic neurons by inhibiting the expressions of iNOS and IL-6.
Parkinson’s disease;tyrosine hydroxylase;inducible nitric oxide synthase;interleukin-6;rosiglitazone
R745
A
1671-587Ⅹ(2012)06-1124-05
2012-05-20
河北省科技厅自然科学基金资助课题(C2004000689);河北省博士基金资助课题(05547008D-4);河北省科学技术与社会发展计划项目资助课题(04276135);河北省唐山市科学技术研究与发展计划项目资助课题(10140201A-15)
张 田(1979-),女,河北省唐山市人,讲师,医学硕士,主要从事帕金森病病因与发病机制的研究。
张宇新(Tel:0315-3726421,E-mail:jpzyx@163.com)
