阴沟肠杆菌噬菌体ФEc53的分离及鉴定
2012-12-06史红艳余静丹周佳琦李菁华孙延波
王 丹,史红艳,余静丹,周佳琦,李菁华,孙延波
(吉林大学白求恩医学院病原生物学系,吉林 长春130021)
阴沟肠杆菌噬菌体ФEc53的分离及鉴定
王 丹,史红艳,余静丹,周佳琦,李菁华,孙延波
(吉林大学白求恩医学院病原生物学系,吉林 长春130021)
目的:以14株阴沟肠杆菌为宿主菌,从环境污水中分离噬菌体,分析其生物学特性,鉴定其分型。方法:采用双层琼脂噬斑法分离并鉴定噬菌体。纯化后的噬菌体经负染法染色,通过电镜观察其大小和形态;提取噬菌体基因组,进行酶切电泳分析;通过裂解谱的分析,确认噬菌体的特异性和裂解宿主菌范围。结果:成功分离1株裂解性噬菌体,电镜显示噬菌体的头部呈球形,直径约60 nm,尾部长约130 nm。琼脂糖凝胶电泳显示其基因组约40000 bp,且含多种酶切位点。特异性实验显示其呈现较窄的宿主范围。结论:分离的阴沟肠杆菌噬菌体(命名为ФEc53)属于有尾病毒目,管尾病毒科,是一种特异性高、裂解性强的毒性噬菌体。
噬菌体;阴沟肠杆菌;细菌耐药
阴沟肠杆菌属肠杆菌科细菌,为革兰氏阴性杆菌,具有鞭毛,能利用柠檬酸盐作为碳源,可发酵葡萄糖,产酸产气。阴沟肠杆菌广泛分布于自然界,亦可存在于人和动物的肠道中。阴沟肠杆菌是医院内感染常见的致病菌之一[1],可引起呼吸道感染、尿道感染、败血症和腹膜炎等。国内细菌耐药性监测数据[2]显示:阴沟肠杆菌对β-内酰胺酶类、氨基糖苷类和喹诺酮类抗生素均表现了较高的耐药率,这为阴沟肠杆菌感染的抗生素疗法造成一定的困难。噬菌体是侵袭细菌的病毒,存在于自然界的环境中,利用其对细菌裂解的特异性和高效性,噬菌体除可用于细菌的分型鉴定外,在多重耐药菌株的治疗、食品加工卫生和生态环境的净化等领域有着广阔的应用前景[3]。虽然噬菌体的研究开展已久,但国内外尚未见有关阴沟肠杆菌噬菌体的深入研究。本实验通过双层琼脂噬斑法从环境中分离1株针对阴沟肠杆菌的裂解性噬菌体,并对其生物学特性进行初步的分析及鉴定,为进一步研究阴沟肠杆菌噬菌体奠定基础。
1 材料与方法
1.1 菌株、主要试剂与仪器 14株阴沟肠杆菌来自长春中医药大学附属医院检验科,菌株经法国生物梅里埃公司VITEK-32全自动微生物分析鉴定系统鉴定。营养琼脂(青岛高科园海博生物技术有限公司),胰蛋白胨和酵母浸粉(北京奥博星生物技术有限责任公司),Agar琼脂粉(Bacteriological Grade公司),脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseⅠ)、Tris-饱 和 酚(北京鼎国昌盛生物技术有限责任公司),核糖核酸酶A(Ribonuclease A,RNase A)(Sigma公司),氯仿(天津天泰精细化学品有限公司),PEG 8000(天佳生物技术有限公司),蛋白酶 K(Bacteriological Grade公司),Eco RⅠ、Eco RⅤ和NdeⅠ(Takara公司)。
1.216 S r RNA阴沟肠杆菌PCR引物的设计与合成 根据GenBank查询阴沟肠杆菌16 S r RNA基因序列(Accession:NC_04121),并设计引物,通过多聚酶链反应,进一步确认阴沟肠杆菌。设计序列如下:上游引物,5′-TCCACAGAACTTTCCAGAGATG-3′; 下 游 引 物,5′-CCTACGGTTACCTTGTTACGACTT-3′。扩增目的基因片段的长度为519 bp,PCR反应条件:95℃、5 min;94℃、30 s,55℃、30 s,72℃、1 min,共35个循环;72℃、10 min。质控菌株:大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853。
1.3 噬菌体的分离和纯化 取500 m L污水,加入固体CaCl2至终浓度1 mmol·L-1,5000 r·min-1离心10 min,取上清255 m L置于1000 m L三角烧瓶中,加50 m L Luria-Bertani(LB)培养基和14株阴沟肠杆菌菌液各1 m L,37℃振荡过夜培养。10000 r·min-1离心 5 min,取上清用0.22μm滤膜滤过除菌。分别以14株阴沟肠杆菌为宿主菌,与滤过液混合静止15 min,加入融化的0.7%LB琼脂(50℃)并均匀地铺在固体营养琼脂平板上,37℃培养16~18 h,观察噬菌斑的形成情况。噬菌斑形成时,挑取单个噬菌斑接种至对应的宿主菌进行扩增,单个噬菌斑经3~5次反复纯化后可得到较纯化的噬菌体。
1.4 噬菌体的电镜观察 取纯化的噬菌体悬液20μL滴于铜网上,待其自然沉淀15 min,用滤纸从侧面吸干多余的液体,加1滴2%磷钨酸到铜网上,染色10 min,干燥后进行电镜观察。
1.5 噬菌体核酸提取和酶切图谱 参照文献[4]的方法,在噬菌体悬液中加入DNaseⅠ至终浓度5 mg·L-1,RNase A至1 mg·L-1,37℃温育1 h。加入EDTA(p H 8.0)至终浓度20 mmol·L-1,加蛋白酶K至终浓度50 mg·L-1,加十二烷基硫酸钠(SDS)至终浓度0.5%,56℃温育1 h。用等体积平衡酚(p H 8.0)抽提离心,收集水相,再用等体积氯仿抽提1次,收集水相。加入体积比为1∶10醋酸钠 NaAc(3 mol·L-1,p H 5.2),于2倍体积的无水乙醇沉淀核酸,干燥后用100μL双蒸水溶解核酸,-20℃保存。提取的噬菌体核酸用限制性内切酶Eco RⅠ、Eco RⅤ和NdeⅠ进行酶切电泳分析。
1.6 宿主菌的特异性判定和裂解谱实验 分别将大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853和14株阴沟肠杆菌(编号分别为03、04、05、06、7、8、53、87、89、136、146、213、1121和1155)接种至LB液体培养基,37℃振荡培养,当A590值为0.2时,将细菌培养液置于冰箱(4℃)2 h后,分别加入纯化的噬菌体100μL,继续培养20 min,测其A590值。该方法重复3次。计算加入噬菌体前后的A590值差值的平均值,判定噬菌体对细菌的特异性和裂解谱的范围。
2 结 果
2.1 菌株的鉴定 PCR扩增阴沟肠杆菌16S r RNA基因部分序列,扩增产物经1.0%琼脂糖凝胶电泳可见500 bp左右大小的特异性条带,与预期值相符(目的片段为519 bp),而质控菌株大肠埃希菌和铜绿假单胞菌的PCR产物则为阴性。见图1。
2.2 噬菌体的噬菌斑的形态 采用双层琼脂法分离出1株阴沟肠杆菌噬菌体,命名为ФEc53。噬菌体在双层琼脂平板上形成圆形、透明,噬菌斑直径为2~4 mm。单个噬菌斑经3~5次反复纯化后,测得噬菌体滴度为2.5×1010PFU·mL-1。见图2。

图1 阴沟肠杆菌16S rRNA PCR扩增电泳图Fig.1 Electrophoregram of PCR amplification of 16S r RNA of Enterobacter cloacae
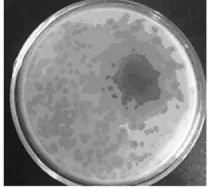
图2 阴沟肠杆菌噬菌体噬菌斑Fig.2 The plaques of Enterobacter cloacae bacteriophages
2.3 电镜观察噬菌体的形态 纯化后的噬菌体经负染后,电镜下噬菌体的头部呈球形,直径约60 nm,有一长尾约130 nm,根据噬菌体新的分类法,噬菌体ФEc53属于有尾病毒目、管尾病毒科。见图3。
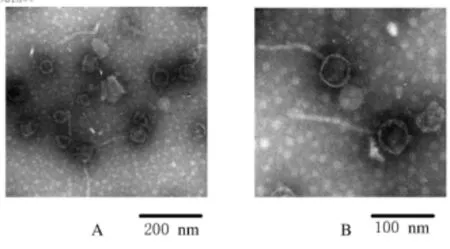
图3 阴沟肠杆菌噬菌体ФEc53电镜图像Fig.3 Electron micrograph of Enterobacter cloacae bacteriophageФEc53
2.4 噬菌体基因组的酶切鉴定 噬菌体ФEc53基因组经3种限制性内切酶酶切,0.8%琼脂糖凝胶电泳,噬菌体ФEc53基因组含Eco RⅠ、Eco RⅤ和NdeⅠ的多个酶切位点,根据Quantity One软件的比对和分析,噬菌体ФEc53基因组大小约为40000 bp。见图4。
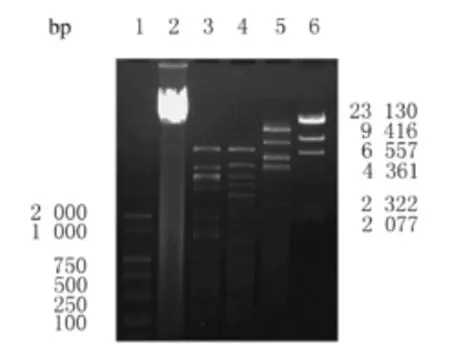
图4 噬菌体ФEc53基因组的酶切电泳图Fig.4 Electrophoregram of enzyme digestion of genome profiles of Enterobacter cloacae bacteriophageФEc53
2.5 宿主菌的特异性和裂解范围 为进一步确认噬菌体的特异性和裂解谱的范围,观察不同宿主菌(14株阴沟肠杆菌、大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853)在与噬菌体作用前后的含量变化。在所试菌株中只有1株阴沟肠杆菌(编号为53)对所分离的噬菌体敏感,其他细菌在与噬菌体作用后继续生长(细菌的含量增加)。见表1。
3 讨 论
阴沟肠杆菌是医院内感染常见的条件致病菌之一,特别是在免疫缺陷和器官移植的患者中,阴沟肠杆菌可引起呼吸道感染、尿路感染、腹膜炎和败血症等疾病。2010年度卫生部全国细菌耐药报告[5]显示:阴沟肠杆菌在临床分离的肠杆菌科细菌中已上升至第3位,此外,由于抗生素的长期和不合理应用所造成的选择性压力增高,阴沟肠杆菌对β-内酰胺类抗生素出现了较高的耐药率[6],并且通过耐药性变异形成新型耐药机制[7-8],这是临床抗感染面临的难题。噬菌体是能够特异感染细菌的病毒,广泛分布于自然界,分离纯化和制备噬菌体用以预防和治疗细菌性感染的研究倍受关注。

表1 宿主菌的特异性和裂解范围Tab.1 The specificity and cracking range of host baterium
本研究采用双层琼脂噬斑法从环境的污水中分离出1株阴沟肠杆菌噬菌体(ФEc53),在双层琼脂平板上可形成清晰的噬菌斑。有关阴沟肠杆菌噬菌体的研究国内至今尚未见报道,本次分离的阴沟肠杆菌噬菌体ФEc53,有一长尾(约130 nm),无收缩尾鞘,头部呈球形(多面体立体对称),直径约60 nm,无囊膜。根据国际病毒分类委员会分类标准[9],该噬菌体属于有尾病毒目,管尾病毒科。目前所分离到的噬菌体绝大多数属有尾病毒目[10],分属3个科,即肌尾病毒科、管尾病毒科和短尾病毒科。现已知管尾病毒科的特征是尾部较长(64~570 nm),无收缩尾鞘,头部为正多面体,双链DNA。本研究采用Quantity One软件比对和初步分析显示:噬菌体ФEc53基因组约为40000 bp;限制性内切酶分析表明:Eco RⅠ的酶切位点有9个,Eco RⅤ有15个酶切位点,NdeⅠ则有7个酶切位点。而在GenBank登录(HQ 641380.1)的阴沟肠杆菌噬菌体的基因组大约59000 bp,Eco RⅠ的酶切位点有15个,Eco RⅤ的酶切位点有37个,NdeⅠ有27个位点。因此,此次分离的阴沟肠杆菌噬菌体与已在GenBank登录的噬菌体有明显的不同。
宿主菌裂解谱的研究证明:噬菌体ФEc53仅能裂解1株阴沟肠杆菌,对其他分离并鉴定的阴沟肠杆菌不敏感,说明噬菌体ФEc53对其他来源的阴沟肠杆菌无特异性,同时也反映出不同菌株的阴沟肠杆菌其表面的受体无法被噬菌体ФEc53所识别,进而不能感染和裂解不同来源的同种宿主菌。这种严格的特异性在噬菌体抗细菌感染的实际操作中受到一定的限制。为克服这一不足,通常采用所谓的噬菌体的 “鸡尾酒”疗法[11],即将含有多株噬菌体的制剂用来治疗和预防某种细菌的感染。因此,在进一步的研究中,一方面应分离和筛选裂解谱宽的噬菌体,另一方面应分离多株阴沟肠杆菌噬菌体组成 “鸡尾酒”制剂,以探讨针对阴沟肠杆菌特别是耐药性阴沟肠杆菌的感染的治疗和预防。
[1]Jeong SH,Lee K,Chong Y,et al.Characterization of a new integron containing VIM-2,a metallo-beta-lactamase gene cassette,in a clinical isolate ofEnterobactercloacae[J].Antimicrob Chemother,2003,51(2):397-400.
[2]刘 军,李国明,赵 毅,等﹒阴沟肠杆菌I类整合子可变区耐药基因的研究[J].中国抗生素杂志,2011,36(7):543-547.
[3]Housby JN,Mann NH.Phage therapy[J].Drug Discovery Today,2009,14(11):536-540.
[4]刘 悦,李菁华,史红艳,等﹒肠出血性大肠埃希菌O157噬菌体的生物学特性[J].吉林大学学报:医学版,2012,38(1):79-83.
[5]吕 媛,李 枟,崔兰卿﹒2010年度卫生部全国细菌耐药监测报告:肠杆菌科细菌耐药监测[J].中华医院感染学杂志,2011,21(24):5138-5143.
[6]周青雪,程东庆﹒阴沟肠杆菌产β-内酰胺酶的研究进展[J].中国抗生素杂志,2011,36(12):881-884.
[7]Matushima A, Takakura S, Fujihara N, et al. High prevalence of mutators amongEnterobactercloacaenosocomial isolates and their association with antimicrobial resistance and repetitive detection[J].Clin Microbiol Infec,2010,16(9):1488-1493.
[8]Panopoulou M, Alepopoulou E,Ikonomidis A,et al.Emergence of VIM-12 inEnterobactercloacae[J].J Clin Microbiol,2010,48(9):3414-3415.
[9]Hanlon GW.Bacteriophages:an appraisal of their role in the treatment of bacterial infections[J].Int J Antimicrobial Agents,2007,30(2):118-128.
[10]赵 晨,王 辂﹒噬菌体治疗——旧观念,新阶段[J].微生物学通报,2011,38(11):1698-1704.
[11]Fu W,Forater T,Mayer O,et al.Bacteriophage cocktail for the prevention of biofilm formation byPsedomonasaeruginosaon catheters in an in vivo model system[J].Antimcrob Agents Chemother,2010,54(1):397-404.
Isolation and identification of Enterobacter cloacae bacteriophagesФEc53
WANG Dan,SHI Hong-yan,YU Jing-dan,ZHOU Jia-qi,LI Jing-hua,SUN Yan-bo
(Department of Pathogenobiology,Norman Bethune College of Medicine,Jilin University,Changchun 130021,China)
Objective To isolate bacteriophages from raw sewage and to investigate the biological properties of bacteriophages using 14 strains of Enterobacter cloacae as host cells,and to identify its structure.Methods Bacteriophages were isolated from sewage with double-agar and identified by plaque method.After purification and negative-staining of bacteriophages,the morphologic features of bacteriophages were examined by electron microscope,the bacteriophage genome was extracted for electrophoresis;the lytic spectrum of host was carried out for specificity and cracking range of the Enterobacter cloacae.Results BacteriophageФEc53 was isolated and identified,electron micrograph showed that the head of bacteriophage was spherical,60 nm in diameter and it had a tail,about 130 nm long.Electrophoresis of phage DNA revealed that the size of genome was about 40000 bp and contained lots of restriction sites.The lytic spectrum trial showed it had a relatively narrow host range.Conclusion The isolated Enterobacter cloacae(namedФEc53)bacteriophage belongs to Caudovirales,Siphoviridae.According to its biologic features,bacteriophageФEc53 has strong lytic and high specificity.
bacteriophages;Enterobacter cloacae;drug-resistant bacteria
R378.2
A
1671-587Ⅹ(2012)06-1077-04
2012-06-21
国家自然科学基金委主任基金资助课题(81150037)
王 丹(1987-),女,吉林省长春市人,在读医学硕士,主要从事噬菌体分子遗传学研究。
李菁华(Tel:0431-85619574,E-mail:ljh@jlu.edu.cn);孙延波(Tel:0431-85619574,E-mail:sunyb@jlu.edu.cn)
