小鼠成纤维细胞饲养层的制备及C57BL/6小鼠胚胎干细胞系的建立
2012-12-06张小梅方廖琼王智彪
张小梅,方廖琼,王智彪
(重庆医科大学生物医学工程学院 省部共建超声医学工程国家重点实验室超声医学工程重庆市市级重点实验室,重庆400016)
小鼠成纤维细胞饲养层的制备及C57BL/6小鼠胚胎干细胞系的建立
张小梅,方廖琼,王智彪
(重庆医科大学生物医学工程学院 省部共建超声医学工程国家重点实验室超声医学工程重庆市市级重点实验室,重庆400016)
目的:制备小鼠成纤维细胞饲养层并建立C57BL/6小鼠胚胎干细胞(ESC)系,为进一步建立人ESC系提供依据。方法:取妊娠12.5~14.5 d的胎鼠,组织消化法分离培养小鼠胚胎成纤维细胞(MEF);收集C57BL/6小鼠3.5 d的囊胚培养于小鼠制作的饲养层上;分离内细胞团(ICM),扩增传代40代以上。观察ESC集落的生长情况。采用碱性磷酸酶(AKP)染色、免疫组织化学早期胚胎特异性表面抗原(SSEA-1)、八聚体结合转录因子4(OCT-4)染色和体内分化实验对ESC集落进行鉴定。结果:分离培养后得到的ESC可稳定传代至40代以上,且均呈集落样生长。经AKP、SSEA-1和OCT-4染色后ESC均呈红褐色阳性表达,接种于裸鼠均可形成畸胎瘤;HE染色,有3个胚层组织成分。结论:成功建立了C57BL/6小鼠ESC系。
胚胎成纤维细胞;C57BL/6小鼠;胚胎干细胞;碱性磷酸酶
胚胎干细胞(embryonic stem cell,ESC)是从早期胚胎内细胞团和原始生殖细胞中分离出来的全能干细胞,具有无限增殖和全能分化的潜力。由于小鼠ESC具有胚胎嵌合和生殖系嵌合能力[1]以及在特定条件下可定向分化[2-3]等的特性,因此近年来ESC在早期胚胎发育研究[4]、基因打靶技术的改进[5]和利用细胞移植进行疾病的治疗[6]等研究领域得到了广泛的应用。ESC已成为生物医学领域的研究热点之一。ESC的建系是一项基础性的工作,不同品系小鼠ESC的建系效率有很大的差异,建系途径和方法各有特点,一个品系ESC的建系方法不一定都适合于其他品系,而ESC研究的基础与核心是有效地分离并建立稳定的ESC系。本研究尝试用自制的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)作为饲养层细胞,分离培养C57BL/6小鼠ESC,最终建立稳定C57BL/6小鼠ESC系,为进一步的研究提供实验基础,为建立人ESC系提供依据。
1 材料与方法
1.1 动物、主要试剂及仪器 健康、成年C57BL/6小鼠,由重庆医科大学实验动物中心提供,8~10周龄,体质量20~25 g,25℃环境下饲养,光照周期12 h,自由摄水、饮食,挑选发情期雌性小鼠按1∶1比例进行雌、雄鼠合笼过夜,次晨发现阴栓者为孕第l天。H-DMEM培养基、0.25%胰蛋白酶(Hyclone公司);胎 牛 血 清(FBS)(Gibco公司);丝裂霉素C(mitomycin C,MMC)(Roche公司);C57BL/6小鼠胚胎干细胞完全培养基(广州赛业生物科技有限公司);BCIP/NBT碱性磷酸酯酶(alkaline phosphatase,AKP)显色试剂盒(碧云天生物技术有限公司);Anti-SSEA-1、Anti-OCT-4抗体(Millopre公司);兔SPKit一抗为兔来源的免疫组化试剂盒(sp-0023)、鼠SPKit一抗为鼠来源的免疫组化试剂盒(sp-0024)(北京博奥森生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司)。TC 2323 型 二 氧 化 碳 孵 箱(Shel-Lab);LX70型倒置显微镜(Olympus公司)。
1.2 小鼠MEF的分离培养 取12.5~14.5 d的妊娠小鼠,断颈处死。无菌条件下取出小鼠子宫,分离胎鼠,PBS充分洗涤;去除胎鼠的头、尾、四肢和内脏,PBS液洗净,用灭菌的眼科剪将剩余组织剪成约1 mm×1 mm×1 mm大小的组织块,向组织块加入适量0.25%胰蛋白酶+0.04%EDTA消化液,轻轻吹打数次,室温或37℃消化3~5 min,加等体积含血清培养基终止消化,静置3~5 min后收集上层悬液;重复上步操作2~5遍,组织基本可以消化完全;收集的细胞悬液800~1000 r·min-1离 心 5 min,培 养 液(HDMEM+10%FBS)重悬细胞至培养瓶中,置于37℃、5%CO2、饱和湿度培养箱中培养;培养第2天初次换液,以后视细胞情况隔天换液,细胞汇合度达80%以上后,按1∶3~1∶5传代。
1.3 MEF饲养层细胞的制备 采用纯化的P2~4代MEF细胞制备饲养层,显微镜下观察细胞生长融合80%时,用10 g·L-1的 MMC处理3 h,以每孔2×105的密度接种到0.1%明胶包被过的六孔板中,置于37℃、5%CO2、饱和湿度培养箱中培养,24 h后可作饲养层细胞使用,用前去除原培养基,PBS洗1~2次后更换成小鼠ESC完全培养基即可供ESC培养。
1.4 ESC的分离培养与传代 无菌取出妊娠3.5 d小鼠子宫,4号针头冲胚,解剖显微镜下收集发育良好的囊胚,置于饲养层上培养,48~72 h后透明带自行脱落,内细胞群(inner cell mass,ICM)孵出并长大。4~5 d后用自制的毛细针挑取ICM,使之与饲养层和滋养层细胞分离,并吸至消化液小滴内(0.25%胰蛋白酶+0.04%EDTA混合消化液),使ICM在消化液小滴内作用3~5 min,并用自制的玻璃微针轻轻吹吸ICM数次,使之分散成若干个由细胞组成的小团块,这时可继续将ICM消化成单细胞,再接种于新的饲养层铺板的6孔板中。3~5 d后挑取单个干细胞集落微滴消化离散,接种于新的饲养层上,传代至3代左右,一般3~5 d即可传代,直接加入适量0.25%胰蛋白酶+0.04%EDTA混合消化液消化ESC,37℃或者室温作用2~4 min,收集细胞后接种于新的饲养层上。
1.5 ESC细胞形态学鉴定 在倒置显微镜下观察囊胚、ICM和ES集落的形态,观察其生长特征。
1.6 AKP染色观察ESC ESC传代培养后48~72 h,弃去原培养液,用PBS洗净,加入适量4%多聚甲醛溶液固定2~5 min,染色过程按照BCIP/NBT AKP显色试剂盒的说明操作,普通光学显微镜观察细胞被染成深蓝色至蓝紫色为阳性细胞,苏木精复染10 min后,水洗,凉干,光镜下观察、拍照,细胞被染成红褐色为AKP表达阳性细胞。
1.7 免疫组织化学染色检测ESC中阶段特异性胚胎 抗 原 1(stage specific embrynic antigen 1,SSEA-1)和 八聚 体 结 合 转 录 因 子4(octamerbinding transcription factor-4,OCT-4)表达 将饲养层细胞制备于10 mm×10 mm载玻片上,24 h后换ESC完全培养基,并将ESC按照1∶5传代培养于该饲养层上,培养48~72 h后,弃去原培养液,用PBS洗净,加入适量4%多聚甲醛溶液固定30 min;PBS清洗标本3次,每次2 min;0.5%Triton X-100 孵 育 20 min;PBS 清 洗 标 本3次,每次2 min;3%H2O2去离子水孵育10~15 min,以消除内源性过氧化物酶活性;分别滴加SP-0023、SP-0024试剂盒中试剂A室温孵育10~15 min,倾去,勿洗;分别加入1∶100稀释后的一抗SSEA-1 Moues Ig M和1∶1000稀释后的一抗OCT-4 Rabbit IgG,4℃过夜;后续步骤分别按照SP-0023、SP-0024试剂盒和DAB显色试剂盒说明书进行操作,染色后普通光学显微镜观察、拍照,细胞被染成红褐色为SSEA-1和OCT-4表达阳性细胞。1.8 ESC在小鼠体内分化能力的鉴定 ESC传代后48~72 h,消化离心收集细胞后,用少量PBS重悬计数,在裸鼠左下肢腹股沟处皮下注射点接种约5×105个ESC,饲养6~8周,取生成的肿块切片,常规HE染色,观察ESC在体内的生长、分化情况。
2 结 果
2.1 MEF形态学变化 MEF细胞为贴壁型生长细胞,大小不均。显微镜下观察,细胞成梭形、多边形或条带状,胞质透明,细胞质中央为卵圆形核,周边向外伸出纤维状伪足,细胞生长较快,随着细胞的增殖逐渐连接成片。原代MEF细胞形态多样(图1A),有其他细胞混杂,传代过程中杂细胞逐渐被去除。2~5代的细胞纯度状态均较好(图1B、C),分裂增殖较快,生长旺盛。第6代以后细胞生长缓慢,形态变异,体积增大,立体感明显变差,且细胞内出现明显粗颗粒区,细胞之间空隙较大,呈衰老征象(图1D)。因此选择第2~5代MEF作为饲养层细胞较好。

图1 光镜下不同代数MEF细胞形态学(×100)Fig.1 The morphology of MEF cells at different generations under light microscope(×100)
2.2 饲养层细胞的制备情况 光学显微镜下观察,经MMC处理后,MEF细胞贴壁较慢,失去分裂增殖能力,制备的MEF饲养层生长状态良好,处理前后细胞形态基本无异。见图2。
2.3 囊胚、ICM及ESC的生长状态 囊胚培养24~48 h开始脱带贴壁,培养3~5 d,内细胞团迅速增殖凸起,呈现卵圆柱状或鸟巢状,此时可以分离内细胞团。ESC有其典型的形态学特征:ESC增殖旺盛,细胞间紧密,呈典型的 “鸟巢状”生长,边缘清晰,表面光滑,结构致密,与饲养层细胞间界限清晰;第1、2代时细胞集落形成稍慢,以后一般生长4 d或5 d即可传代,传到第40代内细胞集落形态规则,细胞间紧密,边缘分化细胞极少或未见分化细胞。见图3(插页一)。
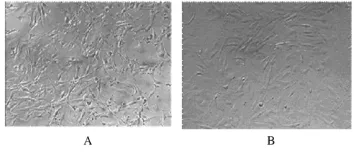
图2 光镜下MMC处理前后MEF细胞形态学(×100)Fig.2 The morphology of MEF cells before and after treated with MMC under light microscope(×100)
2.4 ESC的AKP染色结果 AKP染色,未分化的P2~40代ESC经染色后成红褐色,饲养层未着色,ESC边缘规则,与饲养层界限清楚。见图4(插页一)。
2.5 ESC的SSEA-1和OCT-4免疫组织化学染色结果 免疫组织化学染色,未分化的P2~40代ESC的SSEA-1和OCT-4染色后均呈红褐色,即阳性表达,而饲养层未着色,ESC边缘规则,与饲养层界限清楚。见图5和6(插页一)。
2.6 体内分化能力鉴定 ESC接种在裸鼠左下肢腹股沟后约2周左右开始出现明显可见的包块长出;培养6~8周后,包块平均约有2.5 cm×1.5 cm×1.2 cm大小,取生成的肿块切片,行常规HE染色,观其组织成分包含外、中和内3个胚层的多种组织成分。见图7(插页二)。
3 讨 论
自1981年Evans等[7]首次成功地从着床前小鼠胚胎ICM成功分离并建立小鼠ESC系以来,人们已经成功地从ESC诱导出不同胚层的细胞和器官组织,ESC还可以与受体胚胎嵌合,形成嵌合体,并可在体外进行各种基因操作。目前,ESC已经成为研究哺乳动物早期胚胎发生、细胞组织分化和基因表达调控等的理想模型,并可为未来临床细胞替代疗法和组织器官移植等提供无尽的供体来源。
体外维持ESC未分化状态的增殖培养是研究ESC生物学特点和应用ESC的前提基础。ESC培养主要采用饲养层细胞,已形成一种常规且稳定的ESC培养方式。目前,用于制备饲养层的细胞有原代MEF及已成系的MEF系STO细胞。其中原代MEF取材容易,价格低廉,在ESC建系、扩增培养中最为常用。本研究参照目前较规范的原代MEF分离培养方法,在实验室分离培养获得原代MEF,并制备了饲养层细胞,能够很好地支持ESC生长,分离的小鼠ESC集落增殖呈典型的鸟巢状,其细胞圆小,细胞核大,排列紧密,边缘清晰,细胞之间界限不清楚,符合小鼠ESC的一般特性。
AKP相对分子质量为56000,属于同源二聚体蛋白。每个单体由449个氨基酸组成,完整的AKP分子呈现典型的α/β的拓扑结构,同时每个单体均具有1个活性中心。AKP的高表达,与未分化的多能干细胞相关,因此AKP染色可作为检测未分化状态ESC的一个重要的标志[8-9]。未分化ESC中会表达丰富的AKP,己分化的干细胞中表达减少或消失,而且往往该酶活性越高的ESC才具有更广泛的分化能力[10]。ESC具有表达早期胚胎细胞、胚胎生殖细胞(embryonic germ cell,EGC)表面抗原的特性。早期胚胎阶段特异性抗原SSEA-1、3、4是球形的糖脂,能被单克隆抗体所识别检测到。因为存在种属差异,小鼠ESC只表达早期胚胎细胞的特异性表面抗原SSEA-1,而不表达 SSEA-3和 SSEA-4[11],表现出 SSEA-1阳性。常用单克隆抗体SSEA-1检测ES细胞表面抗原作为发育全能性的一种标志。本研究中对传至第P2~40代的细胞集落进行AKP染色及SSEA-1免疫组织化学染色,结果均呈强阳性,这说明分离培养出的ESC集落保持着未分化状态及发育全能性,持续传代培养后其ESC特性仍保存,说明培养的ESC较稳定。
OCT-4是POU转录因子家族中的一员,是由POU5F1基因编码。高水平的OCT-4的表达被认为与 ESC全能性有关[12-13]。小鼠的 OCT-4是一种有352个氨基酸序列的蛋白质,且在小鼠中OCT-4只限定在多潜能细胞中表达[14]。Guo等[15]的研究结果表明:受精卵所表达的OCT-4对建立ESC系是必需的,目前OCT-4也同样广泛地用于鉴定ESC是否处于未分化状态。本实验采用免疫组织化学方法对传至第P0~35代的细胞集落OCT-4表达产物的检测结果表明:培养的ESC的OCT-4产物阳性,进一步证明分离培养的ESC处于未分化的多潜能状态。
ESC发育多能性是指ESC可以分化成各种体细胞,包括生殖细胞。本实验体内分化研究过程中所获得的畸胎瘤中存在多种组织细胞,如一些管状结构、神经样组织和肌肉组织,进一步证明所分离获得的小鼠ESC具有分化发育成源于3个胚层的组织细胞类型的能力。
本研究通过提取原代MEF制备饲养层,利用体内发育的早期胚胎分离获得的ESC体内外均具有分化的多能性且具备小鼠ESC典型特征,因此建立了稳定的小鼠ESC系,可为进一步建立人ESC系提供理论依据和实验基础。小鼠ESC的成功分离培养为本实验室进一步进行ES组织工程研究和人ESC系的建立等工作奠定基础。
[1]Sukoyan MA,Kerkis AY,Melo MR,et al.Establishment of new murine embryonic stem cell lines for the generation of mouse models of human genetic diseases[J].Braz J Med Biol Res,2002,35(5):535-542.
[2]Nakayama T, Momoki-Soga T. Astrocyte-derived factors instruct differentiation of embryonic stem cells into neurons[J].Neurosci Res,2003,46(2):241-249.
[3]Tian HB,Bai ZL,Wang H,et al.Efficient differentiation of embryonic stem cells into neurons in glial cell-conditioned medium under attaching conditions[J]. Acta Biochim Biophys Sin,2005,37(7):480-487.
[4]Weitzer G.Embryonic stem cell-derived embryoid bodies:aninvitromodel of eutherian pregastrulation development and early gastrulation [J]. Handb Exp Pharmacol,2006(174):21-51.
[5]王 宏,沈子龙,奚 涛,等.条件性基因打靶技术研究进展[J].药物生物技术,2001,8(1):54-57.
[6]牟静岚,时永全.干细胞移植与消化系统疾病治疗的进展[J].细胞与分子免疫学杂志,2006,22(4):550-552.
[7]Evans MJ,Kaufman MH.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
[8]Du L,Lin G.Generation and identification of pluripotent stem cells from human embryonic fibroblast cells by 4 defined factors[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2009,34(12):1157-1165.
[9]Li C,Zhou J,Shi G,et al.Pluripotency can be rapidly and efficiently induced in human amniotic fluid-derived cells[J].Hum Mol Genet,2009,18(221):4340-4349.
[10]Li M,Ma W,Hou Y,et al.Improved isolation and culture of embryonic stem cells from chinese miniature pig[J].J Reprod Dev,2004,50(2):237-244.
[11]Brenner CA,Wolny YM,Adler RR.Alternative splicing of the telomerase catalytic subunit in human oocytes and embryos[J].Mol Reprod,2004,5(9):845-850.
[12]李东伟,李文雍.转录因子Oct4、Sox2、Nanog在早期胚胎发育过程中的表达凋控[J].生物学杂志,2007,24(3):6-8.
[13]Niwa H,Miyazaki J,Smith AG.Quantitative expression of Oct-3/4 defines differentiation,dedifferentiation or self-renewal of ES cells[J].Nat Genet,2000,24(4):372-376.
[14]Pralong D,Lim ML,Vassiliev I,et al.Tetraploid embryonic stem cells contribute to the inner cell mass of mouse blastocysts[J].Cloning Stem Cells,2005,7(4):272-278.
[15]Guo Y,Einhorn L,Kelley M,et al.Redox regulation of the embryonic stem cell transcription factor Oct-4 by thioredoxin[J].Stem Cells,2004,22(3):259-264.
Preparation of mouse fibroblast feeder layers and establishment of embryonic stem cell lines of C57BL/6 mice
ZHANG Xiao-mei,FANG Liao-qiong,WANG Zhi-biao
(Key Laboratory of Ultrasound Engineering in Medicine Co-founded by Chongqing and Ministry of Science and Technology,Chongqing Key Laboratory of Ultrasound Engineering in Medicine,School of Biomedical Engineering,Chongqing Medical University,Chongqing 400016,China)
Objective To prepare mouse fibroblast feeder layers and to establish C57BL/6 mouse embryonic stem cell(ESC)lines and to provide basis for the further establishment of human ESC lines.Methods The mouse embryonic fibroblasts(MEF)were isolated from the mouse embryos at 13.5-14.5 d by primary tissue digestion method and the 3.5 d blastulae of C57BL/6 mice were cultured on the mouse fibroblast feeder layer incubation;the inner cell mass(ICM)was separated and amplified and passaged over 40 generations.The growth of the MEF colonies was observed.The ESC colonies were identified by alkaline phosphatase(AKP)staining,early embryospecific surface antigen(SSEA-1) and octamer-blinding transcription factor 4(OCT-4) staining,and differentiation experiments in vivo.Results The ESC after isolation and culture could stably passage to more than 40 generations and showed a colony-like growth.The ESC showed a red-brown positive expression after AKP,SSEA-1 and OCT-4 staining.The teratomas formed after ESC was inoculated in nude mice.HE staining showed that there were three germ layer tissue components in ESC.Conclusion The C57BL/6 mouse ESC lines are successfully established.
embryonic fibroblast;C57BL/6 mouse;embryonic stem cell;alkaline phosphatase
Q132.8
A
2012-04-28
国家重点基础研究发展计划(973计划)项目资助课题(2011CB707902)
张小梅(1986-),女,重庆市人,医学硕士,主要从事胚胎干细胞与肿瘤相互作用关系方面的研究。
王智彪(Tel:023-68485021,E-mail:wangzhibiao@haifu.com)
1671-587Ⅹ(2012)06-1081-05
