红景天苷与骨髓间充质干细胞联合应用对帕金森病大鼠的治疗作用
2012-12-06范东艳陈玉丙
范东艳,王 苹,陈玉丙
(1.西藏大学医学院预防医学系,西藏 拉萨850000;2.吉林大学第一医院耳鼻咽喉-头颈外科,吉林 长春130021;3.吉林大学第二医院核医学科,吉林 长春130041)
红景天苷与骨髓间充质干细胞联合应用对帕金森病大鼠的治疗作用
范东艳1,王 苹2,陈玉丙3
(1.西藏大学医学院预防医学系,西藏 拉萨850000;2.吉林大学第一医院耳鼻咽喉-头颈外科,吉林 长春130021;3.吉林大学第二医院核医学科,吉林 长春130041)
目的:研究红景天苷与骨髓间充质干细胞(BMSCs)联合应用对帕金森病(PD)大鼠的治疗作用,为PD治疗提供实验基础。方法:采用贴壁法培养BMSCs,免疫荧光法检测细胞表面分子。利用MTT法分析10 mg·L-1红景天苷对BMSCs增殖分化的影响。将60只大鼠随机分为假手术组、模型组、红景天苷治疗组、BMSCs治疗组、红景天苷和BMSCs联合治疗组,每组12只。在相对应的时间点检测各组大鼠行为学变化,取各组大鼠脑组织测定酪氨酸羟化酶(TH)m RNA表达水平。结果:成功分离提取表达干细胞标志物CD29和CD44细胞。红景天苷作用BMSCs后,BMSCs增殖较对照组更为旺盛且平台期较对照组延长。PD模型组大鼠旋转次数减少,与其他组比较差异有统计学意义(P<0.05);模型组大鼠行为改变明显,脑组织内TH m RNA表达水平降低。红景天苷和BMSCs联合治疗组大鼠行为学异常程度较轻,脑组织内TH mRNA表达水平高于其他组(P<0.05)。结论:红景天苷与BMSCs联合应用对PD大鼠的治疗作用优于单独应用红景天苷或BMSCs。
红景天苷;骨髓间充质干细胞;帕金森病
红景天苷是红景天发挥作用的主要有效成分,可通过清除自由基、抑制钙超载和抑制胆碱酯酶活性等作用预防神经细胞功能衰退,维持血脑屏障结构 正 常[1-4]。 骨 髓 间 充 质 干 细 胞 (bone mesenchymal stem cells,BMSCs)是具有多向分化潜能的多能干细胞,在一定的条件下可以诱导分化为神经细胞,并可分泌多种神经营养因子,通过多种途径修复组织损伤,且BMSCs在脑内能长期存活[5],因此在治疗神经系统疾病方面具有广阔前景。虽然红景天苷与BMSCs均能在一定程度上保护神经细胞免受伤害,但单独使用均有一定的局限性,二者联合应用可能会发挥更好的治疗作用,达到单一细胞或单一药物无法达到的效果。有关红景天苷和BMSCs联合应用治疗帕金森病(Parkinson’s disease,PD)的研究国内外未见报道。本研究联合应用红景天苷和BMSCs治疗PD,充分发挥二者治疗的相加作用,旨在为今后药物与细胞移植联合应用提供实验基础。
1 材料与方法
1.1 实验动物、主要试剂及仪器 Wistar大鼠60只,体质量180~200 g,雌雄各半,由吉林大学实验动物中心提供,动物质量合格证号:SCXK-(吉)2007-0003。红景天苷购自中国药品生物制品检定所;DMEM/F12、胎牛血清和胰蛋白酶均购自Gibco公司;MTT、碘化丙啶、多聚甲醛、二甲基亚砜、酪氨酸羟化酶(tyrosin hydroxylase,TH)单克隆一抗和阿朴吗啡(apomorphine)均购自Sigma公司;鼠抗CD29、鼠抗CD44和羊抗鼠FITC均购自Chemicon公司;羊血清购自中杉金桥公司。MK3型酶标仪购自Labsystem公司;荧光倒置显微镜购自Olympus公司。
1.2 BMSCs的分离和体外扩增 将大鼠脱臼处死;无菌取出双侧股骨、肱骨,暴露干骺端,用L-DMEM冲洗骨髓置入30 m L离心管;1000 r·min-1离心5 min;轻柔吹打细胞团,以106m L-1细胞接种于完全培养基内(L-DMEM培养基+15%胎牛血清+100 U·m L-1青霉素和100 U·m L-1链霉素);细胞培养于37℃、5%CO2饱和湿度培养箱内。72 h后更换培养基。待细胞长到80%融合时用0.25%的胰酶消化传代,扩增。采用及时、反复传代法对细胞进行纯化。
1.3 BMSCs表型鉴定 将第3代的BMSCs种植于多聚赖氨酸包被的盖玻片上,4%多聚甲醛室温固定30 min;PBS洗3次,每次5 min;加入5%封闭血清-0.3%Trito 100-PBS,37℃封闭30 min;加一抗:鼠抗CD29(1∶50)、CD44(1∶50)。阴性对照加入PBS,置湿盒内,4℃过夜;PBS洗3次,每次5 min;加入FITC羊抗鼠IgG(1∶100)37℃孵育l h;PBS洗3次,每次5 min;PI复染细胞核,50%甘油封片,荧光显微镜下观察。荧光标记细胞核为红色,细胞浆表达产物为绿色。
1.4 MTT法检测细胞增殖能力 体外实验部分分为2组,实验组加入10 mg·L-1红景天苷[6]作用BMSCs,对照组不给药;取第3代BMSCs调整密度为1×105m L-1,分别接种于96孔板内;每板2组(实验组和对照组),一共接种7块板,每天取1块板采用MTT法检测细胞增殖。MTT法:细胞贴壁1 d后,弃培养基,每孔加入20μL MTT,培养箱内孵育4 h,之后加入二甲基亚砜,每孔200μL,用酶标仪在590 nm波长下测定各孔A值。细胞增殖抑制率=[1-(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%。分别于1~7 d相同时间点进行检测。
1.5 模型动物制备及行为学检测 Wistar大鼠术前进行行为学测试,确定无异常旋转行为。用10%水合氯醛(3 m L·kg-1)腹腔注射,睫毛反射消失后,将大鼠腹卧位固定于立体定位仪上,参照Paxinos and Watson的 《The Rat Brain Atlas》图谱,常规去毛消毒,选择纹状体部,坐标为:前囟前1.0 mm,中线右旁开2.5 mm,硬膜下4.6 mm。用微量注射器将LPS 5μL[7]缓慢注射至右侧纹状体,给药速度为1μL·min-1,对照组纹状体注射5μL PBS。手术毁损后第2周开始进行阿朴吗啡(0.5 mg·kg-1)诱导的行为学检测。大鼠置于旋转行为测试仪内,记录大鼠30 min内的旋转圈数。每分钟向健侧(左侧)旋转圈数平均>7圈大鼠为成功的PD模型大鼠。
1.6 动物分组及给药 在体实验部分将60只大鼠随机分为假手术组、模型组、红景天苷治疗组、BMSCs治疗组、红景天苷和BMSCs联合治疗组,每组12只。均在造模后2周开始给药,假手术组不给药;模型组每日经尾静脉给予5 mg·kg-1生理盐水1次;红景天苷治疗组每日经尾静脉给药1次(5 mg·kg-1)[8],连续给予15 d;BMSCs治疗组以1×106m L-1BMSCs移植纹状体内,注射体积为10μL,留针10 min,缓慢退针,常规消毒并缝合伤口,每隔7 d移植1次,共移植2次。红景天苷和BMSCs联合治疗组大鼠给予红景天苷治疗组和BMSCs治疗组联合的给药方式。
1.7 RT-PCR 检测 TH 根据文献[9-10]合成引物序列。TH引物序列:上游,5′-GGACGGCGACAGAGTCTCAT-3′;下游,5′-AGCTTCCGACGCTGGCGATA-3′(512 bp);β-actin:上游,5′-TGTCCCTGTATGCCTCTGGT-3′; 下 游, 5′-TTGATGTCACGCACGATTTC-3′(217 bp)。大鼠麻醉后,断头取脑,分离中脑腹侧包括黑质区和腹侧被盖区,取约100 mg脑组织,剪碎,提取总RNA,以1%的琼脂糖凝胶电泳,确定mRNA的完整性。逆转录反应条件:42℃逆转录反应1 h,75℃、10 min灭活禽类成髓细胞瘤病毒(AMV)。使用晶芯荧光定量PCR系列通用试剂盒及晶芯RT-Cycler实时荧光定量PCR仪进行PCR扩增。以β-actin作为内参照,采用2-Δ(ΔCt)法计算产物相对量。
1.8 统计学分析 采用SPSS 17.0软件包进行统计学分析。各组大鼠旋转次数以±s表示,两样本均数组间比较采用t检验。
2 结 果
2.1 BMSCs的形态学变化 原代培养BMSCs接种72 h后细胞开始贴壁生长,倒置显微镜下可见细胞有伪足伸出,呈集落式生长,7 d左右可见细胞有80%~90% 融合,行传代处理。取第3代BMSCs检测细胞表面抗原,本研究分离提取的BMSCs为表达干细胞标志物CD29和CD44的细胞。见图1(插页一)。
2.2 红景天苷作用不同时间BMSCs数量 当红景天苷作用BMSCs后,BMSCs增殖较对照组更为旺盛且平台期较对照组延长。见图2。
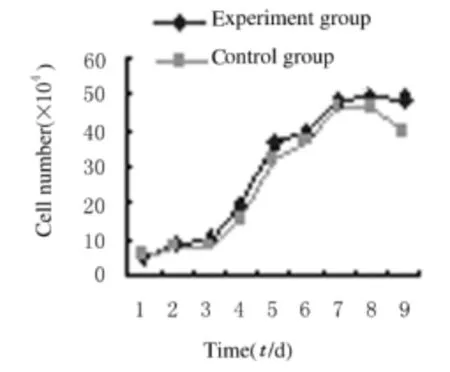
图2 红景天苷作用不同时间BMSCs数量Fig.2 Number of BMSCs after treated with salidroside for different time
2.3 各组大鼠旋转次数 旋转行为是检测模型动物行为学异常的代表性实验,旋转次数多寡表示病情的轻重。BMSCs治疗组、红景天苷治疗组、红景天苷和BMSCs联合治疗组模型大鼠旋转次数随时间增加有不同程度减少,以上3组与模型组比较,旋转次数减少程度差异有统计学意义(P<0.05)。与BMSCs治疗组和红景天苷治疗组大鼠比较,红景天苷和BMSCs联合治疗组大鼠的旋转次数减少,差异有统计学意义(P<0.05)。见表1。
表1 红景天苷作用不同时间各组大鼠的旋转次数Tab.1 Rotation number of rats in various groups after treated with salidroside for different time(n=10±s)
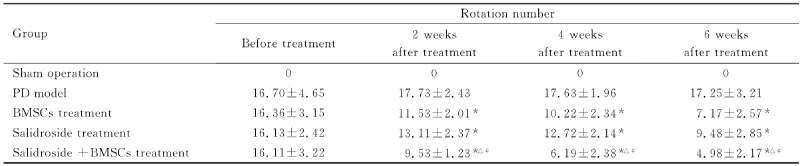
表1 红景天苷作用不同时间各组大鼠的旋转次数Tab.1 Rotation number of rats in various groups after treated with salidroside for different time(n=10±s)
*P<0.05 vs PD model group;△P<0.05 vs BMSCs group;#P<0.05 vs salidroside group.
Group Rotation number Before treatment 2 weeks after treatment 4 weeks after treatment 6 weeks after treatment Sham operation 0 0 0 0 PD model 16.70±4.65 17.73±2.43 17.63±1.96 17.25±3.21 BMSCs treatment 16.36±3.15 11.53±2.01* 10.22±2.34* 7.17±2.57*Salidroside treatment 16.13±2.42 13.11±2.37* 12.72±2.14* 9.48±2.85*Salidroside+BMSCs treatment 16.11±3.22 9.53±1.23*△# 6.19±2.38*△# 4.98±2.17*△#
2.4 各组大鼠TH mRNA表达水平 各组大鼠在造模后第6周收集组织提取总RNA,采用即时RT-PCR方法检测脑组织内TH m RNA表达水平,各组大鼠TH mRNA水平各有不同,红景天苷联合BMSCs治疗组大鼠TH m RNA的转录水平较高,基因变化倍数为2.2。单纯BMSCs治疗组基因变化倍数相对PD组为1.8倍,单纯红景天苷组基因变化倍数相对PD组为1.5倍。
3 讨 论
BMSCs是存在于骨髓间质中具有多向分化潜能、类似于胚胎干细胞的一种多能干细胞[11]。大量研究[12-13]显示:BMSCs移植对多系统疾病均有疗效,同时也是组织工程研究理想的种子细胞。实验中采用贴壁法分离、提取BMSCs,培养3 d后镜下可见细胞贴壁,呈梭形、单核、折光率好且形成集落。传代后细胞生长活跃,利用反复传代法对细胞进行纯化。传至第3代检测BMSCs表面标志物,结果显示CD29和CD44均有较高的表达率。
在本研究中,取第3代细胞与10 mg·L-1红景天苷共培养,对照组不加红景天苷。通过生长曲线的绘制探讨红景天苷对BMSCs增殖、分化的影响。体外实验生长曲线显示:在潜伏期由于细胞对传代操作所致损伤的恢复及新环境的适应2组细胞未见差别;进入对数生长期后,红景天苷作用BMSCs组细胞增殖明显活跃;进入平台期后,对照组细胞衰退较实验组快,提示红景天苷对BMSCs增殖、分化有促进作用,且能延缓细胞衰老。
本研究在体实验中红景天苷与BMSCs联合应用治疗PD结果显示:红景天苷和BMSCs联合治疗组大鼠旋转次数较PD模型组明显减少,较BMSCs移植治疗组和红景天苷治疗组大鼠的旋转次数亦有不同程度减少,提示红景天苷与BMSCs联合应用治疗PD较单独使用效果更理想,二者起到了优势互补的作用。
TH是多巴胺合成的限速酶,在多巴胺合成的过程中起关键作用,并且TH也是脑内多巴胺能神经元的蛋白标志物。动物脑内TH的含量不足可导致PD的一系列临床症状。本研究中RT-PCR检测结果显示:各组大鼠TH mRNA转录水平各有不同,红景天苷联合BMSCs作用PD模型大鼠后,脑内TH mRNA的转录水平高于PD组;单纯应用BMSCs组和单纯应用红景天苷组脑内TH mRNA的转录水平也较PD组有不同程度的增加,但是低于联合应用组脑内TH mRNA转录水平。
综上所述,本研究成功分离、提取了BMSCs,通过反复传代方法对细胞进行纯化。采用红景天苷与BMSCs共培养,红景天苷可促进BMSCs增殖、分化、延续细胞衰老,同时又不影响BMSCs生物学特性;将红景天苷与BMSCs联合应用治疗PD模型大鼠在TH基因转录水平和行为学异常改善方面均优于单独应用。
[1]崔艳梅,娄安如,赵长琦.红景天属植物化学成分及药理作用研究进展[J].北京师范大学学报:自然科学版,2008,44(3):328-332.
[2]李丹红,孟玉彩,赵 文.红景天植物生物活性研究进展[J].毒理学杂志,2008,22(4):320-323.
[3]张维烨,程桂芹,宋军华,等.红景天苷对新生大鼠海马区神经干细胞分化的研究[J].解剖科学进展,2008,14(2):205-208.
[4]Xu JH,Hu HT,Liu Y,et al.Neuroprotective effects of ebselen are associated with the regulation of Bcl-2 and Bax proteins in cultured mouse cortical neurons[J].Neurosci Lett,2006,399(3):210-214.
[5]刘振东,王静成,杨建东.骨髓间充质干细胞向神经细胞分化的相关信号通路研究现状[J].中国组织工程研究,2012,16(6):1111-1114.
[6]和 梅,张 瑶,关雪莲,等.红景天苷与脑源性神经营养因子联合对NSCs定向分化及对癫痫影响[J].黑龙江医学科学,2011,34(6):47-48.
[7]Darios F,Corti O,Lucking CB,et al.Parkin prevents mitochondrial swelling and cytochrome C release in mitochondria-dependent cell death[J].Hum Mol Genet,2003,12(5):517-526.
[8]陈秀娟,于 榕,姚明辉.红景天苷对缺血再灌注大鼠脑损伤的保护作用[J].中国临床医药学杂志,2008,17(4):212-216.
[9]何建成,袁灿兴,卫洪昌.美多巴和中药合用对帕金森病大鼠酪氨酸羟化酶(TH)及TH mRNA的影响[J].中国老年学杂志,2006,26(1):54-56.
[10]Ferraris N, Perroteau I, MarchisS,et al. Glutamatergic deafferentation of olfactory bulb modulates the expression of mGlu R1a mRNA[J].Neuroreport,1997,8(19):1949-1953.
[11]Smits AM,Van Vliet P,Hassink RJ,et al.The role of stem cells in cardiac regeneration[J].Cell Molmed,2007,11(1):21-38.
[12]Thomas MG,Stone L,Evill L,et al.Bone marrow stromal cells areplacement cells for Parkinson's disease:generation of an anatomical but not functional neuronal phenotype[J].Transl Res,2011,157(2):56-63.
[13]刘瑶瑶,陶玉香,徐海伟.骨髓间充质干细胞的生物学特性及其应用进展[J].西部医学,2009,21(8):1395-1397.
Treatment effect of salidroside combined with bone marrow mesenchymal stem cells on rats with Parkinson’s disease
FAN Dong-yan1,WANG Ping2,CHEN Yu-bing3
(1.Department of Preventive Medicine,Medical School,Tibet University,Lhasa 850000,China;2.Department of Otorhinolaryngology and Head-Neck Surgery,First Hospital,Jilin University,Changchun 130021,China;3.Depatment of Nuclear Medicine,Second Hospital,J ilin University,Changchun 130041,China)
Objective To study the treatment effect of salidroside combined with bone marrow mesenchymal stem cells(BMSCs)on rats with Parkinson’s disease(PD),and to provide experiment basis for curring Parkinson’s disease.Methods The BMSCs were cultured adherently,the cell surface molecules were detected by immunofluorescence.The effect of 10 mg·L-1salidroside on the proliferation and differentiation of BMSCs was detected by MTT.60 Wistar rats were randomly divided into sham group,model group,salidroside treatment group,BMSCs treatment group,and salidroside and BMSCs combination therapy group.The behavior changes were detected at a specific time and the levels of tyrosin hydroxylase(TH)mRNA in brain tissue were detected.Results The setm cell markers CD29 and CD44 were expressed successfully.Compared with control group,the proliferation of BMSCs got bigger and the plateau got longer after treated with salidroside.The rotation number of PD model rats was the least compared with the other groups(P<0.05).The expression level of TH mRNA was decreased.The behavior abnormalities of PD model rats were improved and the level of TH mRNA was increased after treated with salidroside and BMSCs compared with the other groups(P<0.05).Conclusion The treatment efficacy of salidroside combined with BMSCs on PD rats is better than salidroside or BMSCs alone.
salidroside;bone mesenchymal stem cells;Parkinson’s disease
R745
A
1671-587Ⅹ(2012)06-1073-04
2012-05-23
国家自然科学基金资助课题(81160360);西藏大学科研启动经费资助课题(2010-2013)
范东艳(1973-),女,吉林省吉林市人,讲师,医学博士,主要从事干细胞应用研究。
陈玉丙(Tel:0431-88796179,E-mail:yb0707@163.com)
