多药耐药基因多态性与异维A酸人体药代动力学差异关联性研究
2012-12-04周可吴黎莉陈沄
周可,吴黎莉,陈沄
(中国医学科学院北京协和医学院皮肤病研究所,南京210042)
异维A酸(Isotretinoin)是第一代维甲酸类药, 目前为治疗中重度痤疮最有效的药物之一。自1982年经FDA认证在美国上市以来已有近30年临床使用历史[1]。多年的临床治疗发现,部分病人疗效不尽如人意,而且与病情的轻重程度无关;另外,异维A酸人体药代动力学(药动学)研究发现其药动学参数有较大的个体差异[2]。笔者试图对部分人群多药耐药基因(MDR1)遗传多态性角度进行分析,从一个方面探寻影响人体内异维A酸代谢动力学过程进而影响疗效的原因。
1 对象与方法
1.1 研究对象 试验经中国医学科学院皮肤病医院国家药品临床试验机构伦理委员会同意后实施。21例男性健康受试者,年龄20~30岁,身高161~185 cm,体质量53~75 kg。受试者无药物过敏史,常规体检及实验室检验结果证明肝肾功能正常、心电图正常、精神状态良好。受试前2周及试验期间未服用其他药物。受试前对试验目的与要求完全了解,并志愿签署知情同意书。
1.2 方法
1.2.1 材料与仪器 异维A酸胶丸(泰尔丝,10 mg/粒,上海延安万象药业股份有限公司);异维A酸对照品(批号20080917,纯度100%,重庆华邦制药股份有限公司);阿维A(批号AC-0712004-711,纯度100.2%,汉江药厂五分厂)。人血基因组DNA抽提试剂盒、GoTaq DNA聚合酶。CYR2 B6等位基因体外扩增引物(上海生工生物工程技术服务有限公司合成)。乙腈(色谱纯,德国Merck公司),正己烷(色谱纯,美国Burdick&Jackson公司),异丙醇(色谱纯,江苏汉邦科技有限公司)。
LC/MS-2010EV液质联用系统(日本Shimadzu公司);2-16K低温高速离心机(德国Sigma公司);Hema480PCR扩增仪(海南黑马公司);Bio-rad PowerPac Basic电泳仪(美国 Bio-rad公司);JS-380A自动凝胶图像分析仪(上海培清科技有限公司)。
1.2.2 给药方式及血样采集 入选受试者空腹10 h后,采取0时静脉空白血样3 mL,将40 mg受试药物用 250 mL温水送服。给药后 0.5、1、1.5、2、2.5、3、4、6、8、12、24、36、60 h 静脉采血 3 mL,血样肝素抗凝,3 000 r/min离心5 min,分离血浆。血浆及血细胞分别置-20℃储存。试验过程完全避自然光。
1.2.3 血浆药物浓度测定 精密吸取血浆0.5 mL,精密加入阿维 A 溶液 25 μL(10 μg/mL),正己烷∶异丙醇(95∶5)4.0 mL,涡旋混匀 3 min,3 500 r/min 离心10 min,取尽上清液,置37℃水浴氮气吹干。残留物以100 μL HPLC-MS测定用流动相涡旋30 s溶解,高速离心后,上清液供LC-MS分析。
色谱条件:色谱柱:SHIMADZU Shim-pack VPODS C18(150×2.0 mm ID,5 μm);流动相:乙腈∶水=90∶10;流速:0.2 mL/min;ESI-MS 选择性负离子检测,异维A酸测定离子[M-H]-m/z299.05;内标阿维A测定离子[M-H]-m/z 325.00。主要ESI-MSD工作参数:CDL温度250℃;Block温度200℃;Probe电压+4.5 kV;检测电压1.45 kV;雾化气流速1.5 L/min。
1.2.4 提取DNA 取血细胞2 mL,用人血细胞DNA提取试剂盒提取基因组DNA,1.5%琼脂糖凝胶电泳鉴定基因组DNA的抽提效果,紫外分光光度计检测其含量。
1.2.5 等位基因体外扩增 采用等位基因特异扩增法(allele-specific amplification,ASA-PCR)对 MDR1 exon12(C1236T)、exon21(G2677T/A)、exon26(C3435T)位点进行基因分型检测。参照文献[3-4]的方法,采用文献报道的已知引物,经NCBI数据库(http://ncbi.nlm.nih.gov)进行BLAST分析比对,其特异性较好[5-6]。引物序列及扩增长度见表1。扩增反应分两次进行。针对不同的待测基因位点,按表1选用相应的引物进行第一次扩增,获得含待测基因位点的DNA片段。首次扩增产物稀释50倍后作为DNA模板,再按表1选用相应的引物进行ASA-PCR扩增,分别获得含不同突变碱基的产物。第一次扩增反应:反应体系:GoTaq Green Master Mix 12.5 μL,DNA 样品 5 μL(约 100 ng),相应引物 1 对各 1 μL,无菌双蒸水 5.5 μL,总体积 25 μL。PCR 反应条件:94℃预变性3 min,94℃变性30 s,按照表2选择相应的温度退火30 s,72℃延伸30 s,共35~40个循环;72℃延伸7 min。4℃冷藏保存。第二次扩增反应:反应体系:GoTaq Green Master Mix 12.5 μL,首次扩增产物的稀释液5 μL,相应引物1对各1 μL,无菌双蒸水5.5 μL,总体积25 μL。PCR反应条件:94℃预变性3 min,94℃变性30 s,再按表2选择相应的温度退火30 s,72℃延伸30 s,共35~40个循环;72℃延伸7 min。4℃冷藏保存。

表1 MDR1引物序列
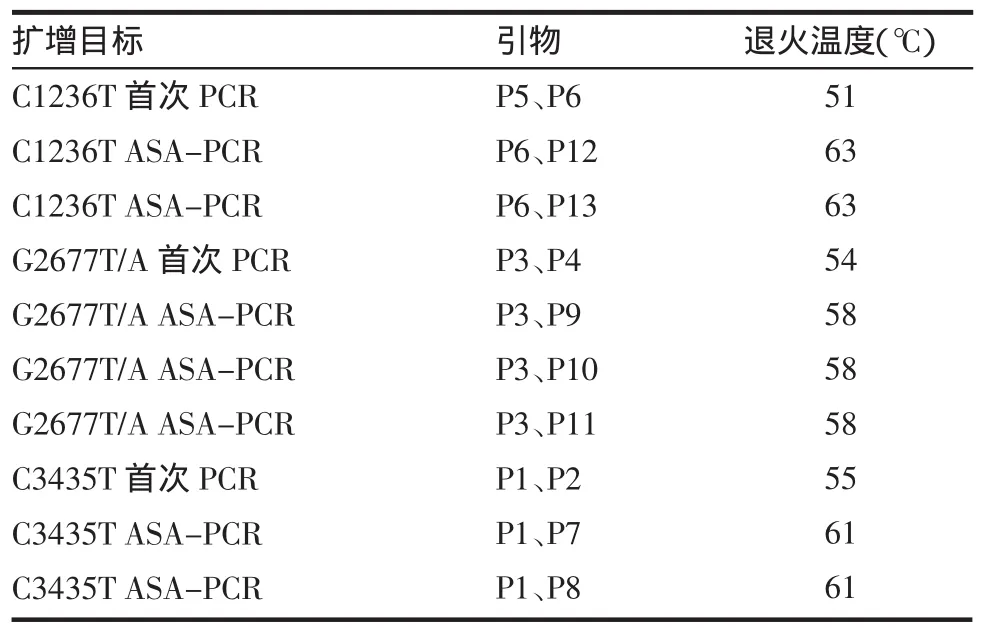
表2 MDR1基因各外显子PCR反应的引物及退火温度
1.3 数据处理及统计分析 血药浓度数据采用中国药科大学药代中心编写的BAPP2.2软件处理,求算出每个受试者的药动学参数,所有数据采用均数±标准差(±s)表示。采用 Kruskal-Wallis秩和检验(SPSS15.0软件包)比较分析不同基因型组之间异维A酸人体动力学参数的差别。
2 结果
2.1 异维A酸人体药代动力学参数 21例受试者单次口服40 mg异维A酸胶丸后的主要药代动力学参数包括血药峰浓度(Cmax)、血药浓度达峰时间(Tmax)、消除半衰期(T1/2)、平均滞留时间(MRT)、血药浓度-时间曲线下面积(AUC),见表3。经体质量校正使血药浓度标准化,以排除受试者体质量对血药浓度的影响。
2.2 MDR1基因的扩增结果
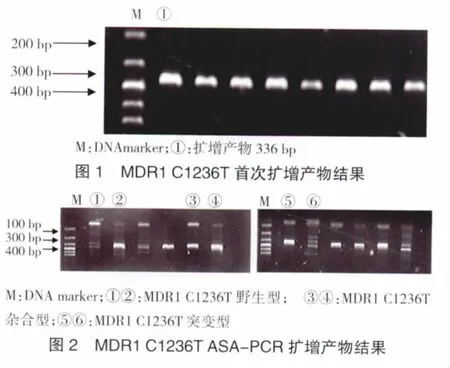
2.2.1 MDR1 exon12(C1236T)ASA-PCR扩增结果 MDR1 C1236T首次扩增产物片段为336 bp,第二次选用引物P6-P12或P6-P13的扩增产物均为223 bp。P12为0、P13为223 bp的样本为CC型(野生型),P12、P13均为223 bp的样本为CT型(杂合型),P12为223、P13为0的样本为TT型(突变型)。首次扩增结果见图1,ASA-PCR扩增结果见图2。
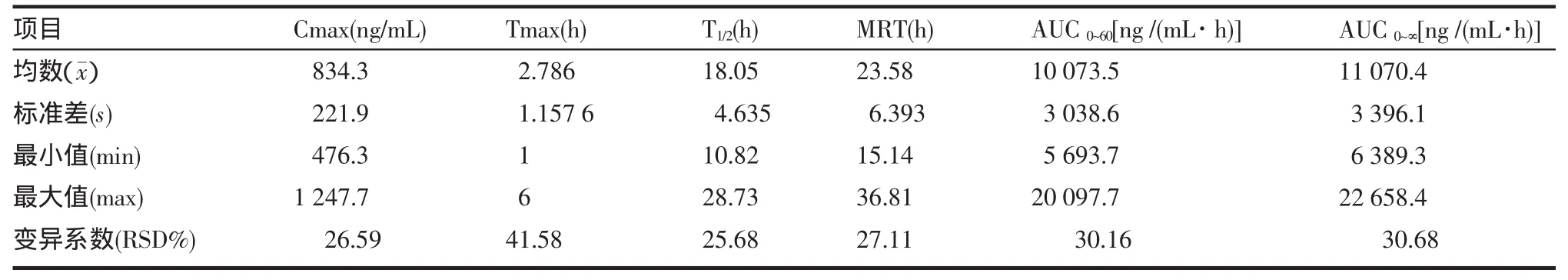
表3 21例受试者单次口服40 mg异维A酸胶丸后异维A酸的主要药代动力学参数
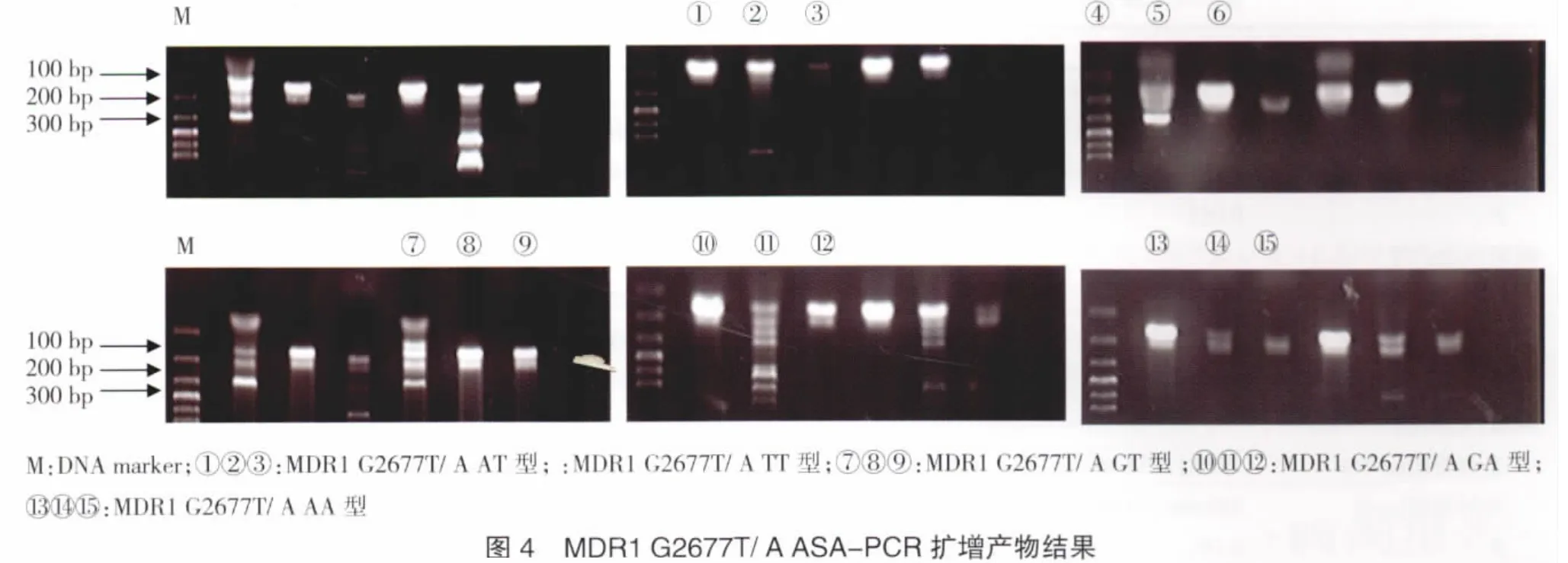
2.2.2 MDR1 exon21(G2677T/A)ASA-PCR扩增结果 MDR1 G2677T/A首次扩增产物片段为225 bp,第二次扩增选用引物P3-P9、P3-P10、P3-P11的扩增产物均为163 bp。根据ASA-PCR扩增的结果,按表4可将此位点分为6种基因型。首次扩增结果见图3,ASA-PCR扩增结果见图4。
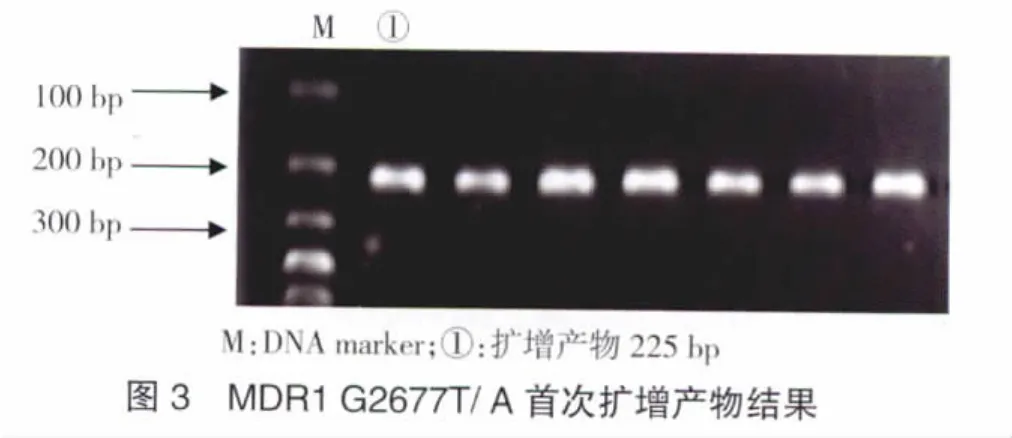

表4 基因型的分型确定

2.2.3 MDR1 exon26(C3435T)ASA-PCR扩增结果MDR1 C3435T首次扩增产物片段为248 bp,第二次选用引物P1-P7或P1-P8的扩增产物均为210 bp。P7为0、P8为210 bp的样本为CC型(野生型),P7、P8均为210 bp的样本为CT型(杂合型),P7为210、P8为0的样本为TT型(突变型)。首次扩增结果见图5,ASA-PCR扩增结果见图6。

表5 MDR1exon12(C1236T)基因多态性分布情况
2.3 MDR1等位基因多态性分布情况 21例受试者的测定结果见表 5~7,MDR1exon12(C1236T)CC型11例(52.4%),CT型 7例(33.3%),TT型 3例(14.3%)。MDR1exon21(G2677T/A)GG 型 0例(0%),GT型1例(4.8%),TT型7例(33.3%),GA型4例(19.0%),AT型 7例(33.3%),AA 型 2例(9.5%)。MDR1exon26(C3435T) 中 CC 型 1例(4.8%),CT型14例(67.0%),TT型6例(28.6%)。
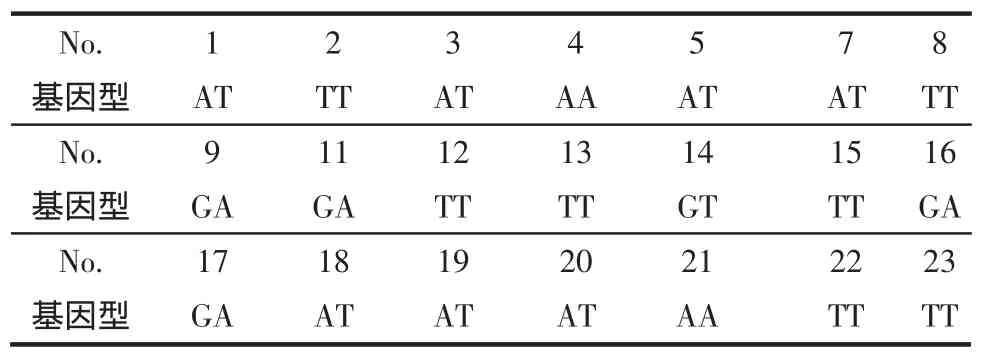
表6 MDR1exon21(G2677T/A)基因多态性分布情况
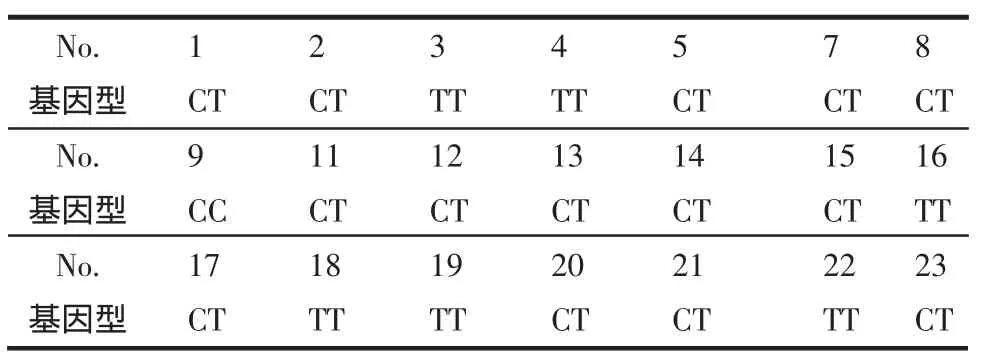
表7 MDR1exon26(C3435T)基因多态性分布情况
2.4 药动学参数与基因型关系分析 MDR1exon12(C1236T)的CC型归为野生型组,CT型(杂合型)与TT型(突变纯合型)合并为突变型组;受试人群未发现MDR1exon21(G2677T/A)GG型即野生型的存在,因此将GT型(杂合型)、GA型(杂合型)归为杂合型组,AT型(突变杂合型)、TT型(突变纯合型)、AA型(突变纯合型)归为突变型组;MDR1exon26(C3435T)的CC型在受试人群中仅检出1例,因此将CC型与CT型(杂合型)归为杂合型组,TT型(突变纯合型)为突变型组。
21例受试者的药物代谢动力学参数分别根据上述每一基因位点的基因型分组,分别进行比较分析。见表8。结果表明MDR1exon12(C1236T)的不同基因型异维A酸的体内某些药动学参数有差异。与野生型组相比,变异型组Cmax、Tmax有所增加,但差异无统计学意义(P值分别为 0.057、0.252);AUC0~60显著提高(P=0.049)、T1/2及MRT明显缩短(P 值分别为 0.011、0.035)。
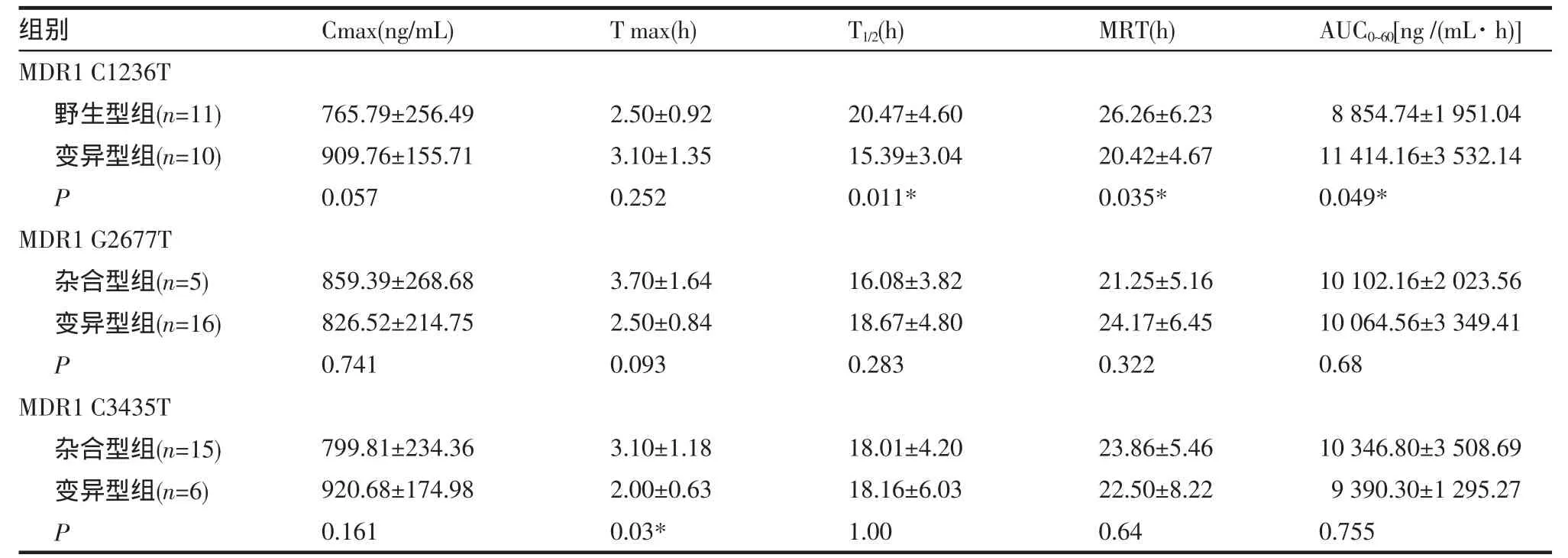
表8 MDR1等位基因多态性与异维A酸药动学参数的关系
MDR1exon21(G2677T/A)的不同基因型异维A酸的体内各项药动学参数差异无统计学意义。MDR1 exon26(C3435T)参数 T1/2、MRT 、AUC0~60在杂合型组与变异型组之间差异无统计学意义,变异型组Cmax有所增加,差异无统计学意义;变异型组Tmax显著小于杂合型组(P=0.03)。
3 讨论
P-gp是多药耐药基因(multidrug resistance 1,MDR1)的产物,属ATP结合家族。P-gp可能量依赖性地将作用底物由细胞膜内转运至细胞膜外,具有跨膜渗透泵的作用。P-gp在小肠上皮细胞、胆汁的微管细胞、脉络丛、淋巴细胞近曲小管表面的肾细胞等许多组织有表达,故对脂溶性药物的肠道吸收、药物及(或)代谢物经肾、胆汁、肠道的排泄过程均有参与。近年多项研究证实遗传因素在个体间P-gp表达和功能的差异中扮演了重要角色[7]。MDR1基因位于人染色体7q21.1~21.12,基因全长约209kb,由28个外显子编码1280个氨基酸,分子质量为170ku。已发现的 48个 SNPs中,外显子 21、26、12的G2677T/A、C3435T、C1236T的单核苷酸多态性具有重要的功能意义,他们间的连锁程度在不同种族间差异很大,具有连锁不平衡性。上述3个MDR1的基因位点在中国人群发生突变的频率较高,分别为50%(G2677T)、12.5%(G2677A)、53.1%(C3435T)、71.9%(C1236T)。MDR1的多态性直接影响P-gp的表达和功能,MDR1的两个等位基因中只要有一个的DNA链发生突变,就会使基因产物P-gp的细胞表达和功能明显下降;若两条DNA链均发生突变,P-gp的表达和功能会继续下降,但下降幅度明显减小[3-4,8]。
有关MDR1基因多态性与异维A酸人体药代动力学过程的关系研究未见报道。本研究发现MDR1 C1236T基因多态性在21名受试者中有呈现,即 CC型 11例(52.4%)、CT型 7例(33.3%)、TT型3例(14.3%)。由于变异型(TT型)样本仅为3例,而一或两条DNA链发生突变,均可使产物蛋白表达及功能的改变,从而影响异维A酸的体内过程,故将CT及TT型归为一组(称为变异型组)与CC型(野生型)进行比较分析。分析结果表明变异型组Cmax、Tmax均明显提高,但差异无统计学意义;变异型组的AUC0~60显著增加,提示变异型组P-gp的表达及功能可能下降,以上结果与文献报道的等位基因突变导致其功能改变的趋势相符合。21例受试者未发现有MDR1 G2677T/A的野生型(GG型)存在,MDR1 C3435T的野生型(CC型)也仅检出1例,这两个位点进行杂合型组与变异型组的比较分析表明:除Tmax(P值为0.03)外,其他药动学参数在这两个基因位点的不同基因型组之间无明显差异。这一结果与上述分析相符。
人体内药物代谢过程有多种酶共同参与,彼此之间的关系及(或)可能存在代偿机制,加之参与药物吸收的P-糖蛋白、药物靶细胞表面受体表位基因突变等也可影响药物体内过程[9]。本次试验研究对更深入地探讨异维A酸临床适应证疗效差异以及异维A酸药物基因组学研究有一定意义。
[1]Katsambas A,Papakonstantinou A.Acne:systemic treatment[J].Clin Dermatol,2004,22:412-418.
[2]Veal G,Rowbotham S,Boddy A.Pharmacokinetics and pharmacogenetics of 13-cis-retinoic acid in the treatment ofneuroblastoma[J].Therapie,2007,62:91-93.
[3]Kodaira C,Sugimoto M,Nishino M,et al.Effect of MDR1 C3435T polymorphism on lansoprazole in healthy Japanese subjects[J].Eur J Clin Pharmacol,2009,65:593-600.
[4]Zheng H,Webber S,Zeevi A,et al.The MDR1 polymorphisms at exons 21 and 26 predict steroid weaning in pediatric heart transplant patients[J].HumImmunol,2002,63:765-770.
[5]Drozdzik M,Stefankiewicz J,Kurzawa R,et al.Association of the MDR1(ABCB1)gene 3435C>T polymorphism with male infertility[J].Pharmacol Rep,2009,61:690-696.
[6]方洁,陈冰,张伟霞,等.肝移植中他克莫司的血药浓度与多药耐药基因多态性的关系[J].中国临床药学杂志,2009,18(2):65-69.
[7]陈西敬,王广基.药物转运蛋白在药物吸收、分布和排泄中的作用及对新药研发的意义[J].中国药科大学学报,2003,34(6):483-486.
[8]宓为峰,张鸿燕.多药耐药基因多态性对抗精神病药临床疗效影响的研究进展[J].中国新药杂志,2009,18(16):1500-1504.
[9]胡永芳,周宏灏.CYP3A4,CYP3A5和MDR1基因多态性对环孢素处置的影响[J].中国药理学通报,2005,21(3):257-261.
