γ-干扰素诱导银屑病皮损角质形成细胞MAPK活性的研究
2012-12-04杨志波唐雪勇向丽萍
杨志波,唐雪勇,向丽萍
(湖南中医药大学第二附属医院,长沙410005)
银屑病是一种常见的、原因不明的、红斑丘疹鳞屑性慢性炎症性皮肤病。其病因和发病机制复杂,研究表明银屑病的发病与γ-干扰素(interferonγ,IFN-γ)有重要关系,在银屑病患者血清及角质细胞培养上清中IFN-γ浓度明显高于正常人[1]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)广泛存在于动植物细胞内的一类丝/苏氨酸蛋白激酶,其主要作用是将细胞外刺激信号转导至细胞及其核内,并引起细胞增殖、分化、应激、凋亡等生物学反应[2]。MAPK在银屑病发病中的作用目前尚不明确,故文中对IFN-γ诱导银屑病皮损培养角质细胞中MAPK活性进行研究,探讨其在银屑病发病中的意义。
1 材料与方法
1.1 材料与试剂 γ-32P-dATP购自北京亚辉生物公司,蛋白酪氨酸激酶抑制剂(genistein,GST)购自美国Sigma公司。IFN-γ、二甲基亚砜(dimethylsulfoxide,DMSO)及其余试剂和P81膜购自上海生物工程公司等。
1.2 实验方法
1.2.1 角质形成细胞的培养 银屑病组和正常人组中角质形成细胞分别来源于我院皮肤科银屑病患者病检皮损及整形美容外科切取的正常皮肤组织。术中取下皮肤,无菌条件下剪碎,标本在DispaseⅡ(2.4 U/mL)5℃过夜孵化。组织用 Dulbecco’s PBS(含青霉素 200 IU/mL,链霉素 200 μg/mL,两性霉素 B 5 μg/mL,庆大霉素 0.1 μg/mL)冲洗,然后上皮从下层结缔组织机械分离,上皮层置于0.25%胰蛋白酶-1 mmol/L EDTA小心吸移产生细胞悬液。然后,用含10%胎牛血清的基质中和胰蛋白酶,悬液离心5 min。小丸悬浮于基质,接种到含饲养层(含有丝裂霉素处理的NIH3T3小鼠成纤维细胞)的T-25组织培养盒中。细胞在基质中培养,基质组成:3份Dulbecco’s Modified Eagle’s Medium(DMEM) 培养基,1份Ham’s F12基质含10%胎牛血清。基质用青霉素100 IU/mL,链霉素100 μg/mL,两性霉素2.5 μg/mL,表皮生长因子(EGF)10 ng/mL,氢化可的松400 ng/mL补充。每2~3 d更换1次,培养皿保持在37℃,含5%CO2潮湿环境中。当培养达到75%~80%的铺满数时,用0.5 mmol/L EDTA 37℃处理5 min除去饲养层。培养物在37℃暴露到胰蛋白酶-EDTA 1~2 min,粘连的角质形成细胞在37℃胰蛋白酶-EDTA孵化4~5 min或直到显微镜观察证实大多数细胞已分开。在胰蛋白酶失活下,用血细胞计数器确定角质形成细胞计数,然后细胞接种于组织培养基。本实验采用均为3~5代角质形成细胞。细胞因子(IFN-γ)和GST 的加入:于 3~5代银屑病角质形成细胞静息24 h后加入100 ng/mL IFN-γ作用30 min,抑制剂组在静息24 h加入10 μg/mL GST DMSO储存液,另设DMSO对照组以排除有机溶剂的影响。
1.2.2 培养角质形成细胞中MAPK活性检测MAPK粗酶的制备 从培养的银屑病皮损或正常人的角质形成细胞各5份加入溶解缓冲液(50 mmol/L β-甘油磷酸、100 mmol/L钒酸钠、2 mmol/L氯化镁、1 mmol/L乙二醇四乙酸、1 mmol/L二硫苏糖醇、1%曲拉通X-100、20 μmol/L亮抑蛋白酶肽、100 U/L抑蛋白酶肽、1 mmol/L苯甲基磺酸氟),电动匀浆,置4℃离心 1 h(100 000 r/min),取上清,用福林一酚法测蛋白浓度。采用滤纸法[3]测MAPK活性。反应总体积为 40 μL[依次加入氯化镁/GST 10 μL、底物髓磷脂碱性蛋白(MBP)10 μL、酶液 10 μL、γ-32P-dATP 10 μL],对照组不加酶液,用等量三蒸水代替,每样均设有对照,将反应管置37℃水浴15 min,加10 μL 25%三氯乙酸终止反应,每样取50 μL至P81微孔膜上,1%磷酸425 mL洗4次,丙酮漂洗、干燥后,每管加闪烁液[0.25 g四-双-二(四-甲基-五-苯基恶唑)、2 g二,五-苯基恶唑、500 mL甲苯]7 mL,用液闪计数仪测定MAPK催化γ-32P掺入底物MBP的量,MAPK的活性以pmol/(mgprotein·min)表示。
1.3 统计学分析 统计计量资料比较采用t检验,用SPSS16.0统计软件处理,P<0.05为差异有统计意义。
2 结果
培养的银屑病皮损与正常人的角质形成细胞形态相似。培养的银屑病皮损和正常人的角质形成细胞中MAPK的活性测定结果:①银屑病皮损培养角质形成细胞中MAPK的活性为(32.44±4.49)pmol/(mg protein·min),正常人为(14.65±2.19)pmol/(mg protein·min),两者相比差异有统计学意义(t=-7.966,P<0.01);②正常人组和银屑病组在IFN-γ刺激后与基础时相比MAPK的活性均明显增高,GST刺激后与基础时相比MAPK的活性明显下降,在DMSO刺激下MAPK活性两者均无明显变化;③在接受IFN-γ、GST及DMSO刺激后,正常人组和银屑病组之间MAPK活性的比较差异均有统计学意义(P<0.01)。见表 1、图 1。

表 1 IFN-γ、GST、DMSO 刺激后培养角质形成细胞MAPK的活性
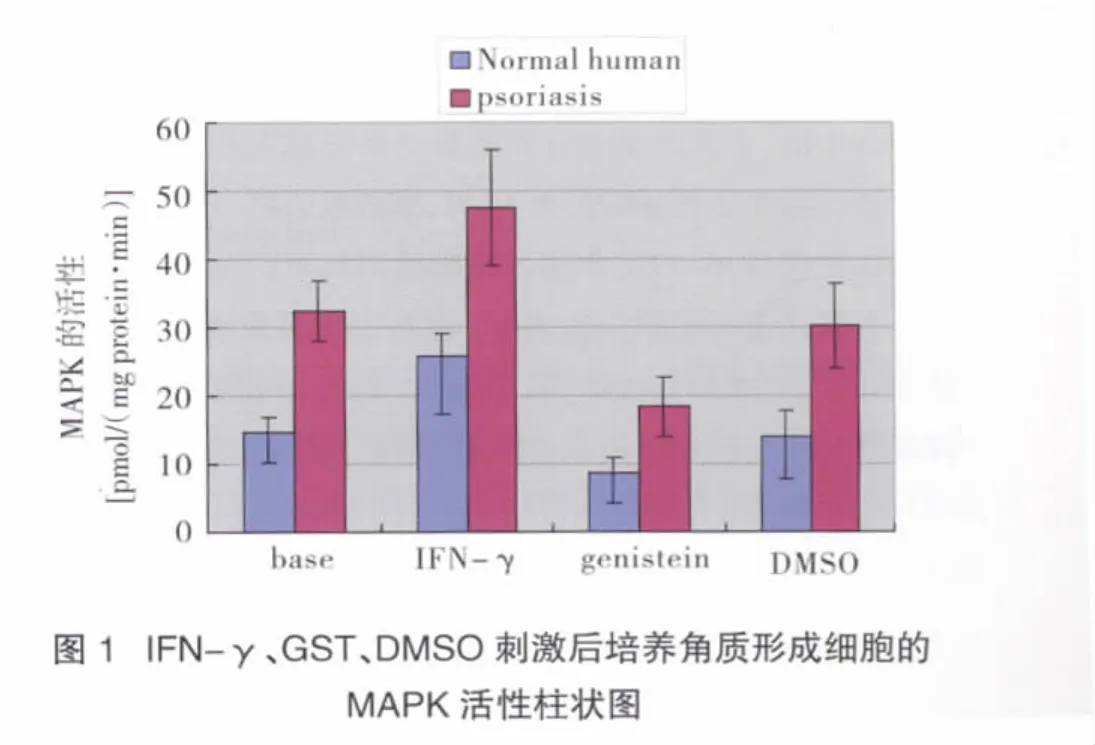
3 讨论
MAPK是一组被不同的细胞外刺激 (如生长因子、细胞因子、激素、药物及细胞应激等)激活的丝/苏氨酸蛋白激酶,MAPK通路与细胞的增殖和凋亡密切相关,对肿瘤的生长增殖起至关重要的作用[3]。多数研究显示,MAPK通路在多种恶性肿瘤中过表达,活性明显增强,在细胞增殖调控中发挥极其重要的作用[4~7]。有研究表明,银屑病患者皮损中EGF、PDGF等细胞生长因子显著高表达,高水平的生长因子可导致MAPK的激活,从而将这些细胞增殖信号传递到细胞内,最终通过磷酸化核转录因子引起细胞增殖的改变[8-9]。细胞增殖信号转导是个复杂的网络,其中MAPK虽然担任非常重要的角色,也只构成了这一复杂网络的部分,而且表皮细胞同时暴露于多种不同的刺激中。因此银屑病表皮细胞的增殖过速可能是由多种因素综合作用的结果,但是银屑病患者皮损中高水平的生长因子可使MAPK过度激活,从而产生表皮细胞过度增殖的效应[10],说明MAPK可能参与了银屑病表皮细胞过度增殖的调节。本研究结果表明,与正常人相比,银屑病皮损角质形成细胞中MAPK的活性明显增高。在加入IFN-γ刺激后,银屑病组及正常人组与基础时相比MAPK的活性明显增高,而在GST刺激时,两组MAPK活性较基础值明显下降,DMSO刺激下MAPK活性较基础值无明显变化。说明IFN-γ诱导MAPK活性的作用方式,可能是通过蛋白酪氨酸激酶直接或间接
促进其活性增加,从而在银屑病角质形成细胞增殖过程中起重要作用。
[1]徐丽敏,茹雪莹,吴泰相.IFN-γ与银屑病发病相关研究的Meta分析[J].中国循证医学杂志,2007,7(7):516-522.
[2]庞勤,何黎.MAPK信号传导通路与相关皮肤病[J].皮肤病与性病,2010,32(4):15-17.
[3]Johnson GL,Lapadat R.Mitogen-activated protein kinase pathways mediatedbyERK,JNK,andp38proteinkinases[J].Science,2002,298:1911-1912.
[4]Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J].N Engl J Med,2004,351:337-345.
[5]高泽俊,袁小青,沈捷,等.MAPKs通路在Leptin促人乳腺癌细胞系增殖中的机制研究[J].南京医科大学学报(自然科学版),2008,28(11):1410-1414.
[6]梁荔,盛红光,刘雯.MAPK信号转导通路在DHA诱导胃癌细胞凋亡中的作用[J].中国现代普通外科进展,2009,12(12):26-29.
[7]刘雯,马金龙,林万润.MAPK信号转导蛋白在高温致神经管畸形中的表达[J].中国病理生理杂志,2010,26(3):472-476.
[8]Santos SD,Verveer PJ,Bastiaens PI.Growth factor-induced MAPK networktopologyshapesErkresponsedeterminingPC-12 cell fate[J].Nat Cell Biol,2007,9:324-330.
[9]赵海生,顾军.MAPK信号转导通路与银屑病[J].中国皮肤性病学杂志,2007,21(3):184-186.
[10]Johansen C,Kragballe K,Westergaard M,et al.The mitogenactivated protein kinases p38 and ERK1/2 are increased in lesional psoriatic skin[J].Br J Dermatol,2005,152:37-42.
