八角茴香中莽草酸提取工艺的优化
2012-12-03张迎刘军海刘燕飞李燕柳仁民
张迎,刘军海,*,刘燕飞,李燕,柳仁民
(1.聊城大学化学化工学院,山东 聊城 252059;2.聊城大学 农学院,山东 聊城 252059)
莽草酸又称毒八角酸,学名为3,4,5-三羟基-1-环己烯-1-羧酸(3,4,5-trihydroxy-1-cyclohexene-1-carboxylic acid),结构式相对分子质量为174.15。莽草酸为白色精细粉末,易溶于水,在25℃下100 mL水中可溶解18 g,难溶于苯、氯仿和石油醚。熔点为191℃~192℃,旋光度为-180°。莽草酸主要存在于八角茴香、马尾松、侧柏等天然植物中,尤以八角茴香中含量相对较多[1]。莽草酸具有镇痛、抗菌、抗血小板凝集、抗肿瘤、抗血栓形成和抗脑缺血等作用[2-5]。因此,提取莽草酸对开发和利用我国丰富的八角茴香资源具有十分重要的意义。
响应面分析法(RSM)是利用合理的试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最佳工艺参数,解决多变量问题的一种统计方法[6]。以水为溶剂利用响应面分析法优化八角茴香中的莽草酸提取最佳工艺条件。
1 材料与方法
1.1 仪器与材料
1.1.1 材料
八角茴香:产于广西,购于本地集贸市场。莽草酸对照品(98%):购于阿拉丁试剂有限公司;高碘酸(AR),高碘酸纳(AR),氢氧化钠(AR),亚硫酸钠(AR)。
1.1.2 仪器
TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;数显恒温水浴锅HH-6:国华电器有限公司;DKB-501A型超级恒温水槽:上海精密实验设备有限公司;AR-1104电子天平:奥克斯国际贸易上海有限公司;循环水式多用真空泵:郑州长城科工贸有限公司;QE-200高速中药粉碎机:武义县屹立工具有限公司。
1.2 方法
1.2.1 八角茴香莽草酸提取工艺流程
八角茴香→粉碎(过筛)→八角茴香粉末→提取回流→抽滤→滤液→测定吸光度
1.2.2 八角茴香莽草酸的提取方法
准确称取八角茴香粉末约2.0 g,置250 mL圆底烧瓶中,加入一定量的蒸馏水,在实验条件下回流提取,然后抽滤得滤液,滤液用蒸馏水定容于250 mL容量瓶中,精确量取0.2 mL溶液定容于10 mL容量瓶,测定其吸光度。
1.2.3 分析测定方法[7]
1.2.3.1 标准曲线的绘制
精密称取莽草酸对照品34.80mg,置于1000mL容量瓶,加蒸馏水溶解并稀释至刻度。准确移取0.2mmol/L的莽草酸标准曲线 0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL于10 mL容量瓶中,分别加入0.5%的HIO4水溶液和0.5%的Na2IO4水溶液各1.25 mL,摇匀,于37℃放置30 min后冷却,加入0.056 mol/L的Na2SO3和1 mol/L的NaOH(体积比2∶3)混合液定容至刻度。在室温下,立即读取该溶液在382 nm处的吸光度值(A)。得到标准曲线的回归方程为:C=40.9836A-0.0574,R2=0.9995,在 0~55.68μg/mL 的范围内,浓度(C)与吸光度(A)有良好的线性关系,标准曲线如图1所示。
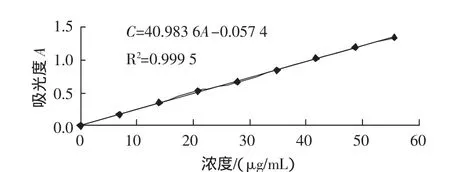
图1 标准曲线Fig.1 Standard curve
1.2.3.2 莽草酸提取率的测定
取一定体积的八角茴香提取液置于10 mL容量瓶中,分别加入0.5%的HIO4水溶液和0.5%的Na2IO4水溶液各1.25 mL,摇匀,于37℃放置30 min后冷却,加入0.056 mol/L的Na2SO3和1 mol/L的NaOH(体积比2∶3)混合液定容至刻度。在室温下,立即读取该溶液在382 nm时的吸光度值,从回归方程中计算提取液中莽草酸的含量。提取率用下式计算:

2 结果与讨论
2.1 提取时间对提取率的影响
分别称取20目的八角茴香粉末约2.0 g,6份。固定提取温度 80 ℃,料液比 1∶20(g/mL),分别提取 0.5、1.0、1.5、2.0、2.5、3.0 h后,提取 1 次,结果如图 2 所示。
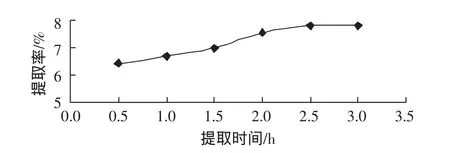
图2 提取时间对莽草酸提取率的影响Fig.2 Effect of extraction time on extraction rate
从图2可以看出,随着提取时间的增加,莽草酸提取率不断提高,但是当提取时间达到2.5 h后,提取率基本上增加很少。所以在实际的提取过程中要考虑时间效率和成本因素,提取时间取2.5 h左右为宜。
2.2 料液比对提取率的影响
分别称取20目的八角茴香粉末约2.0 g,5份。固定提取温度80℃,提取时间1 h,分别在料液比1∶8、1∶14、1∶20、1∶26、1∶32(g/mL)下回流,提取 1 次,结果如图3所示。
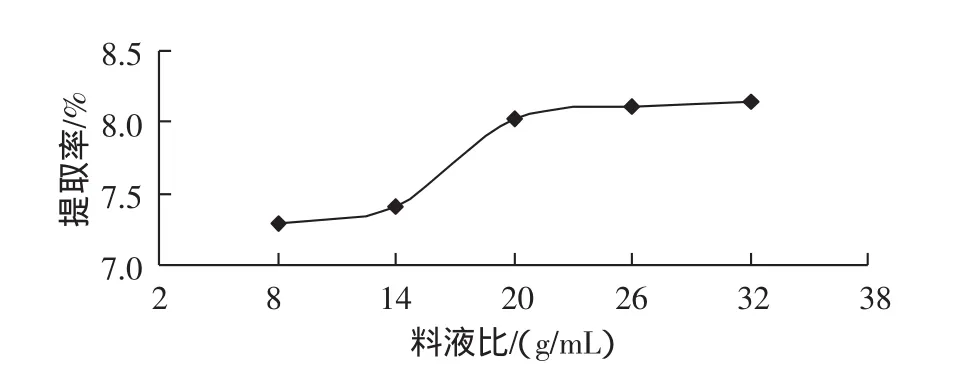
图3 料液比对莽草酸的影响Fig.3 Effect of the ratio of material to solvent on extraction rate
从图3可以看出,料液比越大,莽草酸的提取率越大。当料液比达到1∶20(g/mL)时后,提取率增加很少。料液比过小,溶剂不能有效润湿样品,影响莽草酸的提取;料液比过高,增加后续蒸发处理的困难,操作成本增加。因此,适宜的料液比取1∶20(g/mL)左右为宜。
2.3 提取温度对提取率的影响
分别称取20目的八角茴香粉2.0 g,5份,固定料液比为 1∶20(g/mL),提取时间为 1 h,提取温度分别在 50、60、70、80、90℃下提取,提取 1次,结果如图4所示。
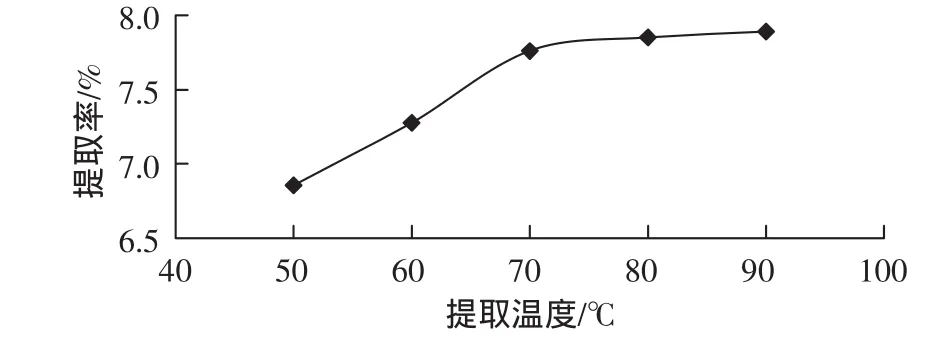
图4 温度对莽草酸吸提取率影响Fig.4 Effect of extraction temperature on extraction rate
从图4可以看出,莽草酸的提取率随提取温度的升高而增大。但是当提取时间达到70℃后,基本上提取率保持不变。所以在实际的提取过程中要考虑时间效率和操作成本因素,所以在实际的工业生产中采用70℃左右为宜。
2.4 原料粒度对提取率的影响
分别称取过20目、40目、60目筛的八角茴香粉末约2.0g,各1份,分别在提取温度80℃,提取时间为1h,料液比为1∶20(g/mL)下,提取1次,结果如图5所示。
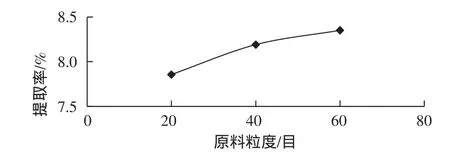
图5 原料粒度对莽草酸提取率的影响Fig.5 Effect of particle size on extraction rate
从图5可以看出,原料粉碎得越细,莽草酸的提取率越高,但是,粒数过细,增加处理困难,采用60目左右的八角茴香粉末来提取莽草酸为宜。
2.5 提取次数对提取率的影响
称取60目的八角茴香粉末约2.0 g,1份。在固定提取温度 80 ℃,提取时间为 1 h,料液比为 1∶20(g/mL)的情况下,分别提取 1、2、3、4、5 次,结果如表 1 所示。
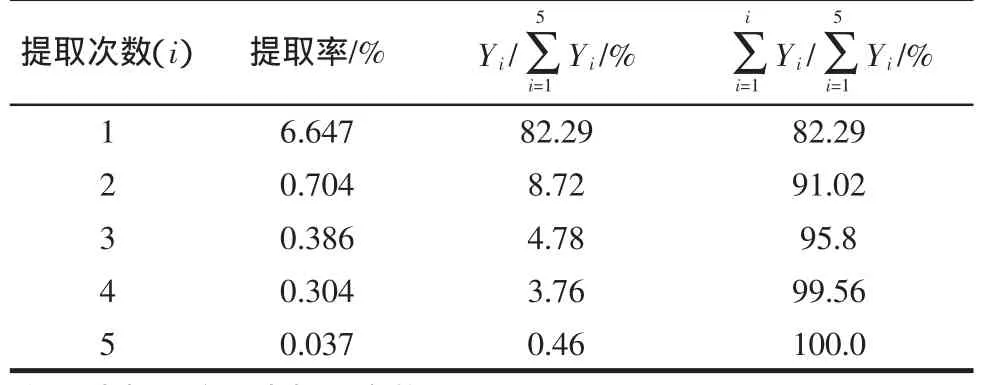
表1 提取次数比对莽草酸的影响Table 1 Effect of extraction times on extraction rate
从表1可以看出,莽草酸的总提取率随着提取次数的增加而增大,经过5次提取已基本提取出来,3次提取即可提出总量的95%,考虑生产成本及效率等方面的因素,所以认为提取3次比较合适。
2.6 实验方案设计与工艺优化
根据Box-Benhnken的中心组合实验设计原理[6,8],采用响应面实验设计方法,选取提取时间、料液比、提取温度等3个影响莽草酸提取率的主要因素,设计三因素三水平的响应面分析。在固定原料粒度为60目,提取次数为1次的情况下,考察3个因素对莽草酸提取率的影响,试验因子水平编码表如表2所示。

表2 响应面分析因子及水平表Table 2 Factors and levels of RSM
对提取时间、料液比、提取温度作如下变换。
式中:Z1、Z2、Z3分别表示提取时间、料液比、提取温度。在单因素试验基础上,以X1、X2、X3为自变量,以莽草酸提取率(Y)为响应值,采用SAS RSREG程序进行响应面分析实验。实验设计与结果如表3所示。
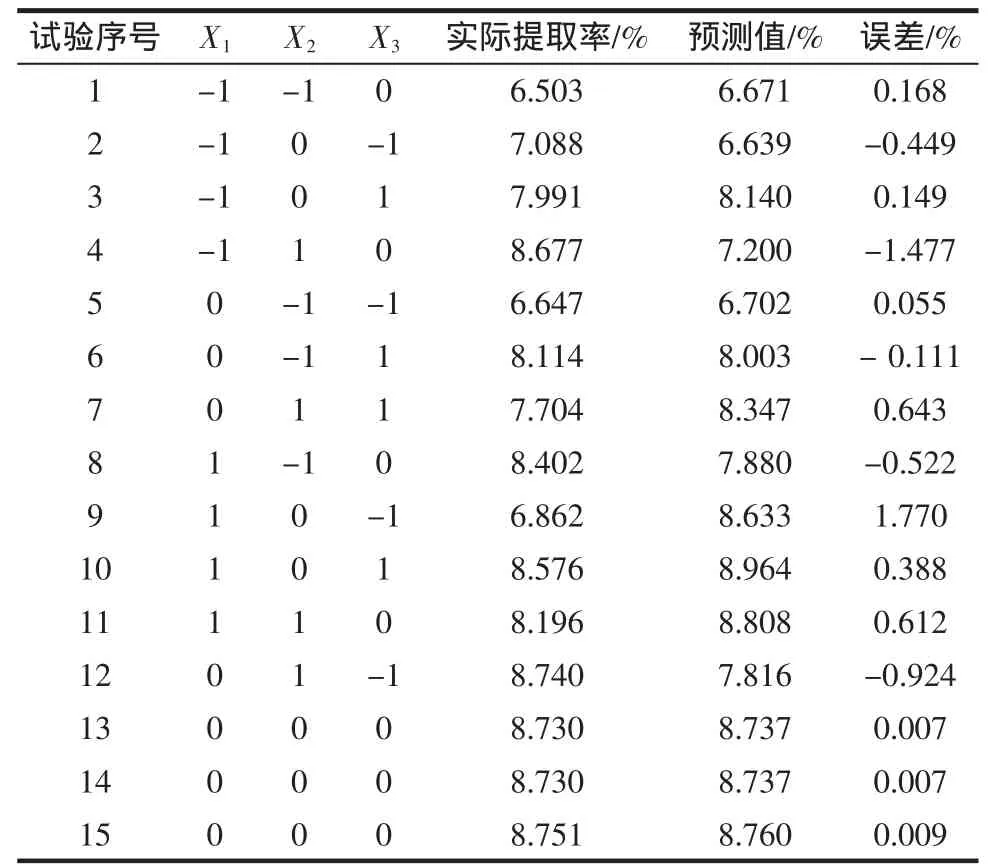
表3 响应面分析方案及试验结果Table 3 Program and experimental results of RSA
其中1~12是析因试验,13~15是中心试验,用来估计试验误差。采用SAS 8.0软件处理上述试验设计所得响应面与等直线见图6~图8。
采用SAS RSREG程序对响应值与各因素进行回归拟合后,得到回归方程:
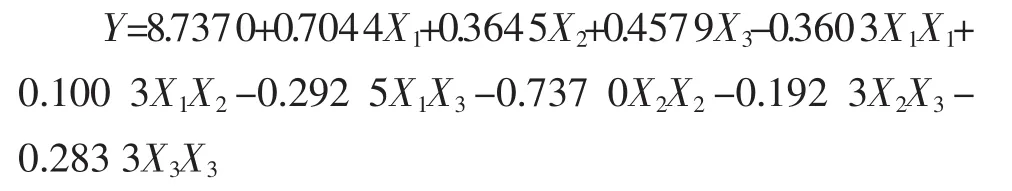
回归分析结果见表4,回归方程中各变量对指标(响应值)影响的显著性,由P检验来判定,概率P(Pr>F)的值越小,则相应变量的显著程度越高。
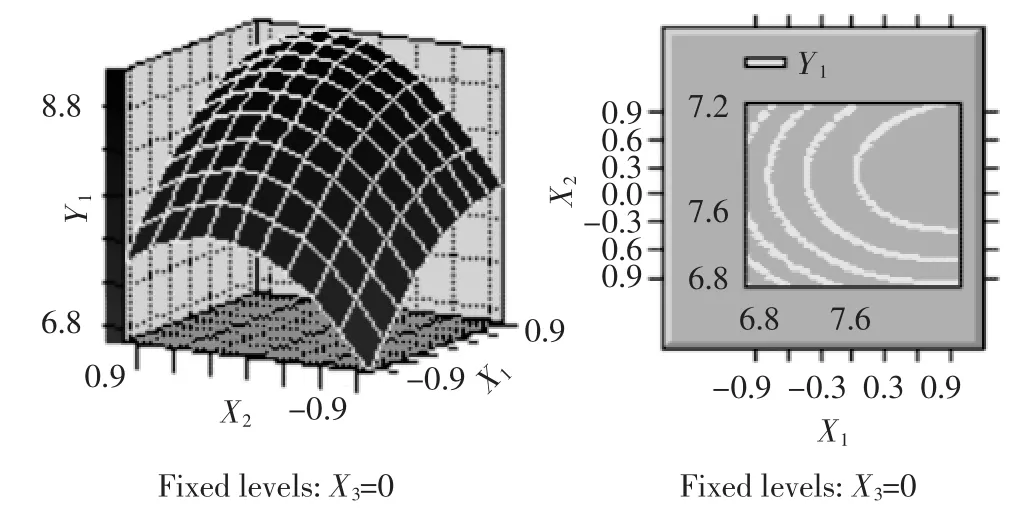
图6 提取时间(X1)和料液比(X2)对提取率影响的响应面与等值线Fig.6 Responsive surfaces and contours of Z=f(Xl,X2)
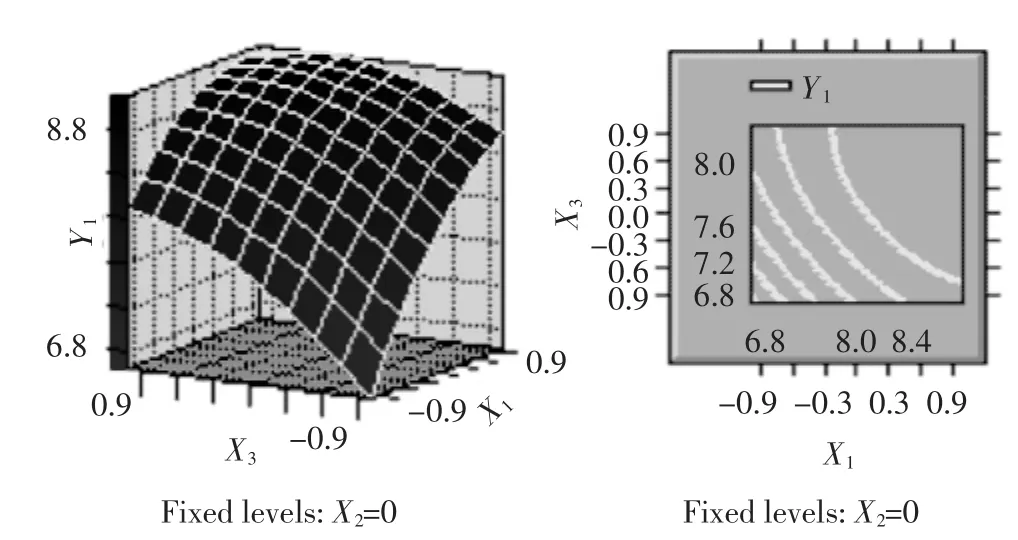
图7 提取时间(X1)和提取温度(X3)对提取率影响的响应面与等值线Fig.7 Responsive surfaces and contours of Z=f(Xl,X3)
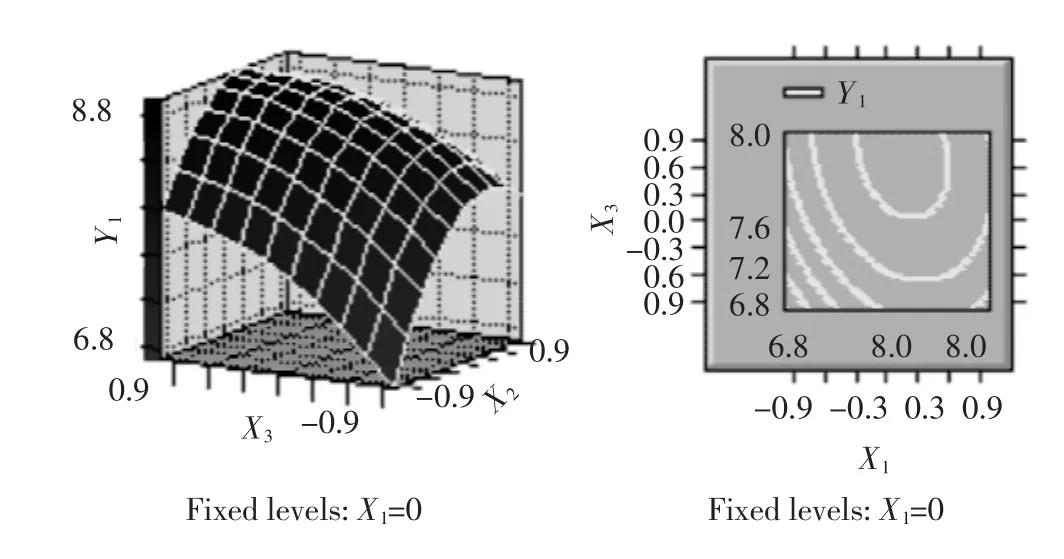
图8 料液比(X2)和提取温度(X3)对提取率影响的响应面与等值线Fig.8 Responsive surfaces and contours of Z=f(X2,X3)
由表4可见,各因素中一次项X1,X2,X3和二次项X2X2都是高度显著的,二次项X1X1,X3X3和X1X3显著,因此各具体实验因子对响应面的影响不是简单的线性关系。回归方程也是高度显著的,相关系数R2=97.80%,说明响应值(提取率)的变化有97.80%来源于提取时间、料液比和提取温度3个变量。因此,回归方程可以较好地描述各因素与响应值之间的真实关系,可以利用该回归方程确定最佳工艺条件。对回归方程取一阶偏导数等于零,整理可得:
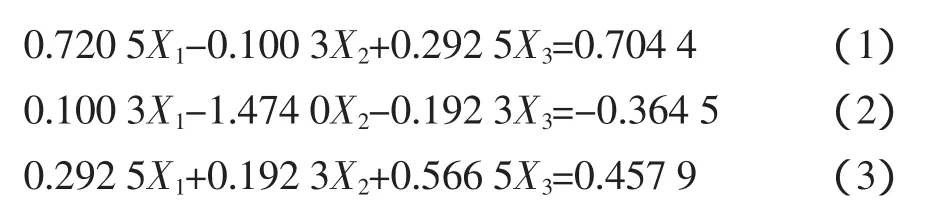
解联立方程组得:X1=0.9195,X2=0.2783,X3=0.2393。代入前述的变换公式得到最佳提取时间为2.92 h,料液比为 1∶21.67(g/mL),提取温度为 82.39 ℃,为了操作的方便,将其修正为提取时间3.0 h,料液比1∶22(g/mL),提取时间为 83℃,即八角茴香莽草酸提取工艺最佳工艺条件为:提取时间为3.0 h、料液比为1∶22(g/mL)、温度为 83 ℃。该模型的 R2=0.9780,此模型与实际试验拟合较好,试验失拟项小,因此可用该回归方程代替实验真实点对实验结果进行分析。用此数学模型预测最佳条件下的提取率为8.873%。实验提取率与理论预测值结果见表3。
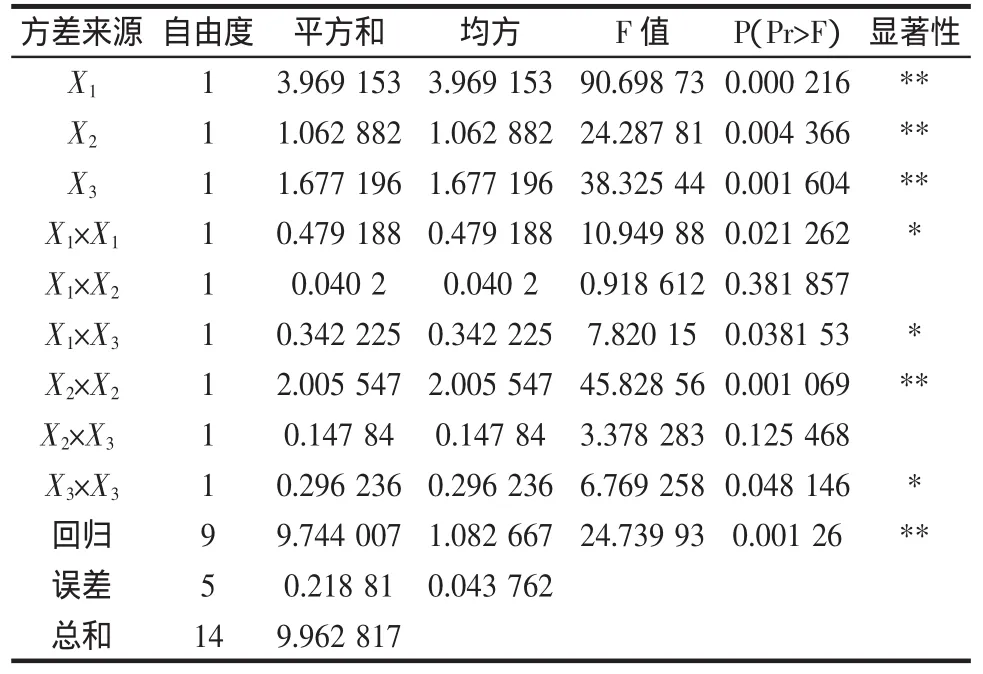
表4 莽草酸回归分析结果Table 4 Results of regression analysis
2.7 最优条件下验证
准称3份八角茴香粉末,每份约2.0 g,分别在最佳提取条件:提取时间 3.0 h、料液比为 1∶22(g/mL)、温度为83℃下提取1次,结果如表5所示。
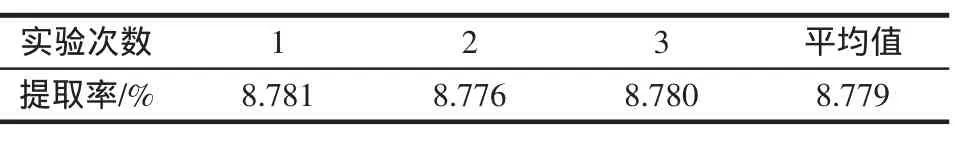
表5 最佳条件的实验结果Table 5 The experimental results in the optimum extraction conditions
由表5可见,莽草酸在最佳条件下一次提取率为8.779%,由数学模型得到理论预测值为8.873%,实际提取率比理论预测值仅低了0.094%。因此,建立的二次回归模型能很好地预测莽草酸的提取率。
3 结论
通过中心组合试验设计和响应面分析法,能可靠地进行优化试验以及数据分析。应用这一方法对莽草酸提取的工艺条件进行优化,取得了较好的效果。在单因素试验基础上,通过中心组合试验,设计三因素三水平响应面分析法试验。最终得到二次回归方程,确定出八角茴香莽草酸的最佳提取条件为:提取时间为 3.0 h,料液比是 1∶22(g/mL),提取温度是 83 ℃;单因素实验确定其最佳提取次数为3次。在最佳提取工艺条件下的一次提取率为8.779%,一次提取理论预测值为8.873%。实际提取率比理论预测值仅低了0.094%,因此该二次回归数学模型能准确的预测八角茴香中莽草酸的提取率。
[1]陈骁熠,袁利,王敏,等.马尾松、侧柏和八角茴香中的莽草酸含量分析[J].湖北农业科学,2009,48(5):1238-1240
[2]Fang A Q,Demain A L,Wong G K.Enhancement of the antifungal activity of rapamycin by the coproduced elaiophylin and nigericin[J].The journal of antibiotics,2000,53(2):158
[3]林洁,兰琪欣,韦应芳,等.八角茴香药用成分的提取及其镇痛作用的实验研究[J].右江民族医学院学报,2008,30(2):195-196
[4]Huang F,Xiu Q.Anti-platelet and anti-thrombotic effects of triacetyl shikimic acid in rats[J].Journal of cardiovascular pharmacology,2002,39(2):262-270
[5]Ma Yi,Xu Qiu-Ping,Sun Jian-Ning.Antagonistic effects of shikimic acid against focal cerebral ischemia injury in rats subjected to middle cerebral artery thrombosis[J].Acta Pharmacologica Sinica,1999,20(8):696-700
[6]高洪霞,刘军海,于波涛.响应面分析法优化辣椒红色素提取工艺条件[J].食品研究与开发,2009,30(10):177-181
[7]TH克罗马蒂,ND波尔格.莽草酸的检测方法:中国,00806428.8[P].2002-05-29
[8]徐效圣,潘俨,傅力,等.响应面法优化水酶法提取核桃油的工艺条件[J].食品与机械,2010(2):92-96
