LC-MS/MS测定大鼠血浆中黄藤素含量及其药代动力学研究
2012-12-01田开鑫肖丹彭衡阳刘天强
田开鑫,肖丹,彭衡阳,刘天强
黄藤素(fibrauretin),也叫巴马汀(palmatine),系从中药植物黄藤的干燥茎中提取得到的一种季胺盐异喹啉类生物碱。它主要存在于防己科、芸香科、毛茛科和小檗科及旋花科植物中,但以防己科的黄藤含量最高,可达 3% 左右。黄藤素呈黄色针状结晶,味极苦,在热水中易溶但在水中略溶。黄藤素一般通过 NaCl 盐析分离和纯化制得,因此,它常以盐酸盐的形式存在[1]。临床上,黄藤素主要用于抗菌消炎,在泌尿生殖系统[2]、呼吸系统[3]、消化系统[4]及外科感染等方面有着广泛应用。此外,黄藤素还具有抗病毒、提高免疫、抗心律失常等药理作用[5]。血浆内黄藤素的测定方法较多,先后出现了紫外分光光度法[6]、高效液相色谱-荧光检测(HPLC-FLU)法[7]、(RP)-HPLC 法[8]等。但是,由于黄藤素体内吸收很差,相对于肌肉注射,其口服生物利用度仅为1.31%[9-10],而现有的黄藤素检测方法大多灵敏度较低,难以达到黄藤素体内浓度的检测。而且样品的处理大多要经过萃取并加入内标,操作繁琐,或者需要利用固相萃取而使分析成本高昂。鉴于此,本研究拟建立一种灵敏、专一、快速的黄藤素大鼠血浆中含量测定的方法,为黄藤素的药动学研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要仪器 Agilent 1200 系列高压快速分离液相系统和Agilent 6410BQQQ 三重四级杆质谱均为美国 Agilent公司产品。
1.1.2 药品及试剂 黄藤素(纯度 ≥ 95%)购于陕西森弗高科实业有限公司;黄藤素标准品(批号:110732-200506)购于中国药品生物制品检定所;乙腈、甲酸均为色谱纯,为美国 Fisher公司产品;水为重蒸水,自制;其他常规试剂均为分析纯。
1.1.3 实验动物 雄性 SD 大鼠,体重(220±20)g,由四川省医学科学院实验动物中心提供,合格证号:SCXK(川)2008-21。
1.2 方法
1.2.1 色谱条件 色谱柱:Zorbax Eclipse XDB-C18600 Bar(1 Bar=100000 Pa)2.1 mm×50 mm,1.8 μm;流动相:水(含 0.1% 甲酸)∶乙腈(70∶30);流速:0.3ml/min;进样量:1 μl。
1.2.2 质谱条件 离子源:电喷雾离子源(ESI),正离子模式检测;干燥气温度:350 ℃,裂碎电压151 eV,碰撞池电压 28 eV;干燥气流速:10ml/min;毛细管电压:4000 V,雾化气压力:45 psi(1 psi=6.895 kPa)。检测离子:352-336。
1.2.3 标准品溶液的制备 称取黄藤素标准品适量,精密称定,置于5ml 棕色量瓶中,用乙腈溶解并定容至刻度,得到 2.21 mg/ml 储备液。将储备液用乙腈分别稀释,制得浓度为:0.442、2.21、4.42、11.05、22.1和44.2 ng/ml的标准品溶液。
1.2.4 给药及生物样品处理 取雄性 SD 大鼠5只,灌服 40 mg/kg 黄藤素,分别于灌胃后0.08(5 min)、0.5、1.0、2.0、4.0、6.0、8.0、10.0、12.0、24.0和36.0 h 眼底静脉取血,置于预先肝素化的离心管中,离心后取血浆置于涂有 1% 肝素钠的离心管中,2620×g 离心 5 min,吸取血浆 100 μl,加入 3 倍量乙腈,涡旋振荡(80 r/min)10 min,7280×g,离心 10 min,取上清液进样。
1.2.5 体内分析方法的建立
1.2.5.1 专属性考察 取空白血浆 + 标准品、空白溶剂、空白血浆分别按照“1.2.4”中样品的处理方法处理,考察方法的专属性。
1.2.5.2 线性关系考察 吸取空白血浆 100 μl,分别加入 20 μl 不同浓度的黄藤素标准溶液,按上述“1.2.4”中样品的处理方法进行处理和测定,记录黄藤素的峰面积 Ai,以 x=黄藤素浓度(ng/ml)对 y=Ai 进行线性回归。
1.2.5.3 精密度考察 取空白血浆 100 μl,分别添加高、中、低 3 种浓度的黄藤素对照品溶液(2.21、11.05、44.2 ng/ml)作为质控样品(Qc);每批质控样品各 5个,连续测定 3 批(每天测定1 批次)。用随行标准曲线计算 Qc 样品的测定浓度,经方差分析求得本法的精密度。
1.2.5.4 稳定性考察 取配制的高、中、低 3 种浓度的黄藤素 Qc 样品,分别在室温(20 ℃)和–20℃ 保存,室温保存样品在4和8 h取样,–20 ℃ 保存样品在第 7 天取样,分别进行色谱测定。对每一个浓度取 5个样本分析,测定黄藤素含量,初始含量为C1;室温下放置4 h 后黄藤素的含量为C2;室温下放置8 h 后黄藤素的含量为C3;–20 ℃下放置7 d 后黄藤素含量为C4,以 Ci/C1计算不同条件下样品的稳定性。

图1 空白血浆 + 标准品(A)、空白溶剂(B)、空白血浆(C)的多级反应监测模式(MRM)色谱图Figure1 The representative chromatograms of (A) a blank rat plasma sample with fibrauretin (5 ng/ml) and (B) a blank acetonitrile solution sample and (C) a blank rat plasma sample
1.2.5.5 回收率 方法回收率:取配制的高、中、低 3 种浓度生物样品,每一个浓度各 5个样本。按照“1.2.4”中样品的处理方法进行处理,所得样品峰面积代入标准曲线方程计算所得浓度与加入的浓度之比即得方法回收率(%)。提取回收率:取配制的高、中、低 3 种浓度生物样品,每浓度各 5个样本。按照“1.2.4”中样品的处理方法进行操作,所测得峰面积,与相应浓度黄藤素乙腈溶液直接进样所测得峰面积相比得提取回收率(%)。
1.3 药物动力学参数计算方法及统计学分析方法
根据所获得的血药浓度-时间数据,用 DAS 2.0进行处理,拟合血药浓度-时间曲线模型,并采用统计矩计算出各项药代动力学参数。
2 结果
2.1 体内分析方法的建立
2.1.1 专属性 结果见图 1,说明空白血浆中的内源性物质及空白溶剂对样品测定无干扰。
2.1.2 线性关系 以血药浓度对峰面积建立回归方程,得到血浆样品中黄藤素的标准曲线。由表1可知,血浆中黄藤素浓度在0.442~44.2 ng/ml 内浓度与峰面积之间有良好的线性关系(r2>0.999)。
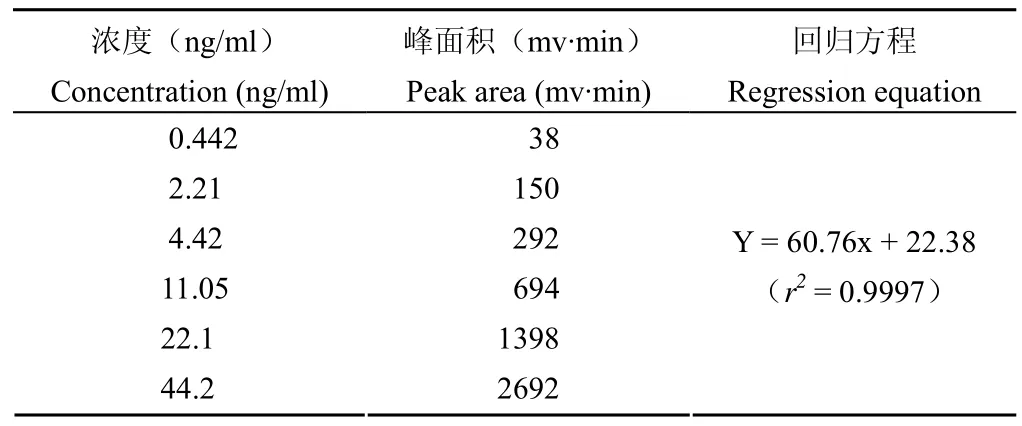
表1 黄藤素在血浆中的线性关系Table1 Linear relationship of fibrauretin in rat plasma
2.1.3 精密度 经方差分析求得本法的精密度,数据见表2。结果表明,测定血浆中次乌头碱浓度的分析方法符合日内和日间 RSD 均小于15%的要求,该方法可用于黄藤素的大鼠体内药动学试验。
2.1.4 稳定性 结果见表3,样品在室温 8 h 内较稳定,–20 ℃ 冰冻及冻融条件均较稳定。
2.1.5 回收率 方法回收率:结果见表4;提取回收率:结果见表5。由表中数据可见方法回收率与提取回收率均为85%~115%,符合生物样品分析方法要求。
2.2 药时曲线
大鼠灌胃 40 mg/kg 黄藤素后,利用上述测定方法测定大鼠血浆中的黄藤素含量,以血药浓度理论模拟值与试验测定值的相关系数 r2最大和AIC 最小为标准,结果大鼠灌服黄藤素的药动学符合二室模型,其平均血药浓度-时间曲线见图 2。

表2 血浆中黄藤素 LC-MS 测定法的精密度考察Table2 Precision results of LC-MS method of fibrauretin in plasma

表3 血浆样品稳定性考察Table3 Stability of rat plasma sample

表4 方法回收率结果Table4 Analytical recovery of fibrauretin in rat plasma

表5 提取回收率结果Table5 Extraction recovery of fibrauretin in rat plasma

图2 大鼠灌胃后黄藤素的血药浓度-时间曲线Figure2 Mean ( ) plasma concentration-time curve of fibrauretin in rats (n=5) after an oral administration of 40 mg/kg fibrauretin
2.3 药动参数
黄藤素口服后,大鼠血药浓度-时间数据经统计矩计算其主要药代动力学参数,结果见表6。
由图 2和表 6 可知,本实验建立的黄藤素LC-MS/MS 测定方法可以用于黄藤素的体内药动学研究。

表6 口服黄藤素在大鼠体内的药物动力学参数Table6 The pharmacokinetic parameters of fibrauretin in rats (n=5) following an oral administration of 40 mg/kg fibrauretin
3 讨论
本实验建立了大鼠血浆中黄藤素 LC-MS/MS测定方法,该方法专一性好,灵敏度高,操作方便易行,并应用所建立的方法成功地检测了黄藤素大鼠灌胃后的血药浓度,用 DAS2.0 计算了其药动学参数。所建立的方法不需使用内标,采用乙腈直接沉淀蛋白法处理血浆样品而非萃取法,使操作方便、简单;而且使用高压快速液相分离系统,使分析时间降低到 2 min,因此,我们建立的黄藤素体内分析方法真正达到了快速、方便,为其体内研究提供了基础。
[1]Tang AL, Liu XF, Feng DM.Extracted using the boiling method and the cold soak method the composition of palmatine in fibrauretin comparative study.Acat Med Sinica, 2003, 16(1):75-76.(in Chinese)唐爱莲, 刘笑甫, 冯冬梅.用煎煮法和冷浸法对黄藤中巴马丁成分提取的比较研究.华夏医学杂志, 2003, 16(1):75-76.
[2]Wu YR.Clinical observation on treating 102 cases of chronic pelvic inflammatory disease with fibrauretine injection.Guiding J TCM,2007, 13(6):46, 49.(in Chinese)伍幼如.黄藤素注射液治疗慢性盆腔炎102例临床观察.中医药导报, 2007, 13(6):46, 49.
[3]Wu CY, Zhang Y, Shi W, et al.Clinical observation on treating acute upper respiratory tract infection disease with fibrauretine tablet.China Med Herald, 2009, 6(5):168.(in Chinese)吴春艳, 张艳, 史伟,等.黄藤素片治疗急性上呼吸道感染临床观察.中国医药导报, 2009, 6(5):168.
[4]Wu CY, Zhang Y, Shi W, et al.Clinical observation on treating acute diarrhea disease with fibrauretine tablet.China Med Herald, 2009,6(9):43-44.(in Chinese)吴春艳, 张艳, 史伟,等.黄藤素片治疗急性腹泻的临床疗效观察.中国医药导报, 2009, 6(9):43-44.
[5]Bhadra K, Maiti M, Kumar GS.Molecular recognition of DNA by small molecules: at base pair specific intercalative binding of cytotoxic plant alkaloid palmatine.Biochim Biophys Acta, 2007,1770(7):1071-1080.
[6]Zhou M, Yang XL, Cheng ZT.Determination of palmatine hydrochloride in fibrauretinum injection by UV spectrophotometry.Chin J Synthetic Chem, 2001, 9(4):379-381.(in Chinese)周敏, 杨秀兰, 成中太.紫外分光光度法测定黄藤素注射液中盐酸巴马汀含量的探索.合成化学, 2001, 9(4):379-381.
[7]Zhang H, Yu C, Hong YC, et al.Determination of palmatine in serum by HPLC-FLU.Acta Pharm Sinica, 2000, 35(7):518-520.(in Chinese)张慧, 余琛, 洪有采,等.HPLC-FLU 法测定血清中黄藤素的含量.药学学报, 2000, 35(7):518-520.
[8]Jin CH, Jiang XH, Xu T, et al.Assay method for sustained-release palmatine tablet in beagle dog.China Pharm, 2009, 20(6):420-421.(in Chinese)金朝辉, 蒋学华, 徐珽,等.黄藤素缓释片在Beagle犬体内测定方法研究.中国药房, 2009, 20(6):420-421.
[9]Zhou Y, Jiang XH.The absorption kinetics of Palmatine in stomach and intestines of rat.West China J Pharm Sci, 2006, 21(2):168-169.周玥, 蒋学华.黄藤素在大鼠胃肠道中的吸收动力学.华西药学杂志, 2006, 21(2):168-169.
[10]Huang JM, Wang GQ, Jin YE, et al.Determination of palmatine in canine plasma by liquid chromatography-tandem mass spectrometry with solid-phase extraction.J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 854(1-2):279-285.
