树突状细胞诱导的CIK 细胞对肺癌生长的抑制作用
2012-12-01陈诗萍买世娟余杏娟柯妙拉夏建川高秋
陈诗萍,买世娟,余杏娟,柯妙拉,夏建川,高秋
随着现代分子生物技术和肿瘤免疫学的发展,生物治疗已成为继手术、化疗、放疗后的第 4 种肿瘤治疗模式。当前肿瘤生物治疗技术包括分子靶点药物、单克隆抗体、细胞因子、细胞免疫治疗和基因治疗。肺癌的生物治疗依次经历了细胞因子(如 IL-2)疗法、肿瘤杀伤细胞[如自体细胞因子诱导杀伤细胞(cytokine-induced killer,CIK)]的过继免疫治疗、肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)疗法和单克隆抗体疗法,但效果均不理想。根据肿瘤细胞与免疫细胞之间的信号传导及抗原呈递过程方面的研究,无论何种生物治疗方法,宿主体内的抗原加工与呈递是诱发宿主免疫系统抗肿瘤免疫的核心。迄今为止,树突状细胞(dendritic cell,DC)是所发现的功能最强的抗原呈递细胞(APC)。有关研究已表明肺癌组织及外周血中 DC的数目与肺癌的预后呈成正相关,可是大多数肺癌组织中有 DC的数量减少或功能缺陷,因此考虑体外培养 DC 并用抗原刺激制备肿瘤疫苗,用于治疗术后残余病灶或微转移的患者。但由于肺癌是实体瘤,抗原性较弱,DC 疫苗的疗效还未肯定,所以有必要通过实验观察 DC 诱导的抗肺癌免疫作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂 淋巴细胞分离液为天津美德太平洋科技有限公司产品;GT-T561 无血清培养基为日本 TaKaRa公司产品;GM-CSF、IL-4、IL-1、IL-2干粉为北京四环生物制药有限公司产品;TNF-α、IFN-γ、CD3 购自广州英韦创津生物科技有限公司;用 GT-T561 无血清培养基配成溶液。
1.1.2 仪器 JEM-2100F 型透射电镜为日本电子株式会社产品;CYTOMICS FC500 型流式细胞仪为美国贝克曼公司产品。
1.1.3 实验动物 SPF 级 BALB/C 裸小鼠50只,雌雄兼用,鼠龄 4~6周,体重 16~18 g,由中山大学医学院实验动物中心繁殖传代(合格证:粤检证字 2002A009)。饲养条件:恒温,空气层流过滤。
1.2 方法
1.2.1 小鼠肺癌移植瘤模型建立 肺癌手术标本剪切成 2 mm×2 mm×2 mm的组织块,接种裸鼠双侧背部皮下,模型建成后以等量移植瘤组织接种裸鼠,筛选有肿瘤生长的裸鼠以肿瘤体积为主要参数按照随机的原则分组予以处理。计算公式为肿瘤体积=π/6(a+b)3,其中 a 为肿瘤长径,b 为肿瘤短径。
1.2.2 病理分析 取裸鼠肺癌移植瘤组织做病理切片,HE 染色观察确定肿瘤类型,并与患者手术标本的病理切片比较。
1.2.3 DC 培养及负载 取用于建立裸鼠移植瘤的肺癌标本的同一患者的外周血,以淋巴细胞分离液常规分离,所得的单个核细胞用 GT-T561 无血清培养基重悬并调整细胞浓度为6×106个/ml,置37 ℃、5% CO2培养箱中静止培养 1 h。贴壁的细胞成分中加入含有 IL-4(30 ng/ml)、GM-CSF(50 ng/ml)和庆大霉素(80 IU/ml)的GT-T561 无血清培养基培养,在培养的第 2、4、6 天补加含IL-4(30 ng/ml)和GM-CSF(50 ng/ml)的培养基。将同一患者手术切除的肺癌组织用反复冻融的方法制备肿瘤细胞裂解物,在培养第 8 天加到DC 细胞中,浓度为100 mg/L,4 h 后加入工作浓度为10 ng/ml的TNF-α,培养 24 h 以刺激 DC成熟。
1.2.4 CIK 细胞培养及诱导 上述未贴壁细胞中加入含庆大霉素(80 IU/ml)、IFN-γ(50000 IU)的GT-T561 无血清培养基中,第 2 天补加入细胞因子 IL-1、IL-2和CD3,使终浓度分别为50 ng/ml、50000 IU/ml和5μg/ml。培养第 5 天补加含 IL-2的GT-T561 无血清培养基,在培养第 9 天,以 DC 与CIK 细胞 1∶10的比例将肿瘤细胞裂解物负载的DC 加入 CIK 细胞中,继续培养,所得的细胞为DC-CIK 细胞。
1.2.5 倒置显微镜及透射电镜观察 DC 细胞 每天应用倒置显微镜观察 DC 及CIK 细胞生长情况。收集 DC,用 2% 多聚甲醛和22.5% 戊二醛混合液前固定,经 PBS 漂洗后,用 1% 锇酸后固定,梯度乙醇脱水、渗透,LR White 树脂包埋,超薄切片,醋酸铀枸橼酸铅双重染色,透射电镜观察。
1.2.6 细胞表型分析 单个核细胞培养第 5 天及抗原刺激后收获 DC,用 PBS 洗涤重悬后加入PE 或 FITC 标记的CD1a、HLA2DR、CD80、CD86、CD14 鼠抗人单抗,于培养第 5 天和第10 天即与DC 共孵育 24 h 后收获 CIK 细胞,用PBS 洗涤重悬后加入 CY5-PE、PE 或 FITC 标记的CD3、CD4、CD8 及CD56 鼠抗人单克隆抗体,4 ℃ 孵育 30 min,用 PBS 洗涤 2 次,重新悬浮,流式细胞仪检测。分析软件为ELITE,样本细胞数不少于5×105个。
1.2.7 荷瘤裸鼠处理及处理后观察 按照随机分组原则将裸鼠分为4组,分别为DC-CIK组、CIK组、DC组和NS组(生理盐水对照组),每组9只。于裸鼠肿瘤同侧腋窝皮下分别注射 DC-CIK细胞、未经诱导的CIK 细胞和DC。注射剂量为1×106个/只,注射液体总量为0.1ml/只。对照组注射等量生理盐水。每星期观察肿瘤生长情况2 次,直至处理后约 1个月,处死裸鼠称取肿瘤重量,计算抑瘤率。
抑瘤率=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%
1.3 统计学分析
2 结果
2.1 动物模型的建立
成功建立肺癌移植瘤模型,肺癌手术标本和裸鼠移植瘤组织 HE 染色比较,两者病理类型一致,但移植瘤的肿瘤恶性程度增加(图 1)。
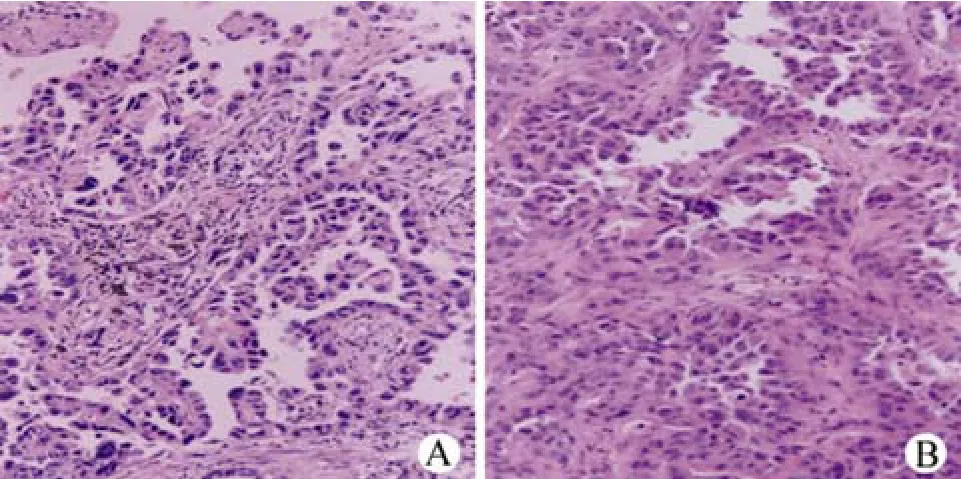
图1 肺癌患者手术标本与裸鼠肺癌移植瘤的病理学比较(×200)(A:高分化乳头状肺癌标本;B:裸鼠移植瘤组织)Figure1 Pathological comparison between resected sample of lung cancer patient and implanted tumor in nude mice (×200)(A: Resected sample of lung cancer patient was diagnosed as well-differentiated palillary adenocarcinoma; B: Xenografted tumor in nude mice)
2.2 DC的形态及细胞表型结果
细胞培养 24 h 后可见有少数细胞悬浮;第3~4 天悬浮细胞较多,聚集成团,细胞体积增大,形态不规则,长条形多见,有突起;培养第 6~7 天时细胞体积增大明显,呈多边形,长的突起增多;于培养第 7 天及与肿瘤抗原共孵育 1 d 后透射电镜观察,可见 DC 有大量长短不一的突起由胞体伸出,细胞核呈肾形并偏于一侧,常染色质增多,胞浆内富含线粒体和粗面内质网,较少溶酶体。与肿瘤抗原共孵育后,可观察到 DC 细胞体积增大,突起增多增长,包绕并吞噬肿瘤细胞裂解物的现象(图 2)。
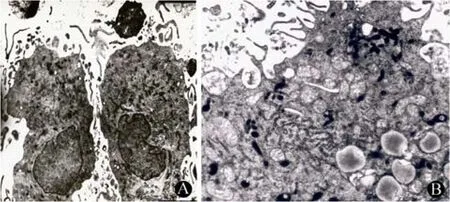
图2 透视电镜观察 DC的超微结构(A:DC 典型形态×2400;B:DC 捕获抗原×6400)Figure2 Transmission electron microscopy of cultured DC[A: Typical appearance of DC (×2400); B: DC capturing antigen (×6400)]
培养第 5 天,HLA2DR、CD14 表达较高,CD80 表达量较低。抗原刺激后CD86 表达较高,CD80 及HLA2DR 表达增加,CD1a 也有表达,CD14 表达有所降低(表1)。说明加入肿瘤抗原刺激后细胞表型有变化,因此,经肿瘤细胞裂解物负载的DC是成熟型。

表1 DC 细胞表型结果Table1 Surface phenotype of DC cells
2.3 CIK 细胞的形态及细胞表型结果
培养第 3 天,CIK 细胞数目增多,体积也增大;第 7 天可见有细胞集落形成;当 DC 与CIK细胞共孵育 24 h 后所得的细胞即为DC-CIK 细胞,可见 CIK 细胞围绕在DC的胞体及突起周围。培养第 7 天电镜观察细胞核较大,核浆比例大,细胞核中异染色质较多,胞浆内细胞器较少。培养第 5 天及与肿瘤细胞裂解物负载的DC 共孵育后检测 CD3、CD4、CD8 及CD56 抗原表达率,加入抗原刺激前后CD3、CD4 变化不明显,而CD8 表达升高,CD56 表达降低(表 2)。

表2 CIK 细胞表型分析Table2 Surface phenotype of CIK cells
2.4 DC 诱导的CIK 细胞对肺癌移植瘤的生长抑制
肺癌移植瘤在裸鼠体内传第 4 代时取等量移植瘤组织接种裸鼠,4组裸鼠肿瘤平均瘤重、瘤体积和肿瘤生长抑制率见表3。DC-CIK 细胞对肿瘤的生长有抑制作用,且较 CIK 细胞的抑制作用更强(P<0.05)。
3 讨论
本实验采用外周血作为DC 来源,用 75 cm2培养瓶贴壁的培养方法,并且应用自体血浆作为DC 生长必需的营养来源。该法优点是取材方便,制备过程简单,避免了应用异种血清 FBS 对 DC的干扰。本实验应用患者自身手术切除标本作为肿瘤抗原来源,比较了抗原负载前后的表面抗原表达情况,刺激前 CD80 表达率较低,刺激后HLA2DR、CD80 显著升高,表明该法制备的DC 已经成熟。成熟与未成熟 DC的功能不同,未成熟 DC 捕获抗原的能力较强,但激发 T 细胞免疫反应能力较差,成熟的DC 具有较强的抗原呈递功能,能将抗原呈递给肿瘤抗原特异性 T 细胞,产生特异性的抗肿瘤免疫应答。本实验制备的肿瘤抗原可以刺激DC 成熟并且使数量扩增,培养前后比较扩增率为4~5 倍。另外,本实验从外周血一次分离所得的单个核细胞中,以贴壁的单核细胞作为DC的前体细胞,同时未贴壁的淋巴细胞用来培养 CIK 细胞,合理利用各种细胞成分,不致造成细胞浪费,减轻患者负担。培养所得的CIK 细胞通过光镜观察发现细胞扩增明显,采用流式细胞仪表型分析 CIK细胞与DC 共孵育前后抗原表达率的变化,CD3表达率升高、CD4 变化不明显,而 CD8 表达则有所升高,CD16/56 表达率明显下降,说明 DC-CIK主要是表型为CD3+、CD8+的T 细胞,与报道中 CIK 细胞主要是 NK和T 细胞的说法不同,可能与肿瘤相关抗原 (TAA)-DC能特异性诱导CD8+ 细胞有关。
表3 DC-CIK 对肺癌裸鼠移植瘤生长的抑制作用( )Table3 The antitumor effect of DC-CIK cells on xenografted tumor in nude mice ( )

表3 DC-CIK 对肺癌裸鼠移植瘤生长的抑制作用( )Table3 The antitumor effect of DC-CIK cells on xenografted tumor in nude mice ( )
实验组Groups肿瘤平均体积(cm3)Average volume (cm3)肿瘤平均重量(g)Average weight (g)抑制率(%)Inhibition rate (%)P 值P value DC-CIK 0.3183±0.32 0.4700±0.38 70.3 0 CIK 0.9836±0.31 1.0522±0.25 33.5 0.053 DC 0.9871±0.38 1.3000±0.25 17.9 0.291 NS 1.7134±1.32 1.5833±0.99 – –
由于裸鼠体内 T 细胞免疫缺陷,选用裸鼠实验对象消除了动物体内 T 细胞的干扰,另外实验中以肺癌患者手术标本建立移植瘤模型,能够更好地模拟患者体内情况,而且病理分析也发现移植瘤与手术标本病理类型一致,但是病理分级升高,这与患者术后微小残余病灶的复发或者转移的情况相似。所以本实验实际上是以裸鼠为媒介模拟患者体内情况,观察 DC-CIK的体内抗肿瘤作用,做到观察的个体化。用肺癌手术切除标本建立移植瘤模型的过程中,发现传代后接种成瘤率约为75%,所以本实验不能预先观察 DC 对肺癌移植瘤发生的预防作用,只能观察其对移植瘤的生长抑制作用。
实验过程中发现,在处理后的第 15 天左右,DC-CIK组中肿瘤开始较快地生长,这说明了DC-CIK 对体积较小的肿瘤抑制作用明显,而随着肿瘤体积增大,这种抑制作用减小。因而临床上 DC应当用于治疗手术后微小残余病灶和微转移病灶,而且应当缩短注射的间期。本实验通过荷瘤裸鼠体内抗瘤实验证实了 DC-CIK 细胞抗肺癌作用明显高于CIK 细胞的作用,提示 DC-CIK 细胞治疗是更为有效的抗肺癌生物治疗方法,为DC 疫苗用于临床治疗提供了理论依据。
[1]Li MS, Yuan AL, Pan DC, et al.Dendritic cell induce immune response to inhibit growth and occurrence of tumor implanted in nudes.Chin J Gastroenterol Hepatol, 1999, 8(4):259-260.(in Chinese)李明松, 袁爱力, 潘德春,等.树突状细胞诱导抗胃癌移植瘤免疫.胃肠病学和肝病学杂志, 1999, 8(4):259-260.
[2]Li MS, Yuan AL, Zhang YL.Immune response induced by dendritic cells pulsed with tumor extracts in vivo inhibit growth of implanted tumor and reject challenge of tumor cells in nudes.Chin J Cancer Biother, 1998, 5(3):204-207.(in Chinese)李明松, 袁爱力, 张亚历.树突状细胞体外诱导抗肝癌免疫抑制裸鼠人肝癌细胞系HepG2移植瘤发生与生长.中国肿瘤生物治疗杂志, 1998, 5(30):204-207.
[3]Li MS, Yuan AL.Dendritic cells induce efficient and special immune response against tumor in vitro.Pract J Cancer, 1998, 13(2):83-85.(in Chinese)李明松, 袁爱力.树突状细胞体外诱导高效而特异的抗肿瘤免疫.实用癌症杂志, 1998, 13(2):83-85.
[4]Gao Q, Li JT, Wang SY, et al.Proliferation and identification of the dendritic cells from the peripheral blood of patients with lung cancer.Chin J Lung Cancer, 2003, 6(2):119-123.(in Chinese)高秋, 李锦添, 王思愚,等.肺癌患者外周血树突状细胞的体外扩增及鉴定.中国肺癌杂志, 2003, 6(2):119-123.
[5]Ba DN.Modern immunological technology and application.Beijing:Union Publishing Company of Beijing Medical University and Peking Union Medical College, 1998:620.(in Chinese)巴德年.当代免疫学技术与应用.北京: 北京医科大学、中国协和医科大学联合出版社, 1998:620.
[6]Luo RC, Han HX.Tumor biotherapology.Beijing: People’s Medical Publishing House, 2006.(in Chinese)罗荣城, 韩焕兴.肿瘤生物治疗学.北京:人民卫生出版社, 2006.
[7]Zhang HL, Xi YZ, Kong FH.The singnal transduction and blockade of T cell activation.Immunol J, 2000, 16(4):S5-S8.(in Chinese)张惠丽, 奚永志, 孔繁华.T细胞激活的信号转导及阻断.免疫学杂志, 2000, 16(4):S5-S8.
