链霉菌I06A-00625发酵产物的提取分离、结构鉴定及活性研究
2012-12-01贾贝何宁赵莉莉余利岩蒋忠科姜蓉
贾贝,何宁,赵莉莉,余利岩,蒋忠科,姜蓉
铜绿色假单胞菌(Pseudomonas aeruginosa)是假单胞菌属中的代表菌种,是一种重要的院内感染条件致病菌,常常感染免疫力低下的病人,引起菌血症、肺炎、泌尿系统感染。由于铜绿色假单胞菌外膜通透性低并存在着外排多种物质的主动外排系统(active efflux systems),使得其具有先天的多重耐药性[1],临床治疗十分困难,一旦感染,死亡率很高,已经成为临床医生面临的治疗难题之一。因此,迫切需要发现新的抗铜绿色假单胞菌的药物。
前期的研究结果发现链霉菌 I06A-00625(cpcc201504)的发酵液样品具有抑制铜绿色假单胞菌生长的活性。本研究通过对 I06A-00625 发酵液抗真菌组分的分离纯化,得到 6个单一化合物,对其进行结构解析并进行抗菌活性研究。
1 材料与方法
1.1 材料
1.1.1 菌株 链霉菌 I06A-00625、铜绿色假单胞菌(ATCC 29212)、黑曲霉菌(BM,ATCC 16404)和白色念珠菌(CA,ATCC 10231)均由本所菌种中心提供。
1.1.2 种子培养基与发酵培养基 含葡萄糖 5 g,酵母膏 5 g,蛋白胨 5 g,牛肉膏 5 g,玉米浆 4 g,黄豆饼粉 10 g,碳酸钙 4 g,氯化钴 0.02 g,淀粉20 g,水 1 L,pH 7.2。
1.1.3 实验试剂及仪器 大孔吸附树脂 X-5和葡聚糖凝胶 LH-20 为上海生化试剂厂产品;Agilent 1200A 型高效液相色谱仪和半制备色谱柱(9.4 mm×250 mm,5 μm)均为美国安捷伦公司产品;UV 2550 型紫外光谱仪为日本 Shimadzu公司产品;Varian VNS-600 型 600M 核磁共振仪为瑞士瓦里安公司产品;LTQ-Orbitrap 质谱仪为美国赛默飞世尔公司产品;高效液相用色谱纯乙腈为美国 SK Chemicals公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 菌种发酵 菌种I06A-00625 于琼脂斜面培养基上 27 ℃ 培养 7 d,接种于100ml 种子培养基中,180 r/min,27 ℃ 振荡培养 48 h。以 5%的接种量转种至发酵培养基中,27 ℃,180 r/min 振荡培养 96 h,发酵终点 pH 7.5。
1.2.2 提取分离 发酵液离心,弃去菌丝体,上清液过 X-5 大孔吸附树脂,分别用无盐水、10%、30%、50%、80% 丙酮洗脱。
对各部分洗脱液进行多种抗菌活性追踪,10%丙酮洗脱液具有较好的抗铜绿色假单胞菌活性,将其浓缩后上葡聚糖凝胶 LH-20 柱,以 30% 甲醇洗脱,活性组分进 HPLC 纯化,液相条件:流动相 18% 乙腈,流速 1ml/min,检测波长 230 nm。收集保留时间为13.8 min的组分。
50% 丙酮洗脱液具有较好的抗真菌活性,浓缩后上葡聚糖凝胶 LH-20 柱,收集黄色、浅黄两个色带。浅黄色带进 HPLC 分析,液相条件:流动相 30% 乙腈,流速 1ml/min,检测波长 215 nm,分别在保留时间 26.1和28.5 min 时有两个组分。黄色色带进 HPLC 分析,液相条件:流动相 30%乙腈 35 min,37% 乙腈 20 min,流速 1ml/min,检测波长 304 nm,在保留时间 46.8、47.8和55.3 min出现 3个活性组分。
1.2.3 抗菌活性测定 采用纸片琼脂扩散法测定抗菌活性,用白色念珠菌和黑曲霉菌作为检定菌。将白色念珠菌和黑曲霉菌按 1%的比例接种于LB 培养基上。将加有 40μg/ml 样品的5 mm纸片贴于平板上,于37 ℃ 恒温箱中培养 24 h 后测量抑菌圈的大小。
2 结果
2.1 分离纯化结果
10% 丙酮洗脱液分离得到 1个具有抗铜绿色假单胞菌的活性组分,命名为I06A625A,经过初步结构鉴定确定其为核苷类化合物,具体结构正在解析。
50% 丙酮洗脱液浅黄、黄色两个色带共收集得到 5个单一组分,依次命名为206A、206B、206C、206D和206E。
2.2 活性化合物结构鉴定
206E 为白色无定形粉末,易溶于甲醇、乙腈、DMSO,不溶于氯仿、水。ESI-MS[M+H]+(m/z):696.2,根据高分辨质谱并结合1H-NMR和13C-NMR 数据确定分子式为C35H53NO13,其紫外吸收分别在291、305、319 nm 波长处有最大吸收,与四烯类抗生素的紫外特征吸收一致,可以断定其为四烯大环内酯类抗生素。根据1H-NMR和13C-NMR 谱核磁数据,查阅相关文献[2-4]后确定其为Tetramycin A,结构式见图 1。
206C 为白色无定形粉末,易溶于甲醇、乙腈、DMSO,不溶于氯仿、水。ESI-MS[M+H]+(m/z):712.3,根据高分辨质谱并结合1H-NMR 数据确定分子式为C35H53NO14,根据紫外吸收特征确定为四烯类抗生素,与206E 为同一系列化合物,根据核磁数据,查阅相关文献[2-4]后确定其为Tetramycin B,结构式见图 1。
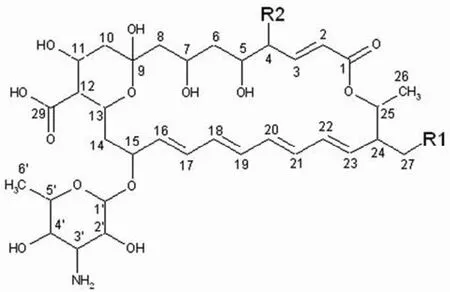
图1 206E、206C、206D的化学结构Figure1 Chemical structure of 206E, 206C and 206D
206D 为白色无定形粉末,易溶于甲醇、乙腈、DMSO,不溶于氯仿、水。ESI-MS[M+H]+(m/z):682.3,根据高分辨质谱并结合1H-NMR 数据确定分子式为C34H51NO13,与206E 为同一系列化合物,根据核磁数据,查阅相关文献[2-4]后确定其为Tetrin A,结构式见图 1。
206A 为白色无定形粉末,易溶于甲醇、氯仿、乙腈等有机溶剂,由 ESI-MS 确定分子量为242,分子式为C14H14N2O2,紫外最大吸收波长:224和294 nm,对其1H-NMR和13C-NMR 各峰进行归属后确定其为化合物 (Z)-3-benzylidenehexahydro,pyrrolo[1,2-a]pyrazine-1,4-dione[5-6]。结构式见图 2。
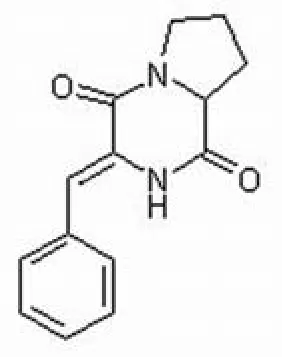
图2 206A的化学结构Figure2 Chemical structure of 206A
206B 为白色无定形粉末,易溶于甲醇、氯仿、乙腈等有机溶剂,由 ESI-MS 确定分子量为193,分子式为C11H15NO2,紫外最大吸收波长:215和275 nm,且在226 nm 处有肩峰,对其1H-NMR和13C-NMR 各峰进行归属后确定其为化合物N-(4-methoxyphenethyl) acetamide。结构式见图 3。
2.3 活性测定
2.3.1 抗铜绿色假单胞菌活性 采用纸片扩散法进行活性测定,活性组分 I06A625A 对铜绿色假单胞菌表现出了抑制活性,但其 MIC 值大于512μg/ml。
2.3.2 抗真菌活性 采用纸片扩散法测量抑菌圈直径,由表1 可知分离得到的3个四烯类抗生素对白色念珠菌及黑曲霉均有抑制活性。
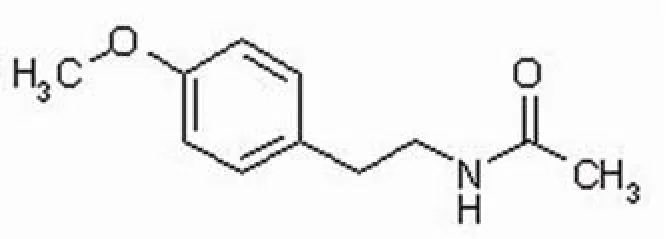
图3 206B的化学结构Figure3 Chemical structure of 206B

表1 化合物的抗真菌活性Table1 Antifungal activity of 5 purified compounds
3 讨论
本实验分离得到的化合物 206E和206C 分别为四烯大环内酯类抗生素 Tetramycin A和B,四烯类大环内酯类抗生素普遍具有较好的抗真菌作用[7]。Tetramycin 最早从 Streptomyces noursei的代谢产物中分离得到[8],随后,Radics等[3]利用核磁共振手段确定了 Tetramycin A和B的结构,并发现其对多种真菌具有较强的抑制作用,本研究也证实了其对白色念珠菌和黑曲霉菌的抑制作用。另外本研究中还发现 Tetramycin A和B 对Pseudomonas aeruginosa的SecA蛋白的ATPase 具有抑制活性,但其抑制酶活作用的机制还有待于进一步研究。
在以 3-ylidene-pyrazine-2,5-diones 为母核的衍生物合成研究中,化合物 (Z)-3-benzylidenehexahydro,pyrrolo[1,2-a]pyrazine-1,4-dione(206A)已被多次报道[9],但却是首次从天然产物中分离得到,从生源角度看可以认为是两个氨基酸形成的环肽。
N-(4-methoxyphenethyl)acetamide(206B)被报道为合成异喹啉类物质的中间体[10],此次在微生物代谢产物中发现,表明其很有可能也是生源途径合成异喹啉类的中间物质。Sachchidanand等[11]还研究过其作为先导化合物在蛋白水平上对 p53稳定性的影响,并修饰了其构型。
链霉菌 I06A-00625 产生的多种活性组分属于不同种类的抗生素,既有抗铜绿色假单胞菌的核苷类化合物,又同时产生抗真菌的四烯类化合物,这种同一株菌可以产生不同种类抗生素的现象也值得我们关注。
[1]Nicasio AM, Kuti JL, Nicolau DP.The current state of multidrug-resistant gram-negative bacilli in North America.Pharmacotherapy, 2008, 28(2):235-249.
[2]Ryu G, Choi WC, Hwang S, et al.Tetrin C, a new glycosylated polyene macrolide antibiotic produced by Streptomyces sp.GK9244.J Nat Prod, 1999, 62(6):917-919.
[3]Radics L, Incze M, Dornberger K, et al.Tetramycin B, a new polyene macrolide antibiotic: the structure of tetramycins A and B as studied by high-field NMR spectroscopy.Tetrahedron, 1982, 38(1):183-189.
[4]Zhang N, Sun CP, Song Z, et al.Isolation, purification and characterization of antifungal substances from Streptomyces hygroscopicus BS-112.Acta Microbiol Sinica, 2011, 51(2):224-232.(in Chinese)张楠, 孙长坡, 宋振,等.吸水链霉菌BS-112产生的抗真菌活性物质的分离纯化与结构鉴别.微生物学报, 2011, 51(2):224-232.
[5]Rukachaisirikul V, Sommart U, Phongpaichit S, et al.Metabolites from the Xylariaceous Fungus PSU-A80.Chem Pharm Bull, 2007,55(9):1316-1318.
[6]Jin S, Wessig P, Liebscher J.Unusual C=C bond migration in 3-ylidene-2,5-piperazinediones.Eur J Org Chem, 2000(10):1993-1999.
[7]Van Etten JL, Gottlieb D.Studies on the mode of action of tetrin A.J Gen Microbiol, 1967(46):377-387.
[8]Dornberger K, Thrum H, Radics L.The structure of tetramycin, a new polyene macrolide antibiotic.Tetrahedron, 1979, 35(15):1851-1856.
[9]Bartels A, Jones PG, Liebscher J.Stereoselective epoxidation and bromoalkoxylation with 3-ylidenepyrazine-2,5-diones.Synthesis,2003(1):67-72.
[10]Okuda K, Kotake Y, Ohta S.Neuroprotective or neurotoxic activity of 1-methyl-1,2,3,4-tetrahydroisoquinoline and related compounds.Bioorg Med Chem Lett, 2003(13):2853-2855.
[11]Sachchidanand, Resnick-Silverman L, Yan S, et al.Target structure-based discovery of small molecules that block human p53 and creb binding protein association.Chem Biol, 2006, 13(1):81-90.
