Hsa-miR-204的生物学信息分析及研究进展
2012-12-01韩泽平黎毓光何金花
韩泽平,黎毓光,何金花
MicroRNA(miRNA)是一类由 21~25个核苷酸组成的非编码蛋白质的单链小分子 RNA,它们广泛存在于真核生物中,在物种进化中相当保守,其表达具有组织特异性和阶段特异性。miRNA 基因通常位于基因间或内含子区域,在核内由 RNA 聚合酶 II 转录产生具有帽子结构多聚腺苷酸尾巴的初级 miRNA(primary miRNA,Pri-miRNA)。Pri-miRNA 在核酸酶 Drosha和其辅助因子 Pasha的作用下被处理成由 70个核苷酸组成的前体 miRNA(precurosor miRNA,Pre-miRNA),经 Ran-GTP 依赖的核质转运蛋白Exportin-5 转运到细胞质中。另一个核酸酶 Dicer 将其剪切成约 22个核苷酸长度的miRNA 双链,其中一条为成熟的miRNA 分子。成熟的miRNA 分子在细胞内与Argonaute蛋白等形成 RNA 诱导的沉默复合体(RNA-induced silencing complex,RISC),并作用于特异 mRNA的3'UTR,从而抑制翻译过程或直接降解 mRNA[1]。研究表明,miRNA通过在转录或转录后水平调节一些信号分子来实现对细胞凋亡、增殖、分化、发育和新陈代谢等的调节[2]。随着研究的不断深入,越来越多的证据显示,miRNA的表达与肿瘤的发生、发展和预后密切相关[3],它既可扮演癌基因,也可扮演抑癌基因的角色,在肿瘤组织中表达上调的miRNAs可能起到癌基因的作用,表达下调的miRNAs 可能起到抑癌基因的作用,我们以 miR-204 为探讨重点,运用生物学软件对其生物学信息及可能的调控基因进行预测,为研究其在疾病发生与发展过程中的作用提供理论依据。
1 生物学分析
1.1 miR-204的生物学信息分析
运用 UCSC和Ensembl 基因组在线浏览工具分析miR-204 在人类基因组中所处的位置,miR-204 定位于人类 9号染色体上 73424891-73425000 位置之间。成熟的单链 miRNA 分子序列为5' UUCCCUUUGUCAUCCUAUG CCU 3'(图 1)。
1.2 miR-204的序列保守性分析
我们利用 UCSC 基因组在线浏览工具分析发现,miR-204的成熟序列在人、小鼠、大鼠、大象和金鱼等脊椎动物中表现为高度保守(图 2)。
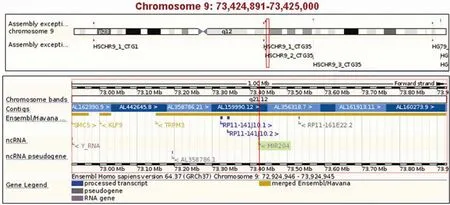
图1 运用 UCSC和Ensembl 基因组在线浏览工具分析 miR-204 在人类基因组中所处的位置
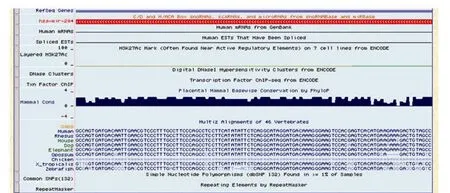
图2 miR-204 在UCSC 基因组在线浏览工具的保守性分析
1.3 Hsa-miR-204 靶基因的筛选
认识 miRNA的作用机制,关键是认识 miRNA 及其靶基因的相互作用。随着计算机生物信息学的飞速发展,miRNA 靶基因预测软件也迅速兴起并发展起来。从 2003年第一个靶基因预测软件 miRanda 面世至今,已涌现出数十种靶基因预测软件。得益于这些软件,我们对 miRNA 靶基因的寻找减少了盲目性,节约了实验成本,而且可以使我们能够更有针对性地研究感兴趣的miRNA,更加准确方便地阐明其在生命活动中的功能与意义。我们选择生物信息学方法(6个主流的miRNA 靶基因分析软件:MicroCosm、miRanda、DIANA-microT、RNAhybrid、TargetScan和RNA22)对 hsa-miR-204(humo sapiens miR-204)的靶基因进行了预测。总共预测到了 8851个 hsa-miR-204的靶基因,其中有 7个基因被 6个主流软件共同预测为hsa-miR-204的靶基因,见表1。
2 miR-204 与肿瘤的关系
近年来,研究表明 miR-204 可能成为一种新的致癌基因或抑癌基因,它通过抑制靶 mRNA 翻译或诱导靶mRNA 降解在转录后水平调控基因表达,具有癌基因或抑癌基因的功能,参与肿瘤的发生、发展及侵袭转移等过程。
2.1 作为抑癌基因
Lee等[4]认为miR-204 可能是在肿瘤相关基因组座位上能抑制头颈部鳞状上皮细胞癌变的miRNA,在头颈部鳞状上皮细胞癌(head and neck squamous cell carcinoma,HNSCC)细胞株中过表达的miR-204,通过抑制肿瘤相关靶基因的表达,并在体外抑制肿瘤的黏附、迁移和侵袭,减少了实验性肺转移的程度,发挥抑癌基因的作用。Wu等[5]应用 miRNA 微阵列方法观察了 10 例子宫内膜腺癌与邻近的非肿瘤性的内膜组织,结果表明子宫内膜腺癌与邻近的非肿瘤性的内膜组织相比 miR-205、miR-449和miR-429明显高表达,而 miR-204、miR-99b和miR-193b 明显低表达,miRNA 有可能在子宫内膜腺癌的发生中起作用,同时为子宫内膜腺癌的诊断和治疗提供一种新的思路。Chung等[6]的研究表明过表达的miR-204能抑制子宫内膜癌细胞的迁移、侵入和细胞外的黏附,并提出FOXC1是 miR-204的靶基因,其表达与子宫内膜癌细胞中 miR-204 成负相关。Chen等[7]将 miR-204 模拟物导入胆管癌细胞系中,发现外源性 miR-204 可以负向调控 BCL-2的作用,且有利于化疗药物 5-Fu 激发的细胞凋亡,此机制可能与恶性胆管癌细胞抵抗凋亡和化疗有关。此外,陈磊[8]结合激光俘获显微切割和荧光实时定量 PCR 技术进行了人肝内胆管细胞癌组织和正常胆管上皮组织中成熟小 RNA 表达及其功能的研究,证实了 miR-320和miR-204 表达能显著下调 MCL-1和BCL-2的蛋白水平,有效提高肿瘤细胞对化疗药物的敏感性。张文辉等[9]采用 miRNA 芯片检测胃远端腺癌组织与正常组织,发现 47 种miRNA 在胃远端腺癌组织中表达差异显著;并进一步采用实时荧光定量 PCR 验证了miR-204 在肿瘤组织中的下调表达;用生物学信息方法分析显示:BCL-2、NR3C1和SOCS6等可能为miR-204的靶基因。结合基因芯片及实时荧光定量 PCR 技术所观察到的miR-204 在胃远端腺癌中表达明显降低的状况,考虑其可能在胃癌的发生、发展中起抑癌基因的作用。杨建军等[10]发现在大肠癌组织及癌旁正常组织中的miRNA 存在差异表达,其中 miR-204 表现为下调。Carzon等[11]使用基因芯片技术比较 85 例AML 患者 miRNA 表达谱,其中 55 例npm 基因突变的AML(npm±AML)患者中 miR-204和miR-128a 低表达。其中 miR-204的靶基因是 hox 基因,表明 hox 基因表达上调的npm±AML 患者可能是由于缺乏 miR-204 所致。Mueller等[12]的研究发现与非侵入性同系黑色素瘤相比,高侵入性黑色素瘤的miR-204 表达明显下调。另外,Greenberg等[13]也验证了 miR-204的表达能抑制高侵入性黑色素瘤的转移。Navarro等[14]利用 RT-PCR技术分析了 49 例经典型霍奇金淋巴瘤(classical Hodgkin Lymphomas,cHL)患者的淋巴结和10 例反应性淋巴结(reactive lymph nodes,RLNs)miRNA的表达,发现 cHL和RLNs 有 25个 miRNA 表达不同,并且有 36个miRNA的表达也不一样。其中,miR-204 起下调作用。Huang等[15]研究报道 miR-204和它的同系物 miR-211 与调控间充质干细胞向成骨方向分化的特异性转录因子(runt-related transcription factor 2,Runx2)的3'UTR 区相结合,可作为Runx2 重要的内源性负性调控物,能抑制成骨作用和促进骨髓间质母细胞和骨髓基质细胞的脂肪形成,从而影响其分化,这可能与抑制肿瘤的发生有关。另外,Yanaihara等[16]证实了 hsa-miR-205、hsa-miR-99b、hsa-miR-203、hsa-miR-202、hsa-miR-102和hsa-miR-204-prec等这6个 miRNA 在非小细胞肺癌、腺癌和鳞状上皮细胞癌上的表达跟正常组织有所不同。
2.2 作为癌基因
运用定量 PCR和Western blot 对前列腺癌细胞株的RNA和蛋白进行检测,Turner等[17]发现前列腺衍生上皮因子(prostate-derived epithelial factor,PDEF)的表达受结合到 3'UTR的miR-204 调控。他们进一步证明了 PDEF是肿瘤发展的一个负性调控因子,而 miR-204的表达能导致PDEF蛋白的丢失促使前列腺癌发生。Zanette等[18]比较慢性淋巴细胞白血病(CLL)和急性淋巴白血病(ALL)的miRNA 表达谱,发现 miR-128b、miR-204、miR-218、miR-181b-1和miR-17-92 簇在ALL 中高表达。Roldo等[19]筛查了 12 例非胰腺肿瘤组织和胰腺原发肿瘤组织中miRNA的表达谱后,发现有一共同的miRNA 表达模式能够区分肿瘤和正常胰腺组织。而 miR-204 主要表达于有胰岛素分泌功能的胰岛素瘤中。
综上所述,miR-204 在肿瘤的发生与发展过程中扮演着癌基因或抑癌基因的作用,这种作用是通过调节靶基因而实现的。
3 miR-204 与其他疾病的关系
最近,研究发现 miR-204 在其他疾病中也有不同程度的表达。miR-204 在正常的视网膜色素上皮细胞(retinal pigment epithelium,RPE)、睫状体和脉络丛中高表达,而且参与RPE和睫状体生成脑脊液和房水调控[20]。高玉[21]采用 miRNA 芯片检测糖尿病组和对照组小鼠视网膜中168个 miRNAs的表达,发现糖尿病组的miR-182、miR-96和miR-204等表达显著上调。Li等[22]证实miR-204 广泛调节人小梁网细胞的凋亡、损伤蛋白的储存、内质网反应性压力和炎症介质的表达。Xiao等[23]采用RT-PCR和Western blot 分别检测心肌细胞在缺血-再灌注情况下 miR-204和LC3-II蛋白的表达,结果显示 miR-204低表达、LC3-II 表达升高,并验证了在心肌缺血再灌注损伤中 miR-204 通过调控 LC3-II蛋白表达从而调节细胞自溶作用。Courboulin等[24]研究发现,在肺动脉高压(pulmonary arterial hypertension,PAH)患者体内,只有肺部和肺动脉中的miR-204 被抑制,而且直接与PAH的严重程度相关。因此,他们认为,miR-204能作为诊断 PAH的可靠生物标记物,恢复 miR-204的表达将可能是 PAH的一种新的治疗方法。
4 展望
miRNAs 作为一类内源性非编码的小 RNAs,通过与靶基因序列特异性相互作用,在转录或翻译水平调节相关基因表达,参与发育、增殖、分化、凋亡等多种生物学过程。与肿瘤相关的miRNAs的研究是近年的研究热点,综合上述研究,miR-204的表达与头颈部鳞状上皮细胞癌、子宫内膜癌、胆管癌、胃癌、大肠癌、白血病、前列腺癌、黑色素瘤、肺癌和胰腺肿瘤等的发生发展密切相关。虽然对 miRNA的认识已取得了很大的进展,但是对 miR-204 本身的研究及其在肿瘤中的研究仍然处于起步阶段,除了需要继续寻找新的与miR-204 相关的肿瘤外,许多已知 miR-204的功能也有待进一步的研究和阐明,同时 miR-204 自身的表达与功能受哪些因素调控,miR-204是直接参与肿瘤的生成还是仅仅作为一种有差异的受调节物,不同的肿瘤组织中为何表达可以完全相反等很多问题都有待我们进一步的研究与探索。
要深入探讨 miR-204 与肿瘤的关系,确定其靶基因是关键。自从第一个 miRNA 靶基因预测软件问世以来,至今已有数十种专业软件被用于预测 miRNA 靶基因,这些软件的计算法则通常是:①种子序列(miRNA 5' 端 2~8 nt)和靶基因 3' 端 UTR 区之间的互补程度;②miRNA靶基因二聚体的自由能大小,即热力学稳定性;③靶基因非翻译区序列跨物种保守性;④miRNA 靶位点处不应有复杂二级结构;⑤miRNA 5' 端与靶基因的结合能力强于3' 端等。但是这些预测软件往往对于已知的miRNA 靶基因有着很高的预测特异性和敏感度,对于未知的靶基因预测各预测软件之间交集很小,假阳性率也较高[25]。Allen等[26]尝试把多种方法组合后进行基因预测,发现使用某一种基因预测软件很难获得理想的结果,但多种基因预测软件综合在一起后,则可以大大提高预测的准确性及合理性。我们利用 6个miRNA 靶基因预测软件对 miR-204 进行靶基因预测,结果显示 CDH2、KHDRBS1、ATF2、MYO10、EZR、CONT1和PITX2 这 7个基因可能为miR-204的靶基因,使下一步的研究更加有针对性。这样既提高了预测的准确性,同时也大大缩短了靶基因的数量,大幅度地节省了实验室验证的工作量。在基因检测如此火热的时代,相信在不久的将来会出现更高效准确的miRNA 靶基因预测工具,为miRNA的研究工作提供可靠的基因预测信息。在下一步的研究工作中,我们将结合上述被预测的7个靶基因,更深一层地探索 miR-204 与肿瘤的关系,相信在不久的将来,我们将能深入地认识肿瘤的发生机制,为肿瘤的诊断、治疗提供新的视野。
[1]Bartel DP.MicroRNAs: genomics, biogenesis, mechanism, and function.Cell, 2004, 116(2):281-297.
[2]Cheng AM, Byrom MW, Shelton J, et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis.Nucleic Acids Res, 2005, 33(4):1290-1297.
[3]Esau CC, Monia BP.Therapeutic potential for microRNAs.Adv Drug Deliv Rev, 2007, 59(2/3):101-114.
[4]Lee Y, Yang X, Huang Y, et al.Network modeling identifies molecular functions targeted by miR-204 to suppress head and neck tumor metastasis.PloS Comput Biol, 2010, 6(4):e1000730[2010-04-01].
[5]Wu W, Lin Z, Zhuang Z, et al.Expression profile of mammalian microRNAs in endometrioid adenocarcinoma.Eur J Cancer Prev,2009, 18(1):50-55.
[6]Chung TK, Lau TS, Cheung TH, et al.Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1.Int J Cancer, 2012, 130(5):1036-1045.
[7]Chen L, Yan HX, Yang W, et al.The role of microRNA expression pattern in human intrahepatic cholangiocarcinoma.J Hepatol, 2009,50(2):358-369.
[8]Chen L.Negative regulation of β-catenin signal pathway by pancreas duodenum homeobox-1.Shanghai: The Second Military Medical University, 2007.(in Chinese)陈磊.胰、十二指肠同源盒基因-1对β-catenin信号通路的调节机制研究.上海: 第二军医大学, 2007.
[9]Zhang WH, Gui JH, Wang CZ, et al.Expression of miRNA-204 in distal gastric adenocarcinoma and its role in pathogenesis and progress of gastric cancer.J Chin PLA Postgrad Med Sch, 2011, 32(7):743-747.(in Chinese)张文辉, 桂俊豪, 王昌正,等.miRNA-204在胃远端腺癌中的表达及作用初探.军医进修学院学报, 2011, 32(7):743-747.
[10]Yang JJ, Ma YL, Qin HL, et al.MicroRNAs as biomarkers for colorectal cancer: recent advances.World Chin J Dig, 2010, 18(6):568-575.(in Chinese)杨建军, 马延磊, 秦环龙,等.MicroRNAs作为大肠癌生物标志物的研究进展.世界华人消化杂志, 2010, 18(6):568-575.
[11]Carzon R, Garofalo M, Martelli MP, et al.Distinctive microRNA signature of acute myeloid leukemia bearing cytoplasmic mutated nucleophosmin.Proc Natl Acad Sci U S A, 2008, 105(10):3945-3950.
[12]Mueller DW, Rehli M, Bosserhoff AK.miRNA expression profiling in melanocytes and melanoma cell lines reveals miRNAs associated with formation and progression of malignant melanoma.J Invest Dermatol,2009, 129(7):1740-1751.
[13]Greenberg E, Hershkovitz L, Itzhaki O, et al.Regulation of cancer aggressive features in melanoma cells by microRNAs.PLoS ONE,2011, 6(4):e18936.
[14]Navarro A, Gaya A, Martinez A, et al.MicroRNA expression profiling in classic hodgkin lymphoma.Blood, 2008, 111(5):2825-2832.
[15]Huang J, Zhao L, Xing L, et al.MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation.Stem Cells, 2010, 28(2):357-364.
[16]Yanaihara N, Caplen N, Bowman E, et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis.Cancer Cell,2006, 9(3):189-198.
[17]Turner DP, Findlay VJ, Moussa O, et al.Mechanisms and functional consequences of PDEF protein expression loss during prostate cancer progression.Prostate, 2011, 71(16):1723-1735.
[18]Zanette DL, Rivadavia F, Molfetta GA, et al.MiRNA expression profiles in chronic lympocytic and acute lymphocytic leukemia.Braz J Med Biol Res, 2007, 40(11):1435-1440.
[19]Roldo C, Missiaglia E, Hagan JP, et al.MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior.J Clin Oncol,2006, 24(29):4677-4684.
[20]Deo M, Yu JY, Chung KH, et al.Detection of mammalian microRNA expression by in situ hybridization with RNA oligonucleotides.Dev Dyn, 2006, 235(9):2538-2548.
[21]Gao Y.Altered retinal microRNA expression profile in duabetic ratinduced by streptozotocin.Shanghai: The Second Military Medical University, 2010.(in Chinese)高玉.microRNA在糖尿病大鼠视网膜中表达差异谱的研究.上海:第二军医大学, 2010.
[22]Li G, Luna C, Qiu J, et al.Role of miR-204 in the regulation of apoptosis, endoplasmic reticulum stress response, and inflammation in human trabecular meshwork cells.Invest Ophthalmol Vis Sci, 2011,52(6):2999-3007.
[23]Xiao J, Zhu XY, He B, et al.MiR-204 regulates cardiomyocyte autophagy induced by ischemia-reperfusion through LC3-II.J Biomed Sci, 2011, 18:35.
[24]Courboulin A, Paulin R, Giguère NJ, et al.Role for miR-204 in human pulmonary arterial hypertension.J Exp Med, 2011, 208(3):535-548.
[25]Xu X.Same computational analysis, different miRNA target predictions.Nat Methods, 2007, 4(3):191.
[26]Allen JE, Pertea M, Salzberg SL.Computational gene prediction using multiple sources of evidence.Genome Res, 2004, 14(1):142-148.
