以次黄嘌呤核苷酸脱氢酶为靶点的药物研发
2012-12-01张大军仲兆金李卓荣
张大军,仲兆金,李卓荣
次黄嘌呤核苷酸脱氢酶(inosine 5′-monophosphate dehydrogenase,IMPDH)是嘌呤生物合成的关键酶,它将次黄嘌呤核苷酸(IMP)氧化为黄嘌呤核苷酸(XMP),XMP在GMP 合成酶的催化下生成 GMP(图 1)。该合成途径被称作是鸟嘌呤核苷酸的经典合成途径,IMPDH的催化反应在该合成途径中起到限速作用。鸟嘌呤核苷酸对于DNA和RNA的合成是重要的酶底物,在细胞的生长分化、凋亡及在细胞信号传导中具有重要作用[1]。IMPDH的催化反应与细胞增殖有密切关系,抑制 IMPDH 将导致鸟嘌呤核苷酸缺乏,DNA 合成受阻,使细胞静止于G1期。
IMPDH 在生物体中广泛表达,存在于人和其他哺乳动物的各个器官中,也存在于微生物体内。研究表明,在培养细胞的细胞质和细胞核中都能找到 IMPDH。人类细胞中含有两种IMPDH,即两个相近的同工酶 IMPDH1和IMPDH2,每个同工酶都是由 514个氨基酸残基组成,具有 84%的氨基酸序列同源性。IMPDH1和IMPDH2 两种基因有很大不同,IMPDH1 活性是构成性表达,其表达通常在相对 IMPDH2 较低的水平中,而且不受细胞增殖、分化等影响。IMPDH2 显示诱导性表达,是增殖细胞中的高度正调节,在增殖细胞和肿瘤细胞中的表达水平不断增强。对于病毒的侵袭,细胞内 IMPDH2的表达水平会提高。IMPDH2 基因在生物体内发挥不可缺少的调节作用,将小鼠的IMPDH1 基因敲除,其能够存活,但若将小鼠的IMPDH2 基因敲除,则小鼠死亡[2]。
以 IMPDH 为靶点的药物研究比较广泛,研究结果显示,IMPDH 抑制剂在免疫抑制、抗肿瘤、抗病毒及抗菌等方面均有良好的应用前景,相关药物的研发取得了重要进展,有些药物已经在临床治疗中发挥着重要作用。本文就近年来以 IMPDH 为靶点的药物的作用机制及研发进展做一综述。
1 免疫抑制
不像人体其他细胞可以通过嘌呤补救合成途径弥补缺乏的鸟嘌呤核苷酸,淋巴细胞的增殖需要大量的鸟嘌呤核苷酸,但其不能够通过旁路途径合成,几乎完全依赖于鸟嘌呤核苷酸的从头合成途径,淋巴细胞的活化同时伴随着IMPDH 表达的增加。因此,抑制 IMPDH 活性能够显著限制淋巴细胞的增殖,从而达到免疫抑制的目的。具有免疫抑制活性的IMPDH 抑制剂的结构如图 2 所示。
咪唑立宾(图 2-1)是一种具有咪唑核苷类结构的天然产物,为IMPDH 竞争性抑制剂,在临床上用于防止器官移植产生的排斥反应。咪唑立宾结合到 IMP 底物结合位点发挥作用,干扰细胞因子受体的表达,拮抗细胞因子对淋巴细胞的激活作用。在兔及羊红细胞进行免疫的实验中,能抑制由于初次应答及二次应答而生成抗体的过程。在用狗及人外周血淋巴细胞进行的体外实验中能抑制各种致有丝分裂因子引起的胚细胞样转变反应。在豚鼠巨噬细胞的游走抑制试验中,能减弱腹腔内渗出细胞的游走,使鸟苷酸合成减少,细胞内 RNA和DNA 合成减少,可阻止增殖的淋巴细胞由 G1期进展为S 期。抑制抗体及记忆 B 细胞和记忆辅助性 T 细胞的产生,可延长移植物的存活。联合应用环孢素和咪唑立宾可以协同增强免疫抑制作用[3]。
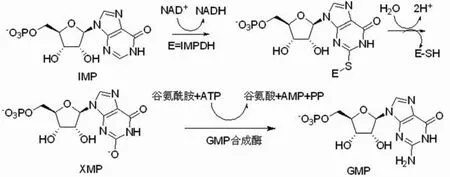
图1 IMPDH 催化鸟嘌呤核苷酸的合成

图2 具有免疫抑制活性的IMPDH 抑制剂
霉酚酸(MPA,图 2-2)是一个可逆的、非竞争性哺乳动物 IMPDH 抑制剂。其前药霉酚酸酯作为一种高特异性的淋巴细胞抑制剂已广泛应用于各种实体器官的移植,能够阻止 T 淋巴细胞的分裂及B 细胞中抗体的形成。霉酚酸酯经胃肠道吸收入血并迅速水解为活性成分霉酚酸,大部分MPA和血浆蛋白结合,少量以游离形式发挥免疫抑制作用。MPA 可以选择性、非竞争性、可逆性抑制 IMPDH 活性。因淋巴细胞不具备通过补救途径进行鸟嘌呤核苷酸合成的能力,完全依赖鸟嘌呤核苷酸从头合成途径,因此 MPA 对淋巴细胞 IMPDH的抑制导致了细胞内鸟嘌呤核苷酸耗竭,间接阻碍了 DNA 合成,从而限制淋巴细胞的增殖以达到免疫抑制目的。霉酚酸通过结合 IMPDH 酶上的NAD结合位点发挥其对 IMPDH 酶的抑制作用,霉酚酸对人体IMPDH1的亲和力动力学参数 Ki 为40 nmol/L,对IMPDH2的亲和力动力学参数 Ki 为10 nmol/L[4]。然而在使用的过程中,MPA 副作用较大,患者在用药过程中需要进行监测。研究显示,患者在服用 MPA 后IMPDH1 基因和IMPDH2 基因表达上调[5]。深入研究 MPA 对 IMPDH表达的影响,对改善 MPA的药效和减小其副作用仍然具有重要意义。MPA 治疗的患者往往涉及联合用药以减少服用MPA 所引起的毒副作用。故开发新结构的毒副作用较小的IMPDH 抑制剂具有重要意义。
美国 Vertex 制药公司基于IMPDH的结构设计了一系列苯唑脲类化合物。作为IMPDH 非竞争性抑制剂,merimepodib(VX-497,图 2-3)与霉酚酸均在IMP 与IMPDH 形成复合物后发挥作用。唑基团与GLY326 形成氢键,MPA的甲基位置由苯唑类化合物甲氧基占据,脲结构与Asp274 形成氢键,而 MPA 与苯唑脲分子及IMP 均能够形成 π-π 堆积作用,这些相互作用对化合物的效力至关重要(图 3和图 4)[6]。VX-497能够特异地、可逆地、非竞争性作用于淋巴细胞的IMPDH,对人类IMPDH1的抑制动力学参数 Ki 为10 nmol/L,对 IMPDH2的抑制动力学参数 Ki 为7 nmol/L。能够抑制淋巴细胞的增殖,临床应用于免疫抑制相关疾病的治疗。
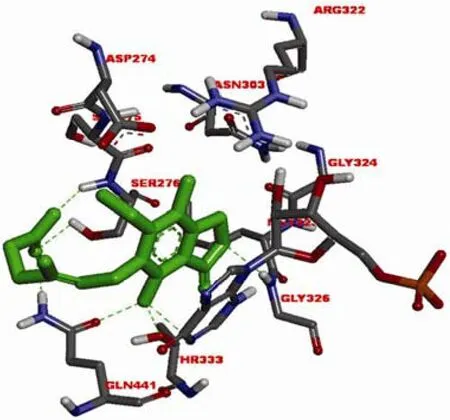
图3 MPA(绿色)与中国仓鼠 IMPDH2(同人类 IMPDH2类似)模拟结合图
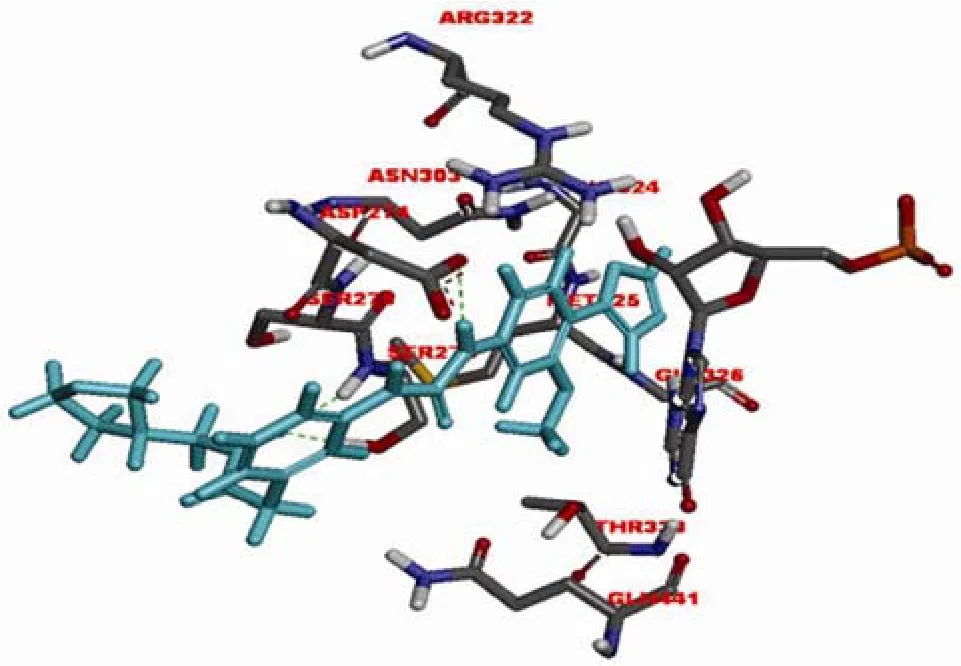
图4 VX-497(蓝色)与中国仓鼠 IMPDH2 模拟结合图
2 抗肿瘤
在肿瘤细胞中,细胞不断增殖需要大量的鸟嘌呤核苷酸,而 IMPDH 在肿瘤增殖细胞中表达明显升高,故抑制IMPDH 即能够抑制肿瘤细胞鸟嘌呤核苷酸的合成,令肿瘤细胞中鸟嘌呤核苷酸枯竭,而正常体细胞因不需要大量的鸟嘌呤核苷酸,故受 IMPDH 抑制剂的影响较小。这就为IMPDH 抑制剂应用于抗肿瘤药物的研发提供了理论基础。抗肿瘤 IMPDH 抑制剂的结构如图 5 所示。
噻唑呋林(图 5-5)是 IMPDH的非竞争性抑制剂,临床上用于治疗慢性粒细胞性白血病。噻唑呋林为前药,需要代谢活化成其活性形式——噻咪4-羧酰胺腺嘌呤双核苷酸(TAD)才能对磷酸肌苷脱氢酶(IMPDH)发生强力非竞争性抑制,从而阻止鸟嘌呤核苷酸的产生。实验证实,噻唑呋林具有极强的诱导白血病细胞 K562 凋亡的作用,但其神经毒性较大,并存在耐药问题[7]。
MPA能够诱导淋巴细胞坏死,抑制肿瘤细胞生长。研究显示,MPA能够诱导 PC-3和DU145 前列腺癌细胞分化。在临床试验中,MPA 对多发性骨髓瘤患者显示了较小的毒性,目前正处于II 期临床试验[8]。为了降低毒性和获得更好的药代动力学参数,研究人员合成了一系列霉酚酸腺嘌呤核苷酸,以减少葡糖醛酸化,改善化合物的药理性质。代表化合物 C2-MAD(图 5-6)作用于IMPDH 尼克酰胺腺嘌呤二核苷酸结合位点,对 IMPDH的Ki 值约为350 nmol/L,显示了抗白血病效果和诱导细胞分化的能力,效果强于MPA。在浓度为1.5 μmol/L 时,C2-MAD能够诱导 65%的白血病细胞 K562 成熟,未增殖的细胞能够产生血红蛋白。在小鼠模型中,C2-MAD 对慢性粒细胞性白血病的治疗效果优于噻唑呋林,而且具有更小的毒性,对耐噻唑呋林的癌细胞仍然具有效力,是一个有前景的治疗慢性粒细胞白血病的候选药物[7]。研究人员对化合物进一步改造,发现了活性更高的化合物(图 5-7,图 5-8)。
同时抑制 IMPDH和组蛋白去乙酰化酶(HDAC)是一种新的抗肿瘤策略。SAHA(图 5-9)能够同时抑制IMPDH和HDAC,其对人类 IMPDH1和IMPDH2的Ki值分别为5.0 μmol/L和1.7 μmol/L。对 HDAC的IC50值为0.06 μmol/L,被批准治疗皮肤 T 细胞淋巴瘤。SAHA 与伊马替尼合用能够对耐伊马替尼的白血病细胞产生疗效。MAHA(图 5-10)对 IMPDH的抑制活性与MPA 相当,其对人类 IMPDH1和IMPDH2的Ki 值分别为70 nmol/L和30 nmol/L,而其对 HDAC的抑制活性比 MPA 强,IC50值为5.0 μmol/L,MAHA 在浓度为0.25 μmol/L 时能够诱导 75% 白血病细胞 K562 分化,而相同条件下,SAHA 诱导 47% K562 分化,具有更强的抗肿瘤活性[9]。
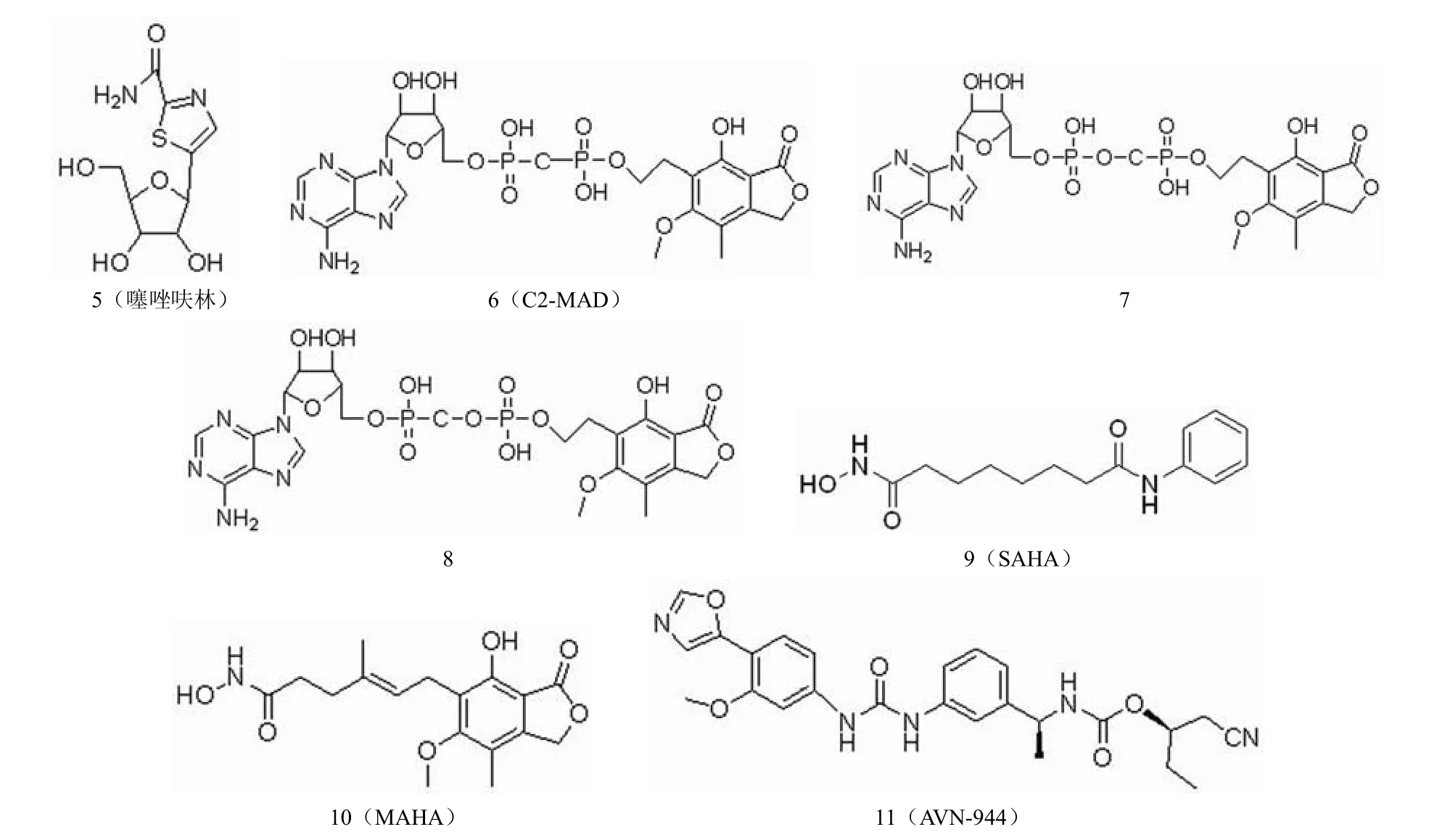
图5 抗肿瘤 IMPDH 抑制剂
AVN-944 (图 5-11)是一个结构新颖的、特异性的非竞争性 IMPDH 抑制剂,在针对肿瘤治疗的I 期临床试验中显示其对健康男性受试者具有良好的耐受性。其对人IMPDH的抑制活性 Ki 为6~10 nmol/L。该化合物诱导细胞周期阻滞在S 期,诱导多发性骨髓瘤细胞株蛋白酶凋亡,还能抑制人类前列腺癌细胞的生长,并且导致肿瘤细胞的分化和死亡[10]。在男性中,前列腺癌是仅次于肺癌的癌症死因。AVN-944 有望成为一个很有前景的前列腺癌治疗药物。AVN-944 与吉西他滨联合用于胰腺癌的治疗已进入临床试验。AVN-944 与IMPDH 模拟结合图如图 6 所示。

图6 AVN-944(紫色)与中国仓鼠 IMPDH2 模拟结合图
研究人员还筛选了一系列天然产物(图 7)用于抗肿瘤研究。化合物 2264A(图 7-12)和2264B(图 7-13)对 IMPDH2 具有明显的抑制活性,其 IC50值分别为70 μmol/L和12 μmol/L,这两个化合物均能够抑制淋巴细胞的增长。从海绵中分离得到的不饱和脂肪酸(图 7-14)对哺乳动物 IMPDH2的IC50约为1 μmol/L,helenalin(图 7-16)显示的抗癌活性也与IMPDH 相关。化合物 17(图 7-17)对 IMPDH的IC50约为15 nmol/L,这些天然产物与IMPDH的作用机制仍在进一步确证。
3 抗病毒
病毒的增殖需要大量的鸟嘌呤核苷酸,而病毒自身不能合成鸟嘌呤,必须依靠宿主细胞的鸟嘌呤核苷酸作为基础物质。若对宿主细胞的IMPDH 进行抑制,降低宿主细胞内的鸟嘌呤核苷酸水平,就能够明显起到抗病毒作用。
利巴韦林(图 8)又名病毒唑,是广谱强效的抗病毒药物,目前广泛应用于病毒性疾病的防治。利巴韦林还可以与干扰素(IFN-α)联用治疗慢性丙型肝炎。利巴韦林临床上也被用作抗呼吸道合胞体病毒药物,市场上称作 virazole。研究表明,利巴韦林具有明显的IMPDH 抑制活性。利巴韦林在用药的过程中对免疫系统平衡会造成影响。大剂量长期使用可引起白细胞减少、贫血、血清转氨酶和胆红素升高,并可引起胆血红蛋白下降[11]。
如前所述,VX-497是一个可逆的、非竞争性 IMPDH抑制剂,其不但具有免疫抑制活性,同样也是一个抗病毒候选药物。在对被 DNA 病毒(乙型肝炎病毒、人巨细胞病毒和单纯疱疹病毒)和RNA 病毒(呼吸道合胞病毒副流感-3 病毒、牛病毒性腹泻病毒、委内瑞拉马脑脊髓炎病毒、登革热病毒、黄热病毒、柯萨奇 B3 病毒、脑炎心肌炎病毒和A 型流感病毒)感染的体外细胞实验中,VX-497的抗病毒活性是利巴韦林的17~186 倍,说明 VX-497 具有强效广谱抗病毒作用。VX-497 与干扰素合用治疗丙型肝炎的实验中,也显示出比利巴韦林与干扰素合用更好的效果[12]。
过去几年,切昆贡亚热疫情爆发的报道受到广泛关注。而 MPA 对切昆贡亚病毒的实验显示,MPA能够诱导切昆贡亚病毒凋亡。在MPA 为10 μmol/L 时,对切昆贡亚病毒具有较强的抑制作用[13]。
4 抗寄生虫
寄生虫的增殖需要大量的鸟嘌呤核苷酸,特异地抑制寄生虫 IMPDH,即能够抑制寄生虫的增殖。原核生物对 MPA表现出明显的耐受性,也为开发选择性的寄生虫 IMPDH抑制剂提供了实验依据。

图7 具有 IMPDH 抑制活性的天然产物
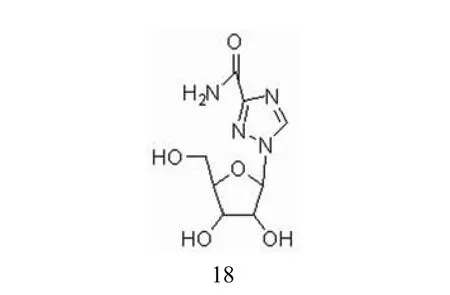
图8 利巴韦林的化学结构
隐孢子虫是一类重要人类病原体,能够引起肠道疾病,并且可能导致人体免疫力低下而威胁人的生命。这种寄生虫引起的疾病在发展中国家尤为严重,尤其危害儿童的健康。针对这一类疾病并没有疫苗,人群可能通过饮水而大规模爆发疾病,而目前并没有特异的药物对其进行治疗,现有药物并不足以应付疾病的挑战。隐形孢子虫不能够通过旁路途径利用鸟嘌呤,研究人员发现了一系列化合物能够特异性地抑制隐孢子虫 IMPDH,对寄生虫的IMPDH 抑制活性明显高于人类 IMPDH 抑制活性,很有希望成为治疗隐孢子虫病的理想药物[14]。
对隐孢子虫 IMPDH 有抑制活性的化合物结构多样(图 9),但也具有相似的特点。化合物 19和化合物 20对隐孢子虫 IMPDH的抑制活性分别约为0.76 μmol/L和1.6 μmol/L。两个化合物都含有萘基团和取代苯基,且均含有酰胺基团。化合物 19 对人类 IMPDH210%的抑制活性均小于0.5 μmol/L,具有很好的选择性。而将萘环换成喹啉环,对活性影响并不显著,化合物 21 对寄生虫的IMPDH抑制活性约为0.8 μmol/L。将喹啉环以苯环代替,化合物 22对寄生虫的IMPDH 抑制活性 3.3 μmol/L,活性略有下降。化合物 23 与上述结构差异较大,但结构中仍保留有酰胺基团,对寄生虫的IMPDH 抑制活性为19 μmol/L,将化合物21的喹啉环以化合物 24 中的杂环取代,对寄生虫IMPDH 抑制活性为5.4 μmol/L,活性下降。化合物 25含有苯并咪唑和噻唑基团,对寄生虫 IMPDH 抑制活性为1.6 μmol/L,化合物 26 对寄生虫 IMPDH 抑制活性为1.4 μmol/L,而化合物 27 为氧连接的对称喹喔啉二酮结构,对寄生虫 IMPDH 抑制活性为5.9 μmol/L,化合物 28 分子较小,但仍具有较强活性,对寄生虫 IMPDH 抑制活性为1.6 μmol/L[15]。
5 抗菌
微生物和哺乳动物的同工酶大约有 30%~40% 序列相同。因此,同一个抑制剂对微生物和哺乳动物 IMPDH 具有不同的抑制活性。MPA 对哺乳动物 IMPDH的抑制活性就明显高于其对微生物 IMPDH的抑制活性。

图9 能够选择性抑制隐形孢子虫 IMPDH的化合物
多重耐药菌的出现对现有抗生素提出了严峻考验,对万古霉素具有耐药性的金黄色葡萄球菌也已经出现,耐药的肺炎链球菌、肠球菌、肺炎克雷伯菌及幽门螺旋杆菌越来越普遍[16]。一旦抗生素大批失效,人类可能面对可怕的灾难。故寻找新的抗生素靶点,研发新的抗生素变得尤为重要。而IMPDH 用于抗菌是一个全新的靶点,全新的作用机制令人充满期待。
6 问题与展望
综上所述,以 IMPDH 为靶点的药物已广泛应用于免疫抑制、抗肿瘤、抗病毒治疗,在临床治疗上发挥着重要作用,其应用和联合应用不但解决了药物的耐受性问题,而且取得了更好的疗效。但目前应用的IMPDH 抑制剂也存在一定的副作用,如胃肠道反应、白细胞减少等症状,一些患者的用药还需进行监测。故开发高效低毒的IMPDH 抑制剂依然具有重要意义。针对不同的病症,对 IMPDH1和IMPDH2 进行选择性抑制,开发特异性的抑制剂,不但可以减小毒副作用,同样能够提高药效。IMPDH 抑制剂应用于抗寄生虫和抗菌方面是一个新的领域,具有广阔的前景。应用计算机技术,结合不同物种特定的IMPDH的结构特点,开发出以 IMPDH 为靶点的特效药,依然是药物工作者面临的挑战。
[1]Yalowitz JA, Jayaram HN.Molecular targets of guanine nucleotides in differentiation, proliferation and apoptosis.Anticancer Res, 2000,20(4):2329-2338.
[2]Gu JJ, Tolin AK, Jain J, et al.Targeted disruption of the inosine 5'-monophosph -ate dehydrogenase type I gene in mice.Mol Cell Biol,2003, 23(18):6702-6712.
[3]Turka LA, Dayton J, Sinclair G, et al.Guanine ribonucleotide depletion inhibits T cell activation.Mechanism of action of the immunosuppressive drug mizoribine.Journal of Clinical Investigation,1991, 87(3):940-948.
[4]Chen L, Wilson D, Jayaram HN, et al.Dual inhibitors of inosinemonophosphate dehydrogenase and histone deacetylases for cancer treatment.J Med Chem, 2007, 50(26):6685-6691.
[5]Bremer S, Vethe NT, Rootwelt H, et al.Expression of IMPDH1 is regulated in response to mycophenolate concentration.Int Immunopharmacol, 2009, 9(2):173-180.
[6]Sintchak MD, Nimmesgern E.The structure of inosine 5'-monophosphate dehydrogenase and the design of novel inhibitors.Immunopharmacology, 2000, 47(2-3):163-184.
[7]Rejman D, Olesiak M, Chen L, et al.Novel methylenephosphophosphonate analogues of mycophenolic adenine dinucleotide.Inhibition of inosine monophosphate dehydrogenase.J Med Chem, 2006, 49(16):5018-5022.
[8]Braun-Sand SB, Peetz M.Inosine monophosphate dehydrogenase as a target for antiviral, anticancer, antimicrobial and immunosuppressive therapeutics.Future Med Chem, 2010, 2(1):81-92.
[9]Chen L, Wilson D, Jayaram HN, et al.Dual inhibitors of inosine monophosphate dehydrogenase and histone deacetylases for cancer treatment.J Med Chem, 2007, 50(26):6685-6691.
[10]Floryk D, Thompson TC.Antiproliferative effects of AVN944, a novel inosine 5-monophosphate dehydrogenase inhibitor, in prostate cancer cells.Int J Cancer, 2008, 123(10):2294-2302.
[11]Hultgren C, Milich DR, Weiland O, et al.The antiviral compound ribavirin modulates the T helper (Th) 1/Th2 subset balance in hepatitis B and C virus-specific immune responses.J Gen Virol, 1998, 79(Pt 10):2381-2391.
[12]Markland W, McQuaid TJ, Jain J, et al.Broad-spectrum antiviral activity of the IMP dehydrogenase inhibitor VX-497: a comparison with ribavirin and demonstration of antiviral additivity with alpha interferon.Antimicrob Agents Chemother, 2000, 44(4):859-866.
[13]Khan M, Dhanwani R, Patro IK, et al.Cellular IMPDH enzyme activity is a potential target for the inhibition of Chikungunya virus replication and virus induced apoptosis in cultured mammalian cells.Antiviral Res, 2011, 89(1):1-8.
[14]Maurya SK, Gollapalli DR, Kirubakaran S, et al.Triazole inhibitors of Cryptosporidium parvum inosine 5'-monophosphate dehydrogenase.J Med Chem, 2009, 52(15):4623-4630.
[15]Hedstrom L.IMP dehydrogenase: structure, mechanism, and inhibition.Chem Rev, 2009, 109:2903-2928.
[16]Hedstrom L, Liechti G, Goldberg JB, et al.The antibiotic potential of prokaryotic IMP dehydrogenase inhibitors.Curr Med Chem, 2011,18(13):1909-1918.
