表达CSFV E2蛋白重组AcNPV载体的构建
2012-11-29胡刚叶苌生科庄金山白朝勇张许科
胡刚叶,苌生科,庄金山,白朝勇,张许科,
(1.河南农业大学动物传染病与微生物实验室,郑州 450002;2.国家兽用药品工程技术研究中心,河南洛阳 471000)
猪瘟病毒(CSFV)的E2基因编码的蛋白是引起动物机体产生保护性免疫的主要抗原蛋白[1]。目前已被批准生产的猪瘟标记疫苗是Advasure®(Pfizer,UK)和 Porcilis Pesti® (Intervet,the Netherlands)[2],二者均是以猪瘟病毒E2蛋白为基础开发的亚单位疫苗,可以很容易通过检测其它相关抗体来区别免疫猪和感染猪。
杆状病毒表达系统是一种高效的真核表达系统,能够有效进行蛋白质的翻译后加工,如转运、分泌、糖基化、脂酰基化等,其表达的外源蛋白结构与天然蛋白结构非常接近。近年来,通过家蚕幼虫和蚕蛹感染重组杆状病毒表达外源蛋白的方法成功地应用于一些蛋白的表达,外源蛋白的表达量得到大幅提高。周耐明等[3]利用重组的家蚕核型多角体病毒(BmNPV)在家蚕幼虫和蚕蛹中高效表达了具有生理活性的 HBsAg,表达量高达750 μg/蚕。肖庆利等[4]利用重组的BmNPV在家蚕幼虫中高效表达了禽马立克氏病毒糖蛋白B抗原,每1 mL蚕血淋巴表达量可达1 mg。
本文利用苜蓿银纹夜蛾核型多角体病毒(AcNPV)Bac-to-Bac表达系统构建了含有CSFV E2基因的重组AcNPV。重组病毒感染昆虫细胞后通过分泌途径产生重组CSFV E2蛋白,在家蚕蛹中亦成功表达出CSFV E2蛋白。
1 材料与方法
1.1 材料 猪瘟活疫苗购自哈尔滨维科生物技术开发公司(生产批号:2010005);AcNPV Bac-to-Bac表达系统试剂盒、pFastBacHBM-TOPO载体、DH10Bac感受态细胞均为Invitrogen公司产品;Sf9细胞由国家兽药工程技术研究中心保存;QIAamp Viral RNAMini Kit由QIAgen公司生产;小量质粒提取试剂盒、小量胶回收试剂盒均由天根生化科技有限公司生产;AMV反转录酶、高保真DNA聚合酶、限制性内切酶、RNA酶抑制剂、T4 DNA连接酶等均由大连宝生物工程有限公司生产;DAB显色试剂盒由康为世纪生物科技有限公司生产;CSFV阳性猪血清由国家兽用药品工程技术研究中心提供;5日龄蚕(品种为大造)由国家兽用药品工程技术研究中心生物制品研究所实验动物房提供。
1.2 引物 根据GenBank登录的猪瘟病毒C-株的cDNA序列(HM175885),利用DNAStar软件设计两对引物用于扩增猪瘟E2基因。引物由上海英潍捷基生物技术公司合成,其序列如下:
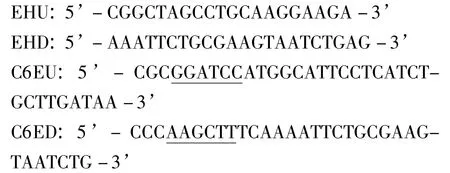
其中引物C6EU的5’端引入了BamH I位点,引物C6ED引入了Hind III位点。
根据设计,EHU/EHD引物对理论上应扩增出猪瘟病毒E2基因大小为1026 bp;C6EU/C6ED引物对理论上应扩增出猪瘟病毒E2基因大小为1113 bp,该引物对扩增产物包含猪瘟病毒E2基因5’端的内源性信号肽序列,加上引物上的酶切位点及末端序列后PCR扩增产物大小应为1133 bp。
1.3 RT-PCR扩增目的基因 将猪瘟活疫苗用稀释液稀释后,按照QIAamp Viral RNAMini Kit说明书步骤进行猪瘟病毒RNA的制备,然后分别利用引物EHD和引物C6ED做为反转录引物进行cDNA的制备。反转录体系如下:病毒RNA 10.5 μL,反转录引物(10 pmol/L)1 μL,RNA 酶抑制剂0.5 μL,dNTPs 2 μL(2.5 mmol/L),反转录酶 1 μL(5 U),反转录酶 Buffer 4 μL,总体系为 20 μL,在PCR仪中进行42℃作用1 h。然后在进行PCR反应,PCR 反应总体系为 50 μL:cDNA 模板 3 μL,上下游引物各(10 pmol/L)1 μL,dNTP 4 μL(2.5 mmol/L),高保真 DNA聚合酶 1 μL,高保真 DNA聚合酶 Buffer 5 μL,用 ddH2O 补足至 50 μL。引物对EHU/EHD的PCR扩增程序为:95℃预变性3 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min 20 s,共进行30个循环;72℃延伸10 min,PCR扩增产物命名为PCR-E2。C6EU/C6ED引物对的PCR扩增程序为:95℃预变性3 min;95℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min 30 s,共进行30个循环;72℃延伸10 min,PCR产物命名为PCR-C6E2。扩增完成后,取全部扩增产物用1%的琼脂糖凝胶电泳检测,结果大小与目的基因大小一致时,切胶,按照胶回收试剂盒步骤进行PCR产物的回收。
1.4 重组杆状病毒的获得 按照AcNPV Bacto-Bac杆状病毒表达系统操作说明书步骤,将引物对EHU/EHD扩增的产物PCR-E2直接克隆入pFastBacHBM-TOPO载体中,克隆产物命名为pFast-E2;将引物对C6EU/C6ED扩增的PCR产物PCR-C6E2通过 BamH I和 Hind III克隆入pFastBacI中,克隆产物命名为 pFast-C6E2。然后,将重组供体质粒pFast-E2和pFast-C6E2分别转化入DH10Bac感受态细胞中,通过蓝白斑筛选出阳性重组的杆状病毒基因组质粒(Bacmid),并分别命名为Bacmid-E2和Bacmid-C6E2,然后将Bacmid-E2和Bacmid-C6E2转染至Sf9细胞,同时也将Bacmid空载质粒转染至Sf9细胞做为对照病毒。转染后观察细胞,待50%左右的细胞出现病变后收获培养上清,通过AcNPV Bac-to-Bac表达系统试剂盒中提供的引物对M13F/M13R扩增特异性片段鉴定重组病毒,重组病毒的PCR扩增产物大小应约为2300 bp加上目的基因的大小,不含有目的基因的对照病毒PCR扩增产物大小约为300 bp。PCR反应总体系为50 μL:病毒基因组模板 3 μL,M13F/M13R(10 pmol/L)各 1 μL,dNTP 4 μL(2.5 mmol/L),高保真 DNA 聚合酶 1 μL,高保真 DNA聚合酶 Buffer 5 μL,用 ddH2O补足至50 μL。PCR扩增程序为:95℃预变性3 min;95℃变性30 s,55 ℃退火 45 s,72 ℃延伸 5 min,共进行30个循环;72℃延伸10 min。获得的重组病毒分别命名为VBac-E2和VBac-C6E2,对照病毒命名为VBac。
1.5 重组病毒在Sf9细胞中表达CSFV E2的鉴定间接免疫荧光鉴定重组蛋白:以M.O.I.=10感染生长至80%左右的单层Sf9细胞,感染48 h后用PBS(0.01 mol/L pH7.4)洗涤细胞 3 次,冷甲醇固定10 min,用含有1%BSA的PBS封闭30 min,PBS洗涤细胞3次,每次5 min,加入CSFV阳性猪血清于37℃温箱孵育1 h,再用PBS洗涤3次,每次5 min,加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗猪 IgG二抗37℃孵育45 min,再用PBS洗涤3次,每次5 min,然后置于倒置荧光显微镜下观察结果。
ELISA法鉴定重组蛋白:按照韩国金诺公司猪瘟抗原检测试剂盒说明书进行。以M.O.I.=10感染生长至80%左右的单层Sf9细胞,感染后48、60、72和84 h分别收获细胞培养上清,进行ELISA检测培养上清中的重组蛋白。
1.6 重组蛋白在家蚕蚕蛹中表达 将获得的转蛹3 d后的蚕蛹通过微量注射器进行蚕蛹体节之间皮下注射,挑选40只蚕蛹进行随机分成5组,第1组5只蚕蛹,每只注射0.01 mol/L的pH6.4的 PBS 2.5 μL,做为 PBS对照组;第 2 组 10 只蚕蛹,每只注射2.5 μL 浓度为 2.5 ×105PFU/μL 的 VBac-E2重组病毒液;第3组10只蚕蛹,每只注射2.5 μL浓度为2.5×105PFU/μL的 VBac-C6E2重组病毒液;第4组10只蚕蛹,每只注射2.5 μL浓度为2.5×105PFU/μL的VBac对照病毒液;第5组5只蚕蛹,不注射,做为空白对照组。注射后第7天收获蚕蛹血淋巴,冻存于-20℃,备用。
1.7 Western-blot鉴定蚕蛹血淋巴中重组蛋白的表达 将收集的蚕蛹血淋巴进行SDS-PAGE电泳,将胶块上的蛋白条带经电转移转至硝酸纤维素膜上,用含有5%脱脂奶粉的PBST封闭过夜,以CSFV阳性猪血清作为一抗,37℃孵育1 h,PBST洗涤硝酸纤维素膜3次,每次5 min,以辣根过氧化物酶标记的羊抗猪IgG作为二抗,37℃孵育1 h,然后用DAB显色试剂盒进行显色,并进行拍照记录结果。
2 结果
2.1 RT-PCR扩增目的基因 RT-PCR产物PCR-E2和PCR-C6E2通过核酸凝胶电泳鉴定,结果如图1所示,获得了与预期大小一致的DNA条带(1026 bp和1133 bp)。
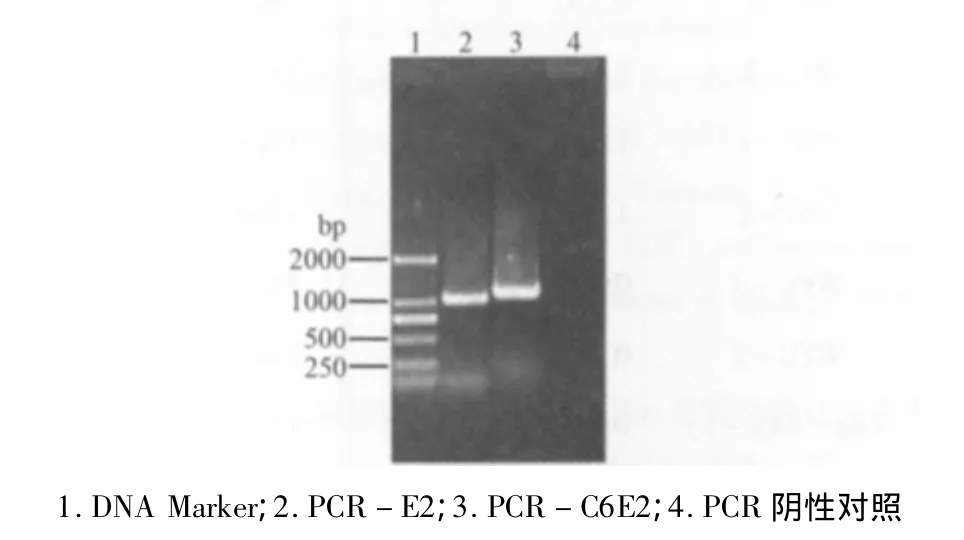
图1 RT-PCR扩增目的基因
2.2 重组杆状病毒的鉴定 将重组杆状病毒质粒Bacmid-E2、Bacmid-C6E2和Bacmid空载质粒转染至Sf9细胞后,在转染后72~96 h观察到三种杆状病毒质粒转染的细胞均出现细胞病变。通过引物对M13F/M13R对细胞培养上清进行PCR鉴定,结果(图2)显示重组病毒构建成功。
图2 重组杆状病毒的鉴定
2.3 重组病毒在Sf9细胞中表达CSFV E2的鉴定间接免疫荧光鉴定重组病毒在感染后48 h后的Sf9细胞中重组蛋白的表达情况。在VBac-E2和VBac-C6E2感染的Sf9细胞中能观察到荧光,而VBac感染的Sf9细胞中没有观察到荧光,结果表明,重组病毒VBac-E2和VBac-C6E2感染Sf9细胞后均能够表达CSFV E2蛋白。
为了进一步验证重组蛋白是否能分泌表达,对感染Sf9细胞48、60、72和84 h后的培养上清进行ELISA检测,样品在450 nm波长下的OD值结果如表1。
根据试剂盒结果判定标准,当样品OD值≥0.4375时应判定为阳性,表1中结果显示,重组病毒VBac-E2和VBac-C6E2在感染Sf9细胞后48、60、72和84 h的细胞上清中重组蛋白检测结果均为阳性,对照病毒VBac感染Sf9细胞84 h后细胞上清中重组蛋白检测结果为阴性。结果表明,重组病毒VBac-E2和VBac-C6E2在感染Sf9细胞后能够分泌表达CSFV E2蛋白。
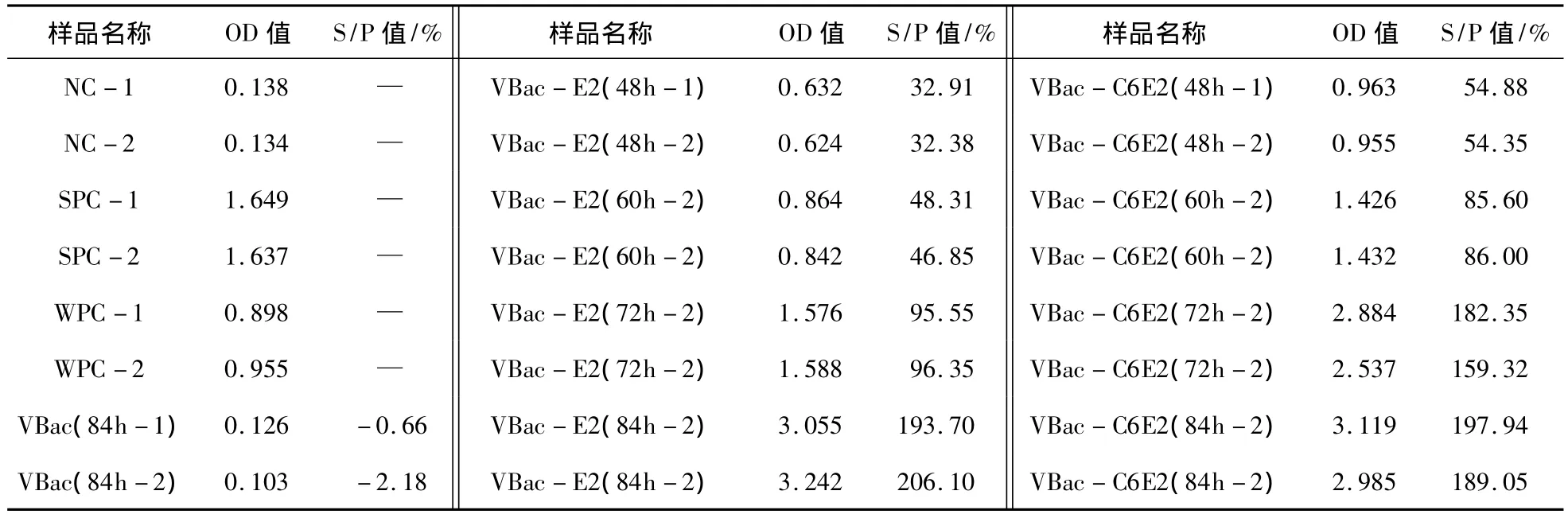
表1 重组蛋白的ELISA检测
2.4 重组蛋白在家蚕蚕蛹中表达及Western-blot鉴定 按照材料与方法1.6中所述进行蚕蛹注射重组病毒,在注射后发现注射重组病毒及对照病毒的蚕蛹的体色变暗甚至发黑,而PBS对照组和空白对照组则体色变化较小或无变化。于注射后第7天收获蚕蛹血淋巴进行Western-blot鉴定重组蛋白的表达,结果显示,重组病毒VBac-E2和VBac-C6E2注射蚕蛹组血淋巴在45~60 kD之间,靠近45 kD条带(图3),与预期大小相符(约48 kD)。
图3 Western-blot鉴定蚕蛹中重组蛋白的表达
3 讨论
本研究构建了两株重组病毒VBac-E2和VBac-C6E2。其中,在 VBac-E2中 CSFV E2基因通过供体质粒pFastBacHBM-TOPO载体而引入了蜂毒素信号肽序列,目的想通过蜂毒素信号肽的引导来分泌表达CSFV E2蛋白。研究结果表明,蜂毒素信号肽能够引导CSFV E2的分泌表达。重组病毒VBac-C6E2中,目的基因5’端存在CSFV的内源信号肽序列,试验表明内源性信号肽同样能够引导CSFV E2的分泌表达。
有文献报道认为AcNPV经口或皮下注射不感染家蚕[5-6],但也有报道称AcNPV能感染特殊品种的家蚕[7-8]。本研究通过注射感染大造蚕蛹进行目的蛋白的表达,Western-blot分析结果表明重组AcNPV能够在大造蚕蛹中表达CSFV E2蛋白。
杆状病毒表达系统进行外源蛋白表达过程中的转录翻译和翻译后修饰加工等与动物细胞相似,表达的外源蛋白活性与天然蛋白基本一致[9]。而家蚕生物反应器表达重组蛋白,外源蛋白的表达量和生物活性更好,成本更低[10]。与传统重组BmNPV的构建相比,重组AcNPV的构建操作更简单,技术更成熟。家蚕并非AcNPV的天然宿主,通过注射感染家蚕蛹的症状更轻微,不易造成致死性的病理变化,可能更有利于家蚕生物反应器表达重组蛋白的应用。利用引物对M13F/M13R对重组病毒进行鉴定时,在预期大小位置处出现了特异性条带,但也存在一些非预期大小的条带,这可能是由于PCR扩增时较低的退火温度所致,也可能是由于细胞培养上清中存在较多的杂蛋白,引起引物非特异性结合所致。
虽然,本研究利用重组AcNPV在蚕蛹中成功表达了CSFV E2蛋白,但蚕蛹感染重组病毒的方式、重组病毒的感染剂量、重组蛋白的纯化工艺、表达量优化等一些问题还有待于深入研究。
[1] Risatti G R,Borca M V,Kutish G F,et al.The E2 glycoprotein of classical swine fever virus is a virulence determinant in swine[J].J Virol,2005,79(6):3787-3796.
[2] Blome S,Meindl-Böhmer A,Loeffen W,et al.Assessment of classical swine fever diagnostics and vaccine performance[J].Rev Sci Tech Off Int Epiz,2006,25(3):1025-1038.
[3] 周耐明,张 颖,金 伟,等.乙肝病毒S基因在家蚕细胞及蚕体内高效表达状[J].生物工程学报,1995,32(11):111-115.
[4] 肖庆利,季 平,何家禄,等.禽马立克氏病毒糖蛋白B基因在家蚕中的表达[J].蚕业科学,1997,23(2):104-108.
[5] Shikata M,Shibata H,Sakurai M,et al.The ecdysteroid UDP-glucosyltransferase gene of Autographa californica nucleopolyhedrovirus alters the moulting and metamorphosis of a non-target insect,the silkworm,Bombyx mori Lepidoptera,Bombycidae[J].J Gen Virol,1998,79:1547-1551.
[6] Yamao M,Katayama N,Nakazawa H,et al.Gene targeting in the silkworm by use of a baculovirus[J].Genes Dev,1999,13:511-516.
[7] Tingqing Guo,Shengpeng Wang,Xiuyang Guo,et al.Productive infection of Autographa californica nucleopolyhedrovirus in silkworm Bombyx mori strain Haoyue due to the absence of a host antiviral factor[J].Virology,2005,341:231-237.
[8] T Q Guo,J Y Wang,X Y Guo,et al.Transient in vivo gene delivery to the silkworm Bombyx mori by EGT-null recombinant AcNPV using EGFP as a reporter[J].Archives of Virology,2005,150:93-105.
[9] 吴小锋,岳万福,刘剑梅,等.Bac-to-Bac系统的研究进展及在家蚕中的应用[J].蚕业科学,2007,33(1):146-150.
[10]杨瑞丽,金勇丰,吴玉澄,等.利用家蚕生物反应器生产有用蛋白的研究[J].浙江大学学报(农业与生命科学版),2001,27(2):173-178.
