三氧化二砷对人多发性骨髓瘤RPMI8226细胞的作用及机制研究
2012-11-24崔久嵬蒿姗姗AadilYousif
李 丹,崔久嵬,蒿姗姗,牛 超,Aadil Yousif,李 薇
(吉林大学第一医院 肿瘤中心,吉林 长春130021)
多发性骨髓瘤(multiple myeloma,MM)是最为常见的血液系统恶性肿瘤之一,发生率占血液系统恶性肿瘤的10%左右,随着人口的老龄化,该病的发生率在我国呈逐年增高的趋势。三氧化二砷(arsenic trioxide,ATO)在体外对多种实体瘤和血液肿瘤细胞系,包括MM 细胞系均有作用,但其机制尚未完全清楚[1、2]。为了揭示ATO对多发性骨髓瘤细胞系的作用机制,本研究分别对细胞增殖、凋亡、细胞周期、VEGF分泌和Bcl-2[3]表达情况等方面进行探讨。
1 材料与方法
1.1 试剂和仪器
三氧化二砷(sigma公司)、IMDM培养液、胎牛血清(Gibco公司),6孔及96孔板培养板(Coring公司);CCK-8细胞增殖及细胞毒性检测试剂盒、细胞周期与细胞凋亡检测试剂盒 (武汉博士德);ELISA检测试剂盒(R&D公司);Bcl-2、β-actin、鼠抗人-抗多克隆抗体(Santa Cruz公司);兔抗鼠二抗多克隆抗体(中杉金桥);Western blot试剂盒(KPL公司);FACScan型流式细胞仪(BD公司);酶标仪(BIO-TEK公司)。
1.2 方法
1.2.1 细胞培养 RPMI8226细胞株购自ATCC,悬浮培养于IMDM 培养液(内含2mmol/L L-谷氨酰胺、10%的灭活胎牛血清、100U/ml青霉素、100 mg/ml链霉素)中,置于5%CO2饱和湿度的37℃培养箱培养。48h传代1次,取对数生长期细胞用于实验。
1.2.2 CCK-8法检测ATO作用后细胞生长情况
收集对数生长期的RPMI8226细胞,调整细胞悬液浓度为5×105个/ml,接种于96孔板。每孔100 μl。实验设溶质对照组,细胞不加药组以及细胞加ATO组(ATO 终浓度分别为1.0、2.0、3.0、4.0、5.0μmol/L)共七组,每组设3个复孔。将各组细胞培养至12h、24h、48h后,每孔加入10μl CCK-8,于5%CO2饱和湿度的37℃培养箱继续培养4h,然后在酶联免疫检测仪450nm处测量各孔的吸光值。取3孔的平均值,计算细胞生长抑制率,绘制细胞生长抑制曲线。实验重复3次。
1.2.3 流式细胞仪Annexin V/PI染色法检测细胞周期及凋亡情况 收集对数生长期的RPMI8226细胞,配成1×106/ml的细胞悬液,接种于6孔板,3 ml/孔。各孔分别加入不同浓度 ATO(1.0、2.0、3.0、4.0、5.0μmol/L)及PBS(作为对照),培养48 h后收集各组细胞,制备成100μl单细胞悬液于流式管中,加入5μl Annexin-Ⅴ和10μl PI染液,同时设荧光补偿管,暗室反应15min,再加入150μl结合缓冲液,于1h内流式细胞仪检测。每组实验均重复3次。
1.2.4 用ELISA法检测不同浓度 ATO对RPMI8226细胞分泌VEGF的影响 收集不同浓度ATO作用RPMI8226细胞48h后上清液,进行稀释后,按照VEGF ELISA检测试剂盒说明书进行操作。
1.2.5 Western blot检测 ATO 作用后 Bcl-2蛋白水平检测 RPMI8226细胞于含10%灭活胎牛血清的IMDM培养液中,根据加入ATO的浓度的不同,共分为六组,即:空白不加药组和ATO终浓度分别为1.0、2.0、3.0、4.0、5.0μmol/L组。各组作用24h及48h后,分别收集各时间点细胞,4℃预冷的PBS洗涤2次,加入细胞蛋白提取液,冰浴10-30min后,12 000rpm,4℃低温离心5min。取上清,经Bradford分析方法定量。细胞蛋白提取液样品(约50μg)溶于样品缓冲液中,混匀,沸水中热溶5min。取等量的蛋白进行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2h,漂洗后加入相应的一抗,4℃孵育过夜,漂洗后二抗孵育1h,用ECL发光液显色、曝光、显影、定影、水洗。X光片曝光处理,计算机软件分析结果。以β-actin为内参照,统计数据以供分析。
1.2.6 统计学方法 用SPSS13.0统计软件分析,采用单因素方差分析(F检验)和LSD-t检验进行多样本均数的两两比较。取α=0.05为检验水准,P≤0.05为差异有统计学意义。
2 结果
2.1 ATO对多发性骨髓瘤RPMI8226增殖的影响
CCK-8法检测ATO作用后细胞增殖后OD值,计算抑制率(图1)。并观察不同作用时间下,ATO对细胞的抑制作用。ATO对RPMI 8226细胞株的增殖抑制呈剂量-时间依赖性,即:剂量越大,时间越长,抑制率越高。其中,ATO浓度为5.0 μmol/L时,12h对细胞的抑制率为51.7%,同浓度24h及48h抑制率分别为61.6%,80.2%。不同浓度ATO(1.0-5.0μmo/L),以24h为例,ATO对细胞的抑制率从42.9%升至61.1%。

图1 ATO抑制RPMI8226细胞抑制率曲线
2.2 ATO对多发性骨髓瘤RPMI8226细胞周期变化
选取1.0,2.0,3.0,4.0,5.0(μmol/L)ATO 作用于RPMI8226细胞48h为例,选用各自未加药组细胞为对照,AnnexinⅤ/PI法,检测细胞周期变化情况(见表2)。流式细胞检测结果分析,随着ATO浓度的增加,G1期细胞数逐渐增多,提示ATO将RPMI8226细胞阻滞在G1期(如表2)。

表2 流式细胞仪检测不同浓度ATO作用48h后细胞周期变化
2.3 ATO对多发性骨髓瘤RPMI8226凋亡的影响
选取1.0,2.0,5.0μmol/L的ATO作用于RPMI8226细胞24h、48h两个时间点,各自选用未加药细胞组为对照,AnnexinⅤ/PI法,检测细胞凋亡情况(见图2及图3)。结果提示ATO可诱导RPMI8226细胞凋亡,1.0μmol/L的ATO在24h诱导细胞凋亡率是15.69%,相同浓度在48h是26.33%;5.0μmol/L组24h凋亡率为27.61%,48 h则为39.47%。与各自的空白组相对比,ATO诱导RPMI8226细胞凋亡,呈时间依赖性和浓度依赖性,P<0.05,有统计学意义。

图2 不同浓度ATO作用细胞24h后细胞凋亡情况
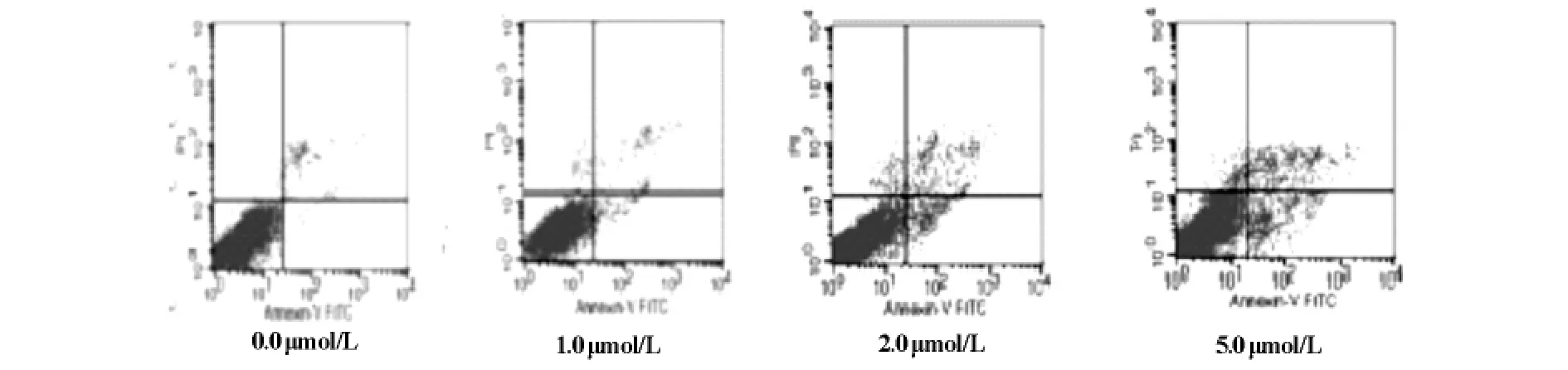
图3 不同浓度ATO作用细胞48h后细胞凋亡情况
2.4 ATO对多发性骨髓瘤RPMI8226自分泌VEGF的影响
ATO作用于人多发性骨髓瘤细胞株RPMI8226后,利用ELISA技术检测ATO作用RPMI8226细胞48h后,对细胞VEGF合成的影响。如表3所示:随着ATO药物浓度升高,VEGF表达及分泌量越少,与对照组相比,P<0.01,有统计学意义。
2.5 ATO对多发性骨髓瘤RPMI8226抗凋亡蛋白Bcl-2表达的影响
为了进一步研究ATO抑制多发性骨髓瘤RP MI8226细胞增殖的机制,我们检测了细胞内抗凋亡蛋白Bcl-2的水平。结果提示,随着ATO浓度升高及作用时间的延长,细胞内Bcl-2蛋白表达下降(如图4)。
表3 As2O3对RPMI8226细胞VEGF转录和分泌的影响(±s)

表3 As2O3对RPMI8226细胞VEGF转录和分泌的影响(±s)
注:与对照组比较,**P<0.01
组别 VEGF(ng/L)Ctrol 865.6±32.5 1mol/L As2O3 583.5±28.6**2mol/L As2O3 471.3±26.1**3mol/L As2O3 305.6±19.4**4mol/L As2O3 238.1±27.1**5mol/L As2O3 101.3±22.3**

图4 ATO作用24、48h后RPMI8226细胞内Bcl-2表达水平
2.6 ATO对多发性骨髓瘤RPMI8226ERK1/2及其磷酸化蛋白表达的影响
本实验进一步研究ATO作用于RPMI8226细胞后ERK变化情况。我们选取ATO处理后48h,ATO 终浓度分别为0、1.0、2.0、3.0、4.0、5.0μmol/L六个组,并以β-actin为内参照,利用 Western blot法检测RPMI8226细胞内ERK1/2蛋白及其磷酸化蛋白表达量。结果显示,各组细胞均有ERK1/2蛋白表达,组间比较表达量无明显差异(如图5)。

图5 ATO作用48h后RPMI8226细胞内ERK表达水平
3 讨论
目前,ATO已用于复发和难治性MM的治疗,并取得可靠疗效。体外实验研究表明,ATO是通过不同的途径,对不同的多发性骨髓瘤细胞系的进行抑制,从而诱导MM 细胞凋亡,包括 MAPK途径、JAK/STAT 途径,线粒体凋亡途径等[4、5]。对于ATO作用于MM细胞凋亡的机制,国内外实验结论各不相同,尚存在很大争议。
本实验应用CCK-8法,对不同浓度ATO作用细胞12h、24h、48h后,检测ATO对多发性骨髓瘤RPMI8226细胞系有明显抑制作用,其作用呈时间依赖和浓度依赖性。并且ATO能够诱导人多发性骨髓瘤RPMI8226细胞凋亡,其作用同样具有时间依赖和浓度依赖的,ATO将RPMI8226细胞阻滞在G1期。
骨髓瘤细胞可以分泌VEGF,并且VEGF分泌水平与肿瘤不同疗效及预后之间存在着密切的联系[6]。高水平VEGF是疗效不佳的影响因素之一,VEGF可以直接促进骨髓瘤细胞生长,证明VEGF还可以通过自分泌途径促进肿瘤细胞生长。我们应用ATO作用于人多发性骨髓瘤细胞株RPMI8226,观察其对瘤细胞VEGF合成分泌的影响,结果显示ATO可抑制RPMI8226细胞VEGF的分泌,提示此可能也是ATO抑制RPMI8226细胞生长的机制之一。
本研究显示:经不同时间,不同浓度ATO作用后,RPMI8226细胞ERK及磷酸化ERK水平未见明显变化。随着ATO作用浓度与时间的延长,Bcl-2水平明显下降,且呈时间及剂量依赖性,因此,提示ATO促进多发性骨髓瘤RPMI8226细胞凋亡作用主要是通过下调 Bcl-2来实现的[7]。Bcl-2其对细胞的作用并不影响细胞的增殖,而是通过抑制细胞凋亡从而增加了肿瘤发生的机会并促进肿瘤的发展[8]。
总之,体外实验表明ATO具有抑制多发性骨髓瘤细胞增殖及VEGF表达。其可能的机制为ATO将RPMI8226细胞阻滞在G1期,Bcl-2基因功能的下调也可能是重要的机制。ATO对RPMI8226细胞的这种抑制作用,表明其可能是一种很好的抗多发性骨髓瘤的药物,值得进一步动物实验及临床研究。
[1]Shen ZX,Chen GQ,Ni JH,et al.Use of arsenic trioxide(As2O3)in the treatment of acute promyelocytic leukemia(APL):Ⅱ.Clinical efficacy and pharmacokineties in replaced patients[J].Blood,1997,89(9):3358.
[2]Miller WH Jr,Schipper HM,Lee JS,et al.Mechanisms of action of arsenic trioxide[J]Cancer Res,2002,62:3901.
[3]Reed JC,Double identity for proteins of the Bcl-2family[J].Nature,1997,387(6635):775.
[4]曹 琦,韦国桢,郭红荣.三氧化二砷诱导恶性肿瘤细胞凋亡机制的研究进展[J].现代肿瘤学,2007,15(5):732.
[5]Risau W,Mechanisms of angiogenesis[J].Nature,1997,386(6626):673.
[6]Chen GQ,Zhu J,Shi XG,et al.In vitro studies on cellular and molecular mechanisms of arsenic trioxide(As2O3)in the treatment of acute promyelocytic leukemia:As2O3induces NB4cell apoptosis with downregulation of Bcl-2expression and modulation of PML-RARalpha/PML proteins[J].Blood,1996,88(3):1058.
[7]Ge F,Lu XP,Zeng HL,et al.Proteomic and functional analyses reveal a dual molecular mechanism underlying arsenic-induced apoptosis in human multiple myeloma cells [J].Proteome Res,2009,8(6):3017.
[8]Wong WW,Puthalakath H.Bcl-2family proteins:the sentinels of the mitochondrial apoptosis pathway[J].IUBMB Life,2008,60(6):396.
