在HER2过表达乳腺癌细胞中曲妥珠单抗抵抗的分子机制
2012-11-24万广稳刘晶晶徐广甍乔士兴
万广稳,张 研,刘 斌,刘晶晶,徐广甍,乔士兴
(吉林大学第二医院,吉林 长春130041)
乳腺癌是严重影响妇女身心健康甚至危及生命的最常见的恶性肿瘤之一,随着环境、饮食及生活习惯等的改变,我国乳腺癌的发病率呈逐年上升趋势。研究结果显示在25%-30%的乳腺癌中存在HER-2基因异常扩增及其蛋白的过度表达[1,2]。HER-2阳性的乳腺癌患者恶性程度高,预后差,该指标已成为评价乳腺癌预后的重要指标。
目前靶向HER-2进行基因治疗方法有多种,如RNA干扰(RNAi)、反义寡核苷酸、抗HER-2疫苗、酪氨酸激酶抑制剂、细胞内单链抗体等,其中应用临床并证明有效的药物是曲妥珠单抗(TZB),其对HER-2阳性乳腺癌的治疗是革命性的成果,即使化疗无效的乳腺癌患者应用TZB治疗仍部分有效,曲妥珠单抗联合放化疗大大提高了HER-2阳性乳腺癌的有效率,延长了患者的生存时间及减少复发率。目前我们通常根据免疫组化所测定的HER2蛋白表达情况或原位荧光杂交(FISH)所测定的HER2基因扩增情况,来选择是否采用曲妥珠单抗治疗。然而,即使是HER2高表达或基因扩增的患者,曲妥珠单抗有效率也仅为12%-34%,许多患者在接受治疗的12个月内出现疾病进展,如何提高曲妥珠单抗的有效率是目前需要解决的问题。近来国外研究表明,自噬具有保护乳腺癌细胞免遭化疗、缺氧、代谢应激等导致的细胞死亡作用,本实验通过RNAi减少微管相关蛋白1轻链3-β(LC3)表达来证明是否可以提高TZB对乳腺癌细胞生长抑制作用。
1 材料与方法
1.1 主要试剂与仪器 微管相关蛋白(LC3B)一抗为美国Signaling公司产品;羊抗兔及兔抗鼠二抗购自北京中山金桥公司.赫赛汀,美国Genentech公司,储存在4°C,浓度为21mg/ml。
1.2 细胞培养 乳腺癌细胞株SKBR-3(购自中科院上海细胞库),200μg/ml TZB诱导维持建立耐TZB的SKBR3细胞,用DMEM培养基(含15%FBS及青霉素与链霉素各100U/ml),37℃,5%CO2培养箱中培养,用0.25%胰酶(0.2%EDTA)消化并传代,取对数生长期细胞进行实验。
1.3 构建含目的基因的慢病毒载体 在NCBI数据库中查找LC3的基因序列,按照siRNA设计原则,利用Ambion公司在线设计软件设计siRNA序列,选出一个核苷酸序列针对LC3干扰靶点,进行Blast基因同源性分析以保证基因沉默的特异性。
①靶序列:(基因序列1043-1061):
5'-GCTAGAGAGATCTCCCTAA-3'
②无义对照目标基因序列:
5'-GACTTCATAAGGCGCATGC-3'
用siRNA Hairpin寡核苷酸序列设计软件设计成双链发夹结构。
将shRNA转入到慢病毒中(构建含有目的基因的慢病毒载体由上海吉玛公司协助完成)。
1.4 目的基因转染TZB抵抗的SKBR3乳腺癌细胞株 第一天:1.靶细胞铺板24-well加入0.5×105cells/well,0.5ml完全培养液,37℃,5%CO2过夜;第二天:2.稀释病毒:稀释液400μl+终浓度5 μg/ml Polybrene将慢病毒原液40ml加入稀释液;3.移去细胞培养液,加入Step 2稀释后的病毒液,同时建立对照,37℃,5%CO2过夜;第三天4.12-24小时移去细胞转染后的病毒液,加入0.5ml的完全培养液,37℃,5%CO2过夜;第四天:5.依据细胞的形态和类型,加入0.5ml的完全培养液,37℃,5%CO2过夜;第六天:6.通过蛋白电泳及PCR检测基因的表达及调控。
1.5 实验分组 以SKBR3乳腺癌细胞及SKBR3-TR细胞为研究对象,来研究LC3表达情况。以SKBR3-TR细胞为研究对象,实验分三组,一组SKBR3-TR细胞为正常组,一组慢病毒载体介导的RNAi无义基因转染SKBR3-TR细胞为阴性对照组(SKBR3-TR+NC);另外一组为慢病毒载体介导的RNAi LC3转染SKBR3-TR细胞为实验组(SKBR3-TR+LC3Ri)。
1.6 实时定量PCR检测LC3mRNA的表达 根据Genbank中序列设计特异性扩增引物,目的基因引物序列 MAPLC3B:5′-CCTAGAAGGCGCTTACAGCT-3′,产物长度186bp,内参GAPDH引物序列:5′-GCACCGTCAAGGCTGAGAAC-3′,产物长度138bp。收集细胞,用Trizol试剂提取总RNA。取500ng总mRNA反转录为cDNA,cDNA 4倍稀释,利用SYBR染料法在PCR仪上扩增,建立MAPLC3B的标准曲线,溶解曲线及扩增曲线。PCR反应条件:95℃预变性5s;95℃变性5s,60℃退火20s,共45个循环。以阴性对照组为校正样本,按照ΔΔCt解析法来进行目的基因与管家基因的相对定量。
1.7 Western blot检测自噬相关蛋白的表达 收集细胞,用1×PBS洗涤3次,每次1 500r/min离心5min,弃上清,加入适量冰预冷的含有PMSF单核细胞裂解液,冰浴30min,12 000r/min离心5 min,取上清移入新Ep管中。蛋白煮沸5min进行变性,分别用10% 和12%SDS聚丙烯酰胺凝胶电泳分离样本蛋白,电转移至硝酸纤维素滤膜上,5%脱脂牛奶封闭1h,一抗作用4℃过夜,二抗室温孵育1h,ECL化学发光法显色,X光胶片显影,Quantity One软件进行电泳条带灰度分析,以相应蛋白条带的平均灰度值与GAPDH蛋白平均灰度值的比值表示各组蛋白表达水平。
1.8 细胞存活率 细胞种在96孔板,(实验分组同前,同时加入SKBR3细胞作为对照,每组设3个复孔),种植密度4×103/孔。细胞种植24小时后加入200μg/ml曲妥珠单抗,96小时后检测细胞活性。应用Cell Counting Kit-8(CCK-8)(DOJINDO公司)试剂盒检测,96孔板每孔加入100μg的培养液和10μg的CCK8,继续培养4小时后,用酶标仪450nm处测量吸光度值.
1.9 统计学分析 采用SPSS 13.0统计软件进行统计学处理,LC3mRNA与蛋白表达水平、细胞存活率均用Mean±SD表示,组间比较采用单因素方差分析。
2 实验结果
2.1 SKBR3组与SKBR3-TR组LC3蛋白表达水平
结果提示耐TZB的SKBR3细胞组较正常组LC3的表达明显增高,有统计学意义(P<0.05)(见图1)。
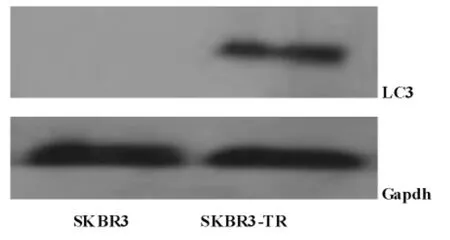
图1 蛋白免疫印迹法检测2组细胞中LC3蛋白的表达水平
2.2 不同SKBR3-TR细胞组LC3蛋白水平的变化
实验组LC3蛋白表达较正常组及阴性对照组明显降低,实验组与对照组比较差异有统计学意义(P<0.05)(见图2),说明LC3被成功沉默。
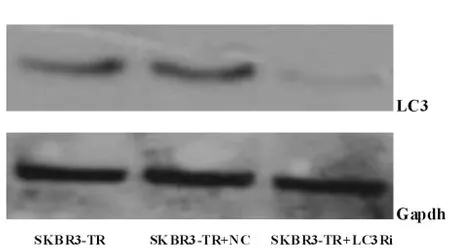
图2 蛋白免疫印迹法检测3组细胞中LC3蛋白的表达水平
2.3 实时荧光定量PCR检测3组细胞中LC3mRNA的表达水平
实时荧光定量PCR结果显示:实验组LC3蛋白表达较正常组及阴性对照组明显降低,实验组与对照组比较差异有统计学意义(P<0.05)(见图3),正常组与阴性对照组无统计学意义(P>0.05),在mRNA水平上证实LC3的沉默。
2.4 细胞存活率
CCK-8实验结果:实验组LC3被沉默后,细胞存活率较正常组及阴性对照组明显降低(见图4),实验组与对照组有统计学意义(P<0.05),说明LC3在曲妥珠单抗治疗HER2阳性乳腺癌抵抗中发挥着重要的作用,正常组与阴性对照组无统计学意义(P>0.05)。
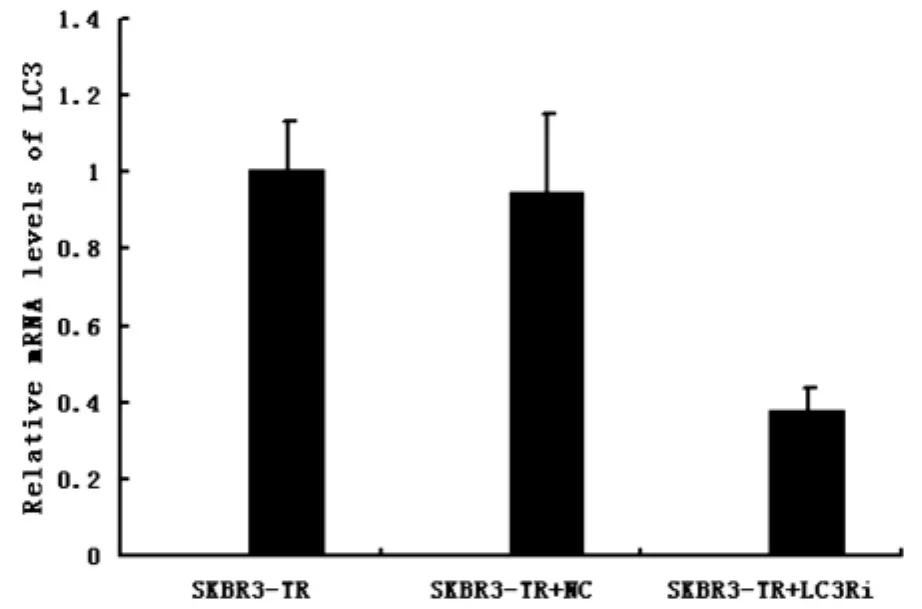
图3 实时荧光定量PCR检测3组细胞中LC3mRNA的表达水平
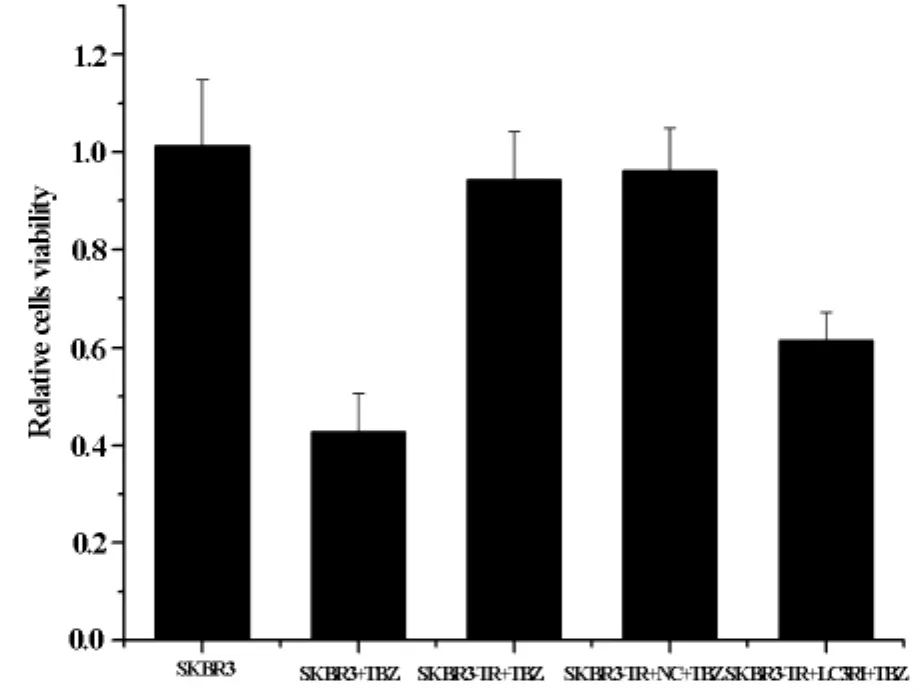
图4 CCK-8检测3组细胞存活率
3 讨论
自噬性细胞死亡(Autophagic cell death简称自噬),属于Ⅱ型程序性细胞死亡,是除了凋亡以外的另一种程序性死亡方式,是真核细胞所共有的一种通过降解细胞内过多或异常蛋白、细胞器等以维持正常细胞功能的机制,而在细胞无法继续维持自身生存时诱导细胞主动性死亡[3]。在肿瘤细胞中,自噬有两方面的生理学功能,一方面,自噬是一种肿瘤抑制基因的机制,另一方面,自噬在肿瘤进展中对抗各种微环境的变化,包括对各种抗癌疗法的形成耐受[4]。
有一些肿瘤细胞有较高的自噬活性,自噬可以使肿瘤细胞耐受低营养、缺氧、化疗及放疗等,从而延长肿瘤细胞寿命,特别在肿瘤进展过程中,肿瘤微环境发生巨大的变化,包括血供不足所造成的营养、生长因子、氧供等不足,肿瘤细胞可以依靠自噬作用将胞内物质降解和循环利用得以继续存活。自噬缺陷可以使功能紊乱线粒体的聚集,增加有氧应激对细胞膜、蛋白质和DNA的破坏,从而对肿瘤细胞生长产生破坏[5]。在放疗诱导乳腺癌细胞凋亡过程中,常会出现肿瘤细胞的辐射耐受现象,从而逃逸凋亡,达不到理想的治疗效果。自噬通过去除受损的细胞器,保护肿瘤细胞以对抗抗癌治疗比如放疗、化疗,使肿瘤细胞逃避凋亡[6],自噬抑制后,可以增加化疗的疗效[7]。相关研究表明:提高自噬可减轻或者避免凋亡所引起的死亡,而抑制自噬则可有利于肿瘤细胞的凋亡[8]。
RNAi是利用生物体内固有的机制,回避了其它方法带来的不确定性,特异的抑制基因的表达,其具有特异性、长度依赖性、快速性 、遗传性、高效性等优点,在研究中已广泛应用,通过干扰某个基因来特异性的研究该基因的特性,本实验通过特异性沉默LC3基因来检测其作用。
曲妥珠单抗是一种人源化的P185胞外区的重组单克隆抗体,最早于1984年Drebin[9]等人提出,于1998年在美国批准上市,它代表了一种对人类疾病的分子靶向药物的开发成功和令人兴奋的模型,它通过将自己附着在HER-2上来阻止人表皮生长因子在HER-2的附着,进而阻断了乳腺癌细胞的生长,同时还可以刺激自身的免疫细胞来杀死乳腺癌细胞。目前研究表明,HER2阳性乳腺癌单抗耐药有以下几种机制:(1)细胞表面蛋白位阻HER2受体导致赫赛汀无法有效与 HER2结合;(2)HER2的下游信号通路上调 HER2下游PI3K/Akt及Ras/MAPK信号通路持续活化;(3)替代信号通路:增加了其他受体的信号。胰岛素样生长因子I型受体(IGF-IR)通路过度活化与赫赛汀耐药有关;(4)受损的免疫介导机制[10]。本实验通过实时定量PCR、蛋白免疫印迹检测LC3mRNA、蛋白的表达证明LC3被沉默,通过CCK-8检测结果提示耐TBZ的乳腺癌细胞存活率明显降低,说明LC3在HER2阳性乳腺癌对曲妥珠单抗抵抗过程中发挥重要作用,而LC3是自噬的重要标志,说明自噬在引起TZB抵抗中可能发挥某种重要的调控机制。
目前被证实的可以抑制自噬的临床相关的药物相对较少,动物肿瘤模型上的研究表明,自噬抑制剂有如质子泵抑制剂奥美拉唑和顺铂,抗疟疾药物氯喹[11]等,随着研究的深入这些药物在未来的临床试验中可能与曲妥珠单抗联合,有助于提高曲妥珠单抗对HER2阳性乳腺癌治疗的疗效.
[1]Slamon DJ,Clark GM,Wong SG,et al.Human breast cancer:correlation of relapse and survival with amplification on HER-2/neu oncogene[J].Science,1987,235(4785):177.
[2]Slamon DJ,Godolphin W,Jones LA,et al.Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer[J].Science,1989,244(4905):707.
[3]Hara T,Nakamura K,Matsui M,et al,Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J].Nature,2006,441(7095):885.
[4]Amaravadi RK,Thompson CB.The roles of therapy-induced autophagy and necrosis in cancer treatment[J].Clin Cancer Res,2007,13(24):7271.
[5]Jin S.mitochondrial quality control,and oncogenesis[J].Autophagy,2006,2(2):80.
[6]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular selfdigestion[J].Nature,2008,451(7182):1069.
[7]Vazquez-Martin A,Oliveras-Ferraros C,Menendez JA.Autophagy facilitates the development of breast cancer resistance to the anti-HER2monoclonal antibody trastuzumab[J].PLoS One,2009,4(7):e6251.
[8]Amaravadi RK,Yu D,Lum JJ,et al.Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma[J].J Clin Invest,2007,117(2):326.
[9]Drebin JA,Stern DF,Link VC,et al.Monoclonal antibodies identify a cell-surface antigen associated with an activated cellular oncogene[J].Nature.1984.312(5994):545.
[10]Fiszman GL,Jasnis MA.Molecular Mechanisms of Trastuzumab Resistance in HER2Overexpressing Breast Cancer[J].Int J Breast Cancer,2011:352182.
[11]Amaravadi RK.Autophagy-induced tumor dormancy in ovarian cancer[J].J Clin Invest,2008,118(12):3837.
