缺失线粒体DNA的人喉癌细胞系的建立
2012-11-24程鹤香
王 磊,程鹤香,赵 倩,陈 鸥,赵 明*
(1.吉林大学第二医院 耳鼻咽喉科,吉林 长春130041;2.佳木斯市中心医院 耳鼻咽喉科)
喉癌是东北的高发癌症之一,其主要的治疗方法主要是手术、放化疗等。其病因主要与吸烟相关,可能的机制是吸烟产生的毒性致癌物质导致的线粒体DNA损伤所致。近年研究发现在许多人类肿瘤中有大量的线粒体基因组缺陷,线粒体基因组改变的频率非常高,包括膀胱、头颈、肺和乳腺、前列腺肿瘤等。体细胞线粒体DNA突变被认为是肿瘤早期发生的标志。线粒体DNA突变是否参与肿瘤形成及寻找线粒体中的体细胞突变是目前肿瘤研究的热点[1-3,14]。
研究喉癌的线粒体功能和突变,需要有喉癌细胞的线粒体缺失细胞,由于线粒体缺失细胞系的构建非常困难,所以一直以来人们利用1989年由Attardi构建的无线粒体的骨肉瘤细胞系进行线粒体功能研究,但是不同种类的细胞结构,生长,分化突变特点等均有特异性,如果进行喉癌线粒体功能的研究,能有线粒体DNA缺失的人喉癌细胞系,是非常重要的[4-7]。我们构建线粒体缺失的喉癌细胞,为后续构建融合喉癌细胞、线粒体突变和线粒体功能研究提供细胞模型,同时也为研究线粒体DNA突变和喉癌发生之间的关系奠定了基础。
本实验采用人稳定传代喉癌细胞系JHUo11作为母本细胞,通过低剂量溴化乙锭持续作用于该细胞,诱导线粒体缺失DNA,成功制备出ρ0(无线粒体)细胞。
1 材料与方法
1.1 主要试剂与仪器
RPMI1640培养基、胎牛血清购自美国 Hyclone公司;溴化 乙锭 (ethidium bromide,EtBr,EB)、丙酮酸(pyruvate)、尿苷(urideine)购自美国Sigma公司;动物细胞基因组DNA快速提取试剂盒购自北京庄盟生物基因科技有限公司;PTC200 PCR仪 ;TECNAI10透射电子显微镜;恒温二氧化碳培养箱。
1.2 ρ0细胞的构建
人喉癌细胞o11在加10%FBS的RPMI1640培养基中培养,生长良好后开始进行ρ0细胞的构建。将生长良好的喉癌细胞o11分装在4个培养盘中,并标号。细胞放入37℃、5%CO2培养箱中继续长期培养,期间约2d换液1次,3~4d或细胞生长融合达80%时传代1次。每次换液或传代时各个序号的培养盘加入丙酮酸、尿苷。加或不加溴化乙锭。见表1。

表1 四组o11细胞加入药品列表
1.3 无mtDNA的细胞系鉴定
1.3.1 光镜下观察无线粒体细胞系及生长缺陷的鉴定 将经EB处理90天后的人喉癌细胞o11换用含10%胎牛血清及RPMI1640培养基中培养(不含丙酮酸钠和尿嘧啶),每2-4天换液1次,与同批非选择培养的人喉癌细胞作对照,观察细胞生长、形态及死亡情况。
1.3.2 PCR检测 将各组细胞经胰酶消化,离心收集细胞。参照试剂盒提供的操作说明进行。将全基因组DNA提取后进行PCR扩增。目的基因为线粒体DNA上任选一段序列,正向引物为(5’-GGTCTATCACCCTATTAACCAC-3’)(nt 8-29);反向引物为(5’-CTGTTAAAAGTGCATACCGCCA-3’)(nt 408–429),扩增产物为420bp。反应体系按操作说明书设定,按以下反应条件进行扩增:预变性94℃5min,然后变性94℃30s,复性55℃30s,延伸72℃1.5min共30个循环,最后72℃延伸10min。产物在10%琼脂糖凝胶电泳分析。在1号细胞中有线粒体编码的基因杂交条带显示,而在线粒体DNA完全缺失的细胞株中(3号)无相应杂交条带显示。电泳液为TBE缓冲液,电泳1.5h,紫外灯下观察并拍照。
1.3.3 健那绿染色活细胞 健那绿(Janu’s Green B)(sigma公司)是脂溶性的碱性染料,是对线粒体专一的活细胞染料,可使线粒体呈现蓝绿色,而细胞质接近无色,毒性很小,通常线粒体的鉴定用健那绿活染法。配制1%健那绿染液:将0.5g健那绿溶解于50mL生理盐水中,加温到30-40℃,使其充分溶解。将1号对照盘细胞和经过PCR鉴定的3号盘细胞分别放入35mm的培养盘中,当细胞生长融合达80%时加入1%健那绿2滴,等2-5分钟后置于高倍光镜下观察。
2 结果
人喉癌细胞培养良好后开始进行mtNDA耗损实验,1号培养盘为不加EB的对照细胞,平均每两日需传代一次。细胞生长速度最快。2号培养盘中的细胞在含有50ng/ml EB培养液中生长较为迅速,平均每3天即可传代,2号培养盘中的细胞增殖较3号培养盘中的细胞快,3号培养盘细胞加入75 ng/ml溴化乙锭,细胞增殖较慢,需每4天换液。持续作用90天后成功构建。4号培养盘中加入EB100ng/ml,细胞生长速度最慢,需一周传代一次,培养至2周时细胞80%以上悬浮死亡。每组细胞、、细胞在加EB初期死亡细胞明显增多,生长速度减慢,随着培养时间的增长,细胞对EB的毒性效应逐渐耐受,死亡细胞逐渐减少。细胞在溴化乙锭的慢性毒性作用过程中,光镜观察细胞结构,发现细胞形态变大,变圆,透光度增加,见图1,2。
将1号、2号、3号盘中的细胞全基因组DNA提取后进行PCR扩增。目的基因为线粒体上的基因片段约420bp,PCR结果显示,对照组1号培养盘扩增出目的片段位于500bp附近,3号盘未扩增出,2号盘扩增出500bp的片段,颜色比1号盘明显变浅,因此可证实3号培养盘细胞中mtDNA已被完全去除,见图3,左起第一为DNA marker,依次是3号盘细胞,1号盘,2号盘。2号盘的细胞经EB处理后,其中的线粒体DNA已大部分消失,但由于EB浓度较低还不足以将线粒体DNA完全去除,故表现为弱浅条带。而4号盘由于EB浓度过高,喉癌细胞系o11不能耐受EB的毒性,故2周内逐渐死亡。
图1 光镜下未加EB的o11细胞

图2 光镜下加EB 90天的o11细胞
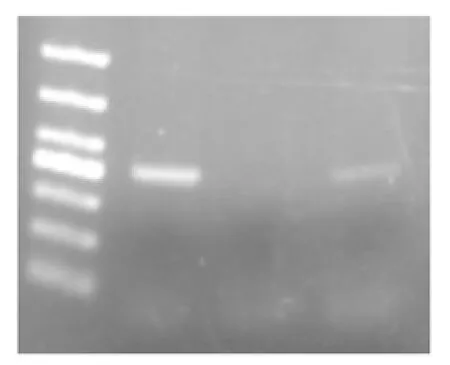
图3 处理90天后各组细胞线粒体DNA的PCR结果
将已经去除线粒体的3号盘细胞1:2传代分装在3a盘和3b盘中。两盘细胞均不加EB,3a盘中细胞在加丙酮酸及尿苷培养液中培养,浓度及量同前。3b盘中细胞在不加丙酮酸及尿苷培养液中培养,发现3a盘中的细胞在有丙酮酸及尿苷的培养基中正常生长。而3b盘中细胞在无丙酮酸及尿苷的培养基中第1天开始细胞逐渐悬浮、肿胀至第三天死亡。这种嘧啶和丙酮酸依赖性说明,线粒体DNA已耗尽。
健那绿是脂溶性的碱性染料,易于被细胞吸收,是对线粒体专一的活细胞染料,解离后带正电,由电性吸引堆积在线粒体膜上。线粒体中细胞色素氧化酶使染料保持氧化状态(即有色状态)呈蓝绿色而使线粒体显色,而在周围的细胞质中染料被还原,成为无色状态。1号盘细胞是未经处理的对照细胞,线粒体正常存在,健那绿染色后可见蓝绿色散在线粒体分布,而3号盘中未见蓝绿色染色体。见图4和图5。由于健那绿对线粒体有专一性,进一步证实3号盘细胞为无线粒体的ρ0细胞。
3 讨论
目前对于无线粒体细胞的诱导培养方法较多,较经典的是溴化乙锭诱导法,其他的有抑制呼吸链复合物Ⅰ、Ⅲ的鱼藤酮及抗癌药物地特氯铵诱导法、抗爱滋病药物双脱氧胞苷诱导法、质粒转染诱导法[4,6,10]。

图4 未加EB处理的o11细胞(健那绿染色)

图5 加EB 90天后的o11细胞(健那绿染色)
无线粒体细胞(ρ0)是通过长期暴露于低浓度的溴化乙锭而建立的,溴化乙啶可以与mtDNA的双链较牢固结合,抑制细胞分裂时的mtDNA的复制和转录,使细胞分裂后mtDNA数量每次减少1/2,逐次减少,数量表示为原来数量的1/2n。由于细胞线粒体内有限的mtDNA拷贝,当分裂次数n足够大时,数量的1/2n将接近零,即细胞线粒体内没有有效的 mtDNA[5,9]。
溴化乙锭耗损mtDNA的剂量和作用时间在不同的细胞差别较大,剂量从25ng/ml到5μg/ml不等,处理时间由20多天到210多天。细胞ρ0是一类完全缺少mtDNA的细胞。自从King和Attardi利用骨肉瘤细胞构建出第一个人类ρ0细胞后,目前已有多种类型的细胞ρ0产生,如 HeLa细胞、SKHep1细胞、肺癌细胞系等ρ0细胞,但仍有许多细胞株不能被诱导成功[4,14]。判断一种细胞是否能培养成ρ0细胞,将细胞用EB处理一定时间后,将均加入相等的丙酮酸钠及尿嘧啶。2、3、4号盘中的养,若细胞在无尿嘧啶的培养基中逐渐悬浮、肿胀,死亡,而在有尿嘧啶的培养基中正常生长,则该细胞具有较强的培养成ρ0细胞的潜力;如果两种培养基中细胞均正常生长,则该细胞可能对药物有耐性,不能失去mtDNA,很难培养成细ρ0胞;如果两种培养基中细胞均死亡,也不可能培养成ρ0细胞[11-13]。
线粒体DNA缺失细胞系,其原理可抑制整个胞浆中的线粒体DNA的复制,但不影响核DNA复制。无二氢乳氢酸脱氢酶活性,具有尿嘧啶和丙酮酸依赖性,利用丙酮酸通过糖酵解途径获得能量,需补充外源性丙酮酸和尿苷来维持其生存[5,11,12],还能够接受外源性线粒体DNA发挥作用[10]。本实验选用75μg/ml的浓度来耗损mtDNA,间隔一段时间采用光镜和PCR扩增检测人喉癌细胞mtDNA耗损的情况,结果发现细胞在耗损开始阶段死亡的较多,但随着培养时间的延长死亡细胞逐渐减少,细胞逐渐适应了培养基的生长环境,经过大约90天就成功构建出ρ0细胞。
ρ0细胞的筛选非常困难,不易获得成功,即使成功,至少要几个月的时间,国内外尚未发现无线粒体喉癌细胞系构建的文章。线粒体DNA突变与头颈肿瘤的发生关系密切,ρ0细胞因缺乏mtDNA可以用来构建出各种胞质杂交融合细胞(cybrid),建立喉癌线粒体基因改变模型,我们可以利用该细胞研究相同的核遗传背景下不同线粒体DNA分子的基因改变及功能变化,为喉癌的发生机制和线粒体DNA突变的相关性的研究奠定基础。
[1]Livre A,Blons H,Houllier AM,et al.Clinicopathological significance of mitochondrial D-Loop mutations in head and neck carcinoma[J].Br J Cancer,2006,94(5):692.
[2]Prior SL,Griffiths AP,Baxter JM,et al.Mitochondrial DNA mutations in oral squamous cell carcinoma[J].Carcinogenesis,2006,27(5):945.
[3]Kulawiec M,Safina A,Desouki MM,et al.Tumorigenic transformation of human breast epithelial cells induced by mitochondrial DNA depletion[J].Cancer Biol Ther,2008,7(11):1732.
[4]Hashiguchi K,Zhang-Akiyama QM.Establishment of human cell lines lacking mitochondrial DNA[J].Methods Mol Biol,2009,554:383.
[5]King MP and Attardi G.Human cells lacking mtDNA:repopulation with exogenous mitochondria complementation[J].Science,1989,246:500.
[6]Turner C.J,Granycome C,Hurst R et al.Systematic segregation to mutant mitochondrial DNA and accompanying loss of mitochondrial DNA in human NT2tera to carcinoma Cybrids[J].Genetics,2005,170:1879.
[7]Singh KK,Russell J,Sigala B,et al.Mitochondrial DNA determines the cellular response to cancer therapeutic agents[J].Oncogene,1999,18(48):6641.
[8]Kulawiec M,Owens KM,Singh KK.Cancer cell mitochondria confer apoptosis resistance and promote metastasis[J].Cancer Biol Ther,2009,8(14):1378.
[9]Armand R,Channon JY,Kintner J,et al.The effects of ethidium bromide induced loss of mitochondrial DNA on mitochondrial phenotype and ultrastructure in a human leukemia T-cell line(MOLT-4cells)[J].Toxicol Appl Pharmacol,2004,196:68.
[10]Trimmer PA,Keeney PM,Borland MK,et al.Mitochondrial abnormalities in cybrid cell models of sporadic Alzheimer's disease worsen with passage in culture[J].Neurobiol Dis,2004,15(1):29.
[11]Leibowitz RD.The effect of ethidium bromide on mitochondrial DNA synthesis and mitochondrial DNA structure in HeLa cells[J].J Cell Biol,1971,51:116.
[12]Ferraresi R,Troiano L,Pinti M,et al.Resistance of mtDNA-deleted cells to apoptosis[J].Cytometry,2008,73A:528.
[13]Lee W,Choi HI,Kim MJ,et al.Depletion of mitochondrial DNA upregulates the expression of MDR1gene via an increase in mRNA stability[J].Exp Mol Med,2008,40(1):109.
[14]Modica Napolitano J,Singh KK.Mitochondrial dysfunction in cancer[J].Mitochondrion,2004,4(5/6):755.
