孕烷X受体抗食管癌EC9706细胞凋亡的作用机制
2012-11-20谢晶华解智慧史祖宣樊青霞郑州大学第一附属医院肿瘤科一病区河南郑州450052
谢晶华 解智慧 史祖宣 樊青霞 (郑州大学第一附属医院肿瘤科一病区,河南 郑州 450052)
孕烷X受体抗食管癌EC9706细胞凋亡的作用机制
谢晶华 解智慧 史祖宣 樊青霞 (郑州大学第一附属医院肿瘤科一病区,河南 郑州 450052)
目的 研究孕烷X受体(PXR)抗食管癌EC9706细胞凋亡的作用机制。方法 使用利福平活化食管鳞癌 EC9706细胞中的PXR,阿霉素(ADM)诱导高表达PXR的EC9706细胞凋亡,采用流式细胞仪观察细胞的增殖周期,MTT法观察细胞凋亡率,Western印迹和免疫组化法检测Caspase-3,Bcl-2,Bax蛋白表达情况。结果 ADM处理可以明显抑制细胞生长;使细胞呈明显凋亡改变;利福平诱导PXR高表达的EC9706细胞凋亡减少,抑制Caspase-3的蛋白水平,上调蛋白Bcl-2的表达,表明PXR在抗食管鳞癌细胞凋亡中发挥重要的作用。结论 PXR可能是通过降低Caspase-3和升高Bcl-2蛋白的表达抑制食管癌细胞EC9706的凋亡。
食管癌;细胞凋亡;孕烷X受体;Caspase-3;Bcl-2
孕烷X受体(PXR),亦称为类固醇X受体,其主要生物学功能是参与机体对内源及外源化合物的代谢及排泄过程,是核受体家族重要成员之一。核受体在药物代谢转运和药物之间相互作用中扮演重要角色,尤其是PXR,其配体具有泛宿主性,很多药物包括抗癌药物都是其配体。近几年对PXR的基因定位、基因结构特点、组织分布、作用机制及其与多种肿瘤的关系等研究取得一定进展。本文拟研究PXR在抗食管癌 EC9706细胞凋亡的作用机制。
1 材料与方法
1.1 材料
人食管癌细胞株EC9706购自中国科学院上海细胞生物学研究所;RPMI1640培养基购自英国DIOMED;胎牛血清(FBS)购自Odyssey公司;胰蛋白酶购自Gibco公司;MTT试剂盒购自美国Sigma公司;羊抗鼠荧光二抗700购自LI-COR Biosciences基因公司;羊抗兔荧光二抗800购自LI-COR Biosciences基因公司;总RNA抽提试剂盒和RT-PCR反应试剂盒购自上海生物工程技术服务有限公司;HRP标记的羊抗鼠的二抗购自Rockland公司;β-actin鼠抗人的单抗购自 Sigma公司;BCA标准蛋白检测系统购自Pierce公司;蛋白预染Marker购自Fermentas公司。
1.2 MTT法检测细胞活力
将EC9706细胞分为两组,一组加0.1%二甲基亚砜(DMSO)作为处理对照组,另一组加10 μmol/L利福平作为处理组。预处理24 h后,接种于96孔板,每孔约1×103个细胞,设定3个复孔,两组均设调零空白对照组(不加细胞,只加相应培养基),连续培养,继续分别加入0.1%DMSO、10 μmol/L 利福平进行处理。将 1 μg/ml ADM 分别加入处于对数生长期的细胞培养瓶中,在第1、3、5、7天时,每孔加入 MTT溶液(5 mg/ml)20 μl,37℃孵育4 h后,小心吸去培养液,加入150 μl DMSO,溶解紫色结晶物,在微孔板振荡器上震荡10 min。用Model 550型酶标仪在波长490 nm测吸光度(OD值),以空白对照组调零。试验重复3次,取均值。
通过下列公式计算细胞生长抑制率:生长抑制率(%)=(实验组 OA490值-对照组 OA490值)/对照组OA490值×100%。
1.3 流式细胞仪检测细胞周期
将对数生长期的EC9706细胞用不含血清的新鲜培养液培养8 h,使细胞停止生长,处于同一细胞周期,然后将细胞制成悬液,调整细胞数为4×104个/ml,各取5 ml细胞悬液培养于75 ml细胞培养瓶,常规培养、消化、离心、收集各用药组(一组加0.1%DMSO作为处理对照组,另一组加10 μmol/L利福平作为处理组)和阴性对照组培养48 h的EC9706细胞,将1 μg/ml ADM分别加入处于对数生长期的细胞培养瓶中,用冷PBS液洗涤细胞两次,加入预冷70%的乙醇并均匀吹打,尽量制备成单细胞悬液,4℃冰箱固定24 h,随后再用冷PBS液洗涤细胞两次去除固定液,加1 ml碘 化 丙 锭 染 液(含 碘 化 丙 锭 100 μg/ml,RNA 酶100 μg/ml),混匀,置4℃避光染色30 min,上流式细胞仪,用氩离子激发碘化丙锭产生红色荧光,记录激发波长488 nm处红色荧光,检测细胞DNA含量。用计算机自带Multicycle(Phoenix Flow System,San Diego,CA,USA)软件分析,计算凋亡细胞百分数及细胞周期百分数。
1.4 Western印迹检测高表达PXR蛋白的EC9706细胞以及野生型 EC9706细胞中 Bcl-2、Caspase-3、B
(1)将EC9706细胞分为两组:一组加0.1%DMSO作为处理对照组,另一组加10 μmol/L利福平作为处理组。将1 μg/ml ADM分别加入处于对数生长期的细胞培养瓶中,作用48 h后,提取细胞核蛋白。约6×106个细胞,加预冷PBS漂洗2次,用细胞刮子快速将细胞刮下,500 r/min×3 min,弃上清,尽可能干燥沉淀,加200 μl细胞质蛋白和细胞核蛋白抽提试剂(CERI),剧烈漩涡振荡15 s,充分重悬,冰上10 min。
(2)从不同蛋白样品中取出等量蛋白(50 μg)与1×SDS凝胶上样缓冲液混合,加入4%体积的 β-巯基乙醇,煮沸10 min。然后在4℃下,15 000 r/min离心5 min。蛋白上样,经由10%SDS-PAGE分离胶分离,转印至PVDF膜上。将此膜取下,剪角后在5%脱脂奶粉封闭液中缓慢摇动2~4 h。然后。将特异性一抗按1∶1 000~1∶2 000稀释。与膜一起孵育过夜。1×PBST洗涤3次,每次10 min。随后将此膜与相应的二抗(1∶3 000~1∶4 000)一起孵育4 h。在1×PBST洗涤3次后,利用增强性化学发光试剂盒(ECL)检测特异性蛋白条带。由两位资深科研中心教授独立观察每张切片后一起做出判断。每例切片随机选择10个高倍视野(×400),每个视野计数100个细胞。
参照吴婵妮等〔2〕的方法如下计算结果:阳性率=(阳性细胞数/总细胞数)×100%。
1.5 免疫组化法检测EC9706细胞中的Capase-3、Bcl-2和Bax蛋白表达
载玻片经泡酸、清洗、高温灭菌后置于6孔培养板中,取对数生长期细胞胰酶消化成单细胞悬液后,将EC9706细胞分为两组:一组加0.1%DMSO作为处理对照组,另一组加10 μmol/L利福平作为处理组。将1 μg/ml ADM分别加入处于对数生长期的细胞培养瓶中,作用48 h后,以每毫升2×105个细胞浓度接种于6孔培养板中,每孔2.5 ml,培养24 h后弃去培养液,PBS洗涤3次,丙酮固定10 min。室温下0.5%H2O2-甲醇作用30 min,山羊血清封闭1 h,PBS洗涤后滴加一抗,4℃过夜,PBS洗涤后滴加生物素标记的兔抗鼠二抗工作液,室温作用30 min,PBS洗涤后滴加辣根酶标记链酶卵白素工作液作用1 h,PBS洗涤后DAB显色5 min,苏木素复染,中性树脂封片,倒置显微镜下观察。
1.6 统计学分析
2 结果
2.1 EC9706细胞生长曲线和倍增时间
在液体悬浮培养条件下,EC9706细胞呈单个散在贴壁生长。细胞种植密度为5×104/ml,此浓度细胞从换液后的第24~96小时呈指数增殖,实验测得EC9706细胞倍增时间为20~24 h(见图1)。
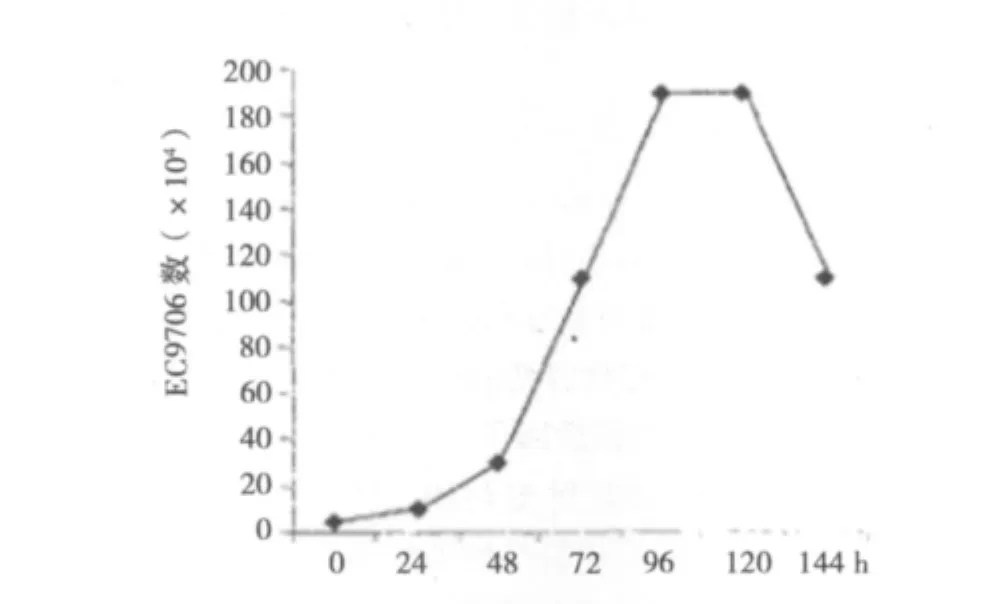
图1 食管癌EC9706细胞生长曲线
2.2 利福平活化核受体PXR对食管癌EC9706细胞增殖和化疗敏感性的影响
2.2.1 利福平对食管癌EC9706细胞核受体PXR表达的影响
根据以上结果,选择EC9706细胞作为研究PXR基因功能的对象。EC9706细胞经10 μmol/L利福平处理 48 h后,提取EC9706细胞核蛋白,采用Western印迹方法进一步检测PXR核蛋白表达水平变化。分子量50 kD位置,与0.1%DMSO处理对照组相比,利福平处理组核蛋白条带明显增粗,显色较深。这表明利福平刺激后可增强PXR蛋白在EC9706细胞核内表达(图2)。以上结果表明,利福平预处理后,可活化PXR,增强其核蛋白表达水平。
2.2.2 利福平活化PXR对食管癌细胞增殖的影响 在10 μmol/L利福平作用下,EC9706细胞增殖明显加快,第3、5、7天的490 nm波长处吸光度值(OD)分别为:0.682±0.048、1.183±0.156、1.817±0.095;而0.1%DMSO处理对照组相应的OD值分别为:0.528±0.035、0.920±0.036、1.402±0.092。相应时间内,利福平组OD值均明显高于DMSO组(P<0.05)。而第1天,利福平组和DMSO组OD值〔(0.155±0.006)vs(0.163±0.004)〕之间没有显著差异(P>0.05)。结果表明利福平活化PXR后,可促进EC9706细胞增殖。见图3。

图2 利福平处理EC9706细胞后PXR表达变化
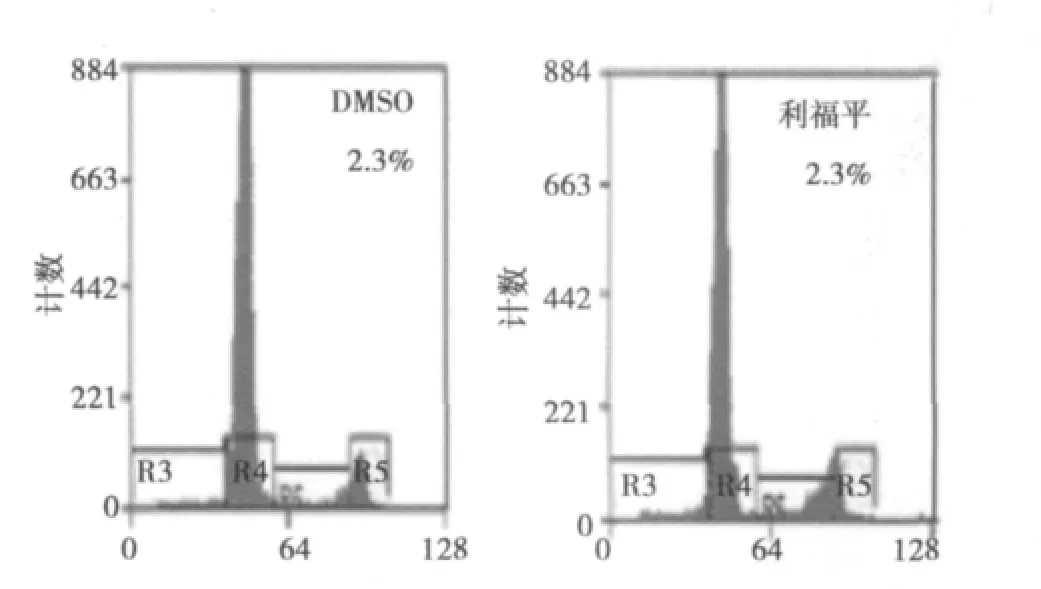
图3 利福平对EC9706细胞增殖的影响
2.3 PXR在抗ADM诱导EC9706细胞凋亡中的作用
2.3.1 流式细胞仪观察到的ADM处理空白组和PXR+利福平组EC9706细胞的增殖周期 在1 μg/ml阿霉素作用下,DMSO组EC9706细胞增殖明显加快,相应时间内,利福平组OD值均明显低于DMSO组(P<0.05)。结果表明利福平活化PXR后,可抑制EC9706细胞增殖。见图4。
2.3.2 MTT观察ADM处理空白组和PXR+RIF组EC9706细胞的凋亡率 在1 μg/ml ADM作用下,ADM处理的DMSO组EC9706细胞凋亡明显增多(P<0.01);ADM处理的RIF组EC9706细胞凋亡明显增多(P<0.01)。结果表明利福平活化PXR后,再用利福平处理后可降低EC9706细胞的凋亡率。见图5。
2.3.3 Western印迹检测ADM对利福平与DMSO组EC9706细胞中Caspase-3、Bcl-2和Bax蛋白表达的影响 ADM处理EC9706细胞后Caspase-3、Bcl-2和Bax的蛋白表达,以光密度指数(OD)表示三种蛋白表达的相对含量。所有样品检测均以DMSO处理组细胞为空白对照,用ipp7c软件计算出Caspase-3、Bcl-2和Bax蛋白的OD值。ADM处理的PXR+利福平组的Caspase-3蛋白的FI值均低于对照组;Bcl-2蛋白的OD值均高于对照组(P<0.05或P<0.01)。但Bax蛋白的OD值与对照组相比,则无明显差异(P>0.05)(图6)。
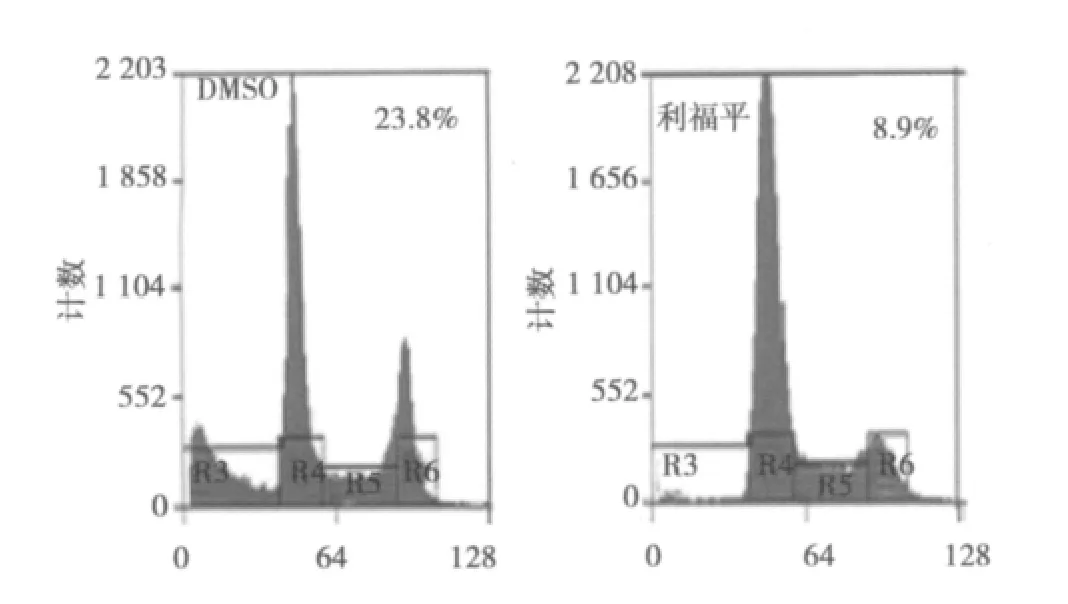
图4ADM处理DMSO组和RIF组对EC9706细胞增殖的影响
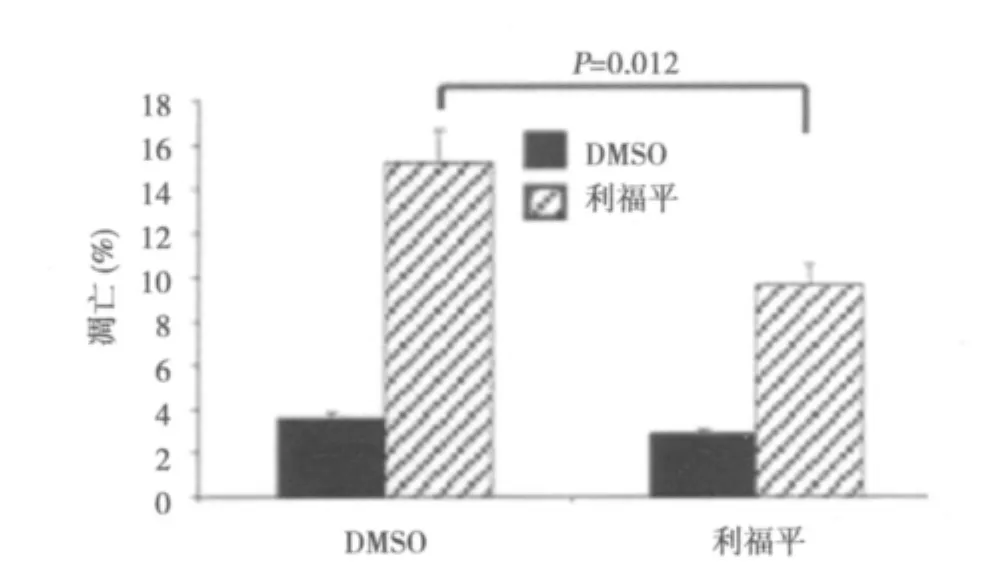
图5ADM处理DMSO组和RIF组EC9706细胞凋亡率的影响
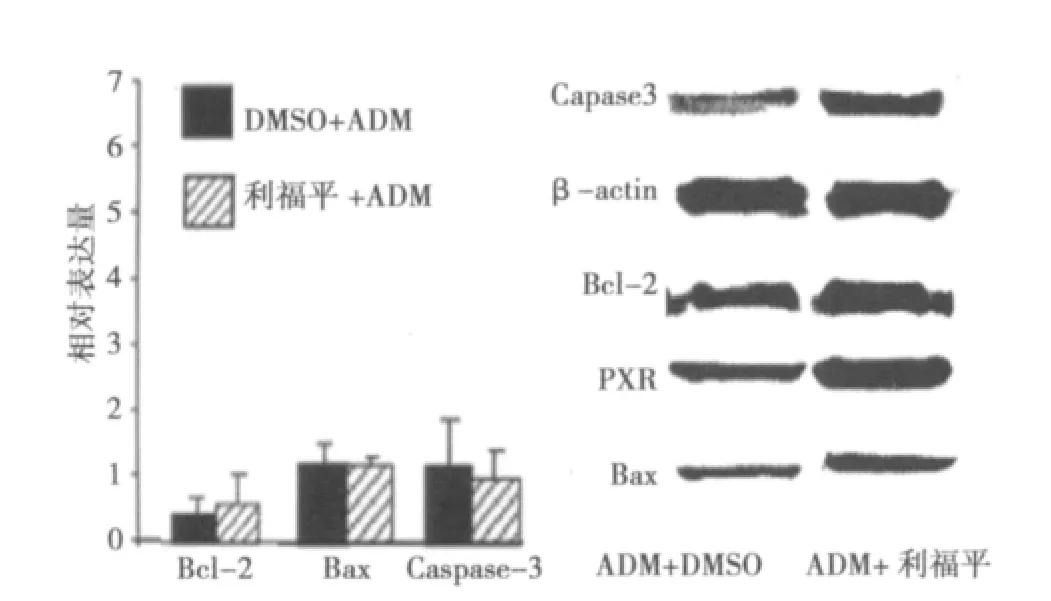
图6 Western印迹检测ADM处理DMSO组和利福平组EC9706细胞Caspase-3、Bcl-2和Bax蛋白表达的影响
2.3.4 免疫组化法观察到ADM处理的DMSO组和RIF+PXR组的Caspase-3,Bcl-2,Bax的表达情况 Caspase-3主要定位于细胞质,也可见于细胞核。Bcl-2和Bax定位于细胞质,亦可见于胞膜和核膜。着色明显高于背景,在相应部位出现棕黄色颗粒者为阳性细胞,不着色或显色强度与背景无差别者为阴性细胞。见图7。
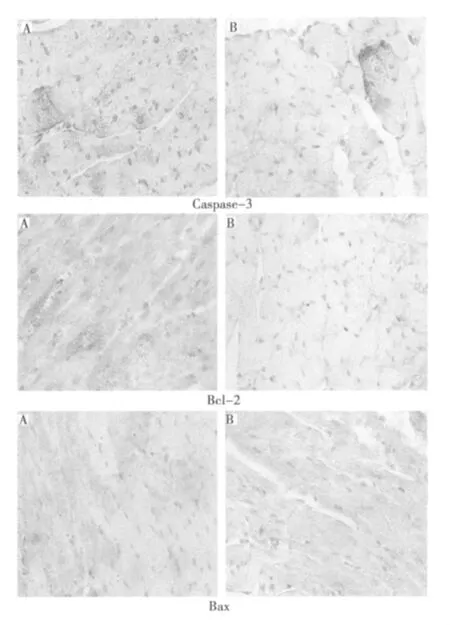
图7 免疫组化法观察到ADM处理的两组Caspase-3、Bcl-2和Bax的表达情况(×400)
3 讨论
PXR可通过上调多重抗凋亡基因包括 BAG3、BIRC、2MCL-1,下调凋亡基因如 BAKl、TP53/P53,Bcl-xL而起到对抗细胞凋亡的功能,从而对抗 DCA/LCA诱导的结肠癌变〔3〕。Daisuke等〔4〕报道PXR在食管鳞癌中是高表达的,而且是判断ESCC患者的一种潜在的预后因子。
ADM是一种常见的抗肿瘤药物,其抗瘤谱较广,对乳腺癌、肺癌、卵巢癌、胃癌、肝癌等多种癌症都有一定疗效,而且是治疗食管癌效果最好的化疗药物之一。ADM属细胞周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。已有文献报道,ADM诱导细胞凋亡的分子机制,可能是由于其部分分子结构可嵌入到DNA双链中形成稳定的复合物,影响DNA的结构和功能,阻止DNA复制和RNA的合成,还能抑制拓扑异构酶Ⅱ的功能,从而抑制肿瘤细胞的分裂和增殖〔1〕。有研究证实PXR的配体利福平及其他配体可增强CYP3A4和MDRl表达,前者可代谢50%以上的处方药,其中也包括部分抗癌药物。PXR配体具有泛宿主性,一些抗癌药如紫杉醇、顺铂等也是其配体,可通过PXR诱导MDRl表达,并可被酮康唑抑制〔5〕,这些研究提示PXR与EC9706细胞的抗凋亡调控相关。
PXR的表达部位主要在肝脏、小肠、肾脏及血脑屏障等组织细胞,这与经其转录激活的下游靶酶或蛋白如 CYP3A4、CYP2B6、UGT1A1、MDR1等的表达部位基本一致。近年来在众多肿瘤组织中也发现了PXR的高表达,研究表明高表达PXR的肿瘤谱已经从早期的性激素相关肿瘤得到了很大范围的扩展。在结肠癌〔6〕中也发现了PXR的表达并证实了与多药耐药的相关性。最近,在食道鳞状上皮癌组织中,PXR蛋白及mRNA水平均明显高于正常食道上皮组织〔2〕。
PXR抑制肿瘤细胞凋亡也可能是其诱导耐药的机制之一。在人结肠癌细胞中,PXR活化导致了抗凋亡基因,如 BAG3,BIRC 2,MCL-1等表达上调,而包括BAK1和TP53在内的促凋亡基因表达受到抑制〔7〕。可是Verma等〔8〕却发现了相反的结果。他们在人乳腺癌细胞系MCF-7和ZR-75-1中发现,PXR的活化也可以通过一氧化氮(NO)依赖的途径上调 p53的表达,进而导致促凋亡因子p21、PUMA、BAK表达增加,促进了乳腺癌细胞的凋亡。PXR对细胞凋亡的作用可能和性激素的表达水平及PXR对NO的诱导作用的强弱有关,具有一定的组织特异性,从而为研究化疗药物的选择性和与激素类药物的联合用药方面提供了参考。
本实验发现PXR基因与凋亡蛋白Caspase-3在食管鳞癌中的表达明显相关,进一步证实其在食管鳞癌的发生与演进中有着重要的作用与地位,是食管鳞癌治疗中的一个靶基因,因此对PXR的研究及应用这些研究成果有望使其成为食管鳞癌诊断和基因、免疫治疗的新靶点,为食管鳞癌的诊断、治疗开辟一条新途径。本研究证明,药理学活化PXR足够抑制阿霉素诱导的EC9706细胞的凋亡,基因表达分析说明PXR的抗凋亡作用与多种凋亡相关基因的调控有关。PXR作为抗肿瘤细胞凋亡作为在肿瘤的治疗新靶点方面已引起重视,本研究为PXR在食管癌中的治疗作为新的靶点提供了理论依据。
1 Mizutani H,Tada Oikawa S,Hiraku Y,el al.Mechanism of apoptosis induced by doxorubicin through the generation of hydrogen peroxide〔J〕.Life Sci,2005;76(13):1439-53.
2 吴婵妮,周海波,陈金明.三羟基异黄酮诱导食管癌EC-109细胞凋亡的研究〔J〕. 浙江医学,2008;30(12):1313-8.
3 Zhou J,Liu MT,Zhai YG,et al.The antiapoptotic role of pregnane X Receptor in human colon cancer cells〔J〕.Mol Endocrinol,2008;22:868-80.
4 Daisuke Takeyama,Yasuhiro Miki,Fumiyoshi Fujishima,et al.Steroid and xenobiotic receptor in human esophageal squamous cell carcinoma:a potent prognostic factor〔J〕.Cancer Sci,2010;101(2):543-9.
5 Huang H,Wang H,Sinz M,et al.Inhibition of drug metabolism by blocking the activation of nuclear receptors by ketoconazole〔J〕.Oncogene,2007;26(2):258-68.
6 Jiang H,Chen K,He J,et al.Association of pregnane X receptor with multidrug resistance-related protein 3 and its role in human colon cancer chemoresistance〔J〕.J Gastrointest Surg,2009;131(10):1831-8.
7 江 恒,陈文生,陈克力,等.核受体PXR对人结肠癌细胞增殖和化疗敏感性的影响〔J〕.现代生物医学进展,2009;9(11):103-24.
8 Verma S,Tabb MM,Blumberg B.Activation of the steroid and xenobiotic receptor,SXR,induces apoptosis in breast cancer cells〔J〕.BMC Cancer,2009;9(1):3-22.
R329
〕 A 〔
1005-9202(2012)22-4962-04;
10.3969/j.issn.1005-9202.2012.22.051
樊青霞(1952-),女,主任医师,主要从事恶性肿瘤研究。
谢晶华(1987-),女,硕士,主要从事恶性肿瘤研究。
〔2011-12-17收稿 2012-04-05修回〕
(编辑 赵慧玲)
