吸烟与戒烟对哮喘模型大鼠的影响
2012-11-20姜洪芳王佳贺中国医科大学附属盛京医院老年病科辽宁沈阳110004
姜洪芳 白 雪 王佳贺 (中国医科大学附属盛京医院老年病科,辽宁 沈阳 110004)
吸烟与戒烟对哮喘模型大鼠的影响
姜洪芳 白 雪 王佳贺 (中国医科大学附属盛京医院老年病科,辽宁 沈阳 110004)
目的 通过观察哮喘模型大鼠在吸烟及戒烟后大体症状、肺功能、肺泡灌洗液(BALF)细胞分类及血清炎症介质的变化,探讨吸烟与戒烟对哮喘患者影响。方法 健康雄性Wistar大鼠40只,随机分为对照组、致敏组、吸烟致敏组、戒烟致敏组,每组10只。观察各组大鼠大体症状,测定各组大鼠肺功能,行支气管肺泡灌洗液细胞分类计数,取血清以ELISA方法测定IL-13、IgE蛋白质含量。结果 哮喘模型大鼠制备成功;被动吸烟后呼吸急促、喘鸣等症状加重,肺通气功能减低,肺泡灌洗液中中性粒细胞比例上升,血清IL-13、IgE水平上升;而戒烟后喘息症状略有减轻,肺功能短期内即有恢复,肺泡灌洗液中中性粒细胞比例下降,血清IgE水平下降。结论 吸烟可加重哮喘模型大鼠喘息症状,使得肺通气功能进一步减低,炎症反应加重;通过戒烟,可明显改善哮喘模型大鼠生存状态,建议及早戒烟。
吸烟;戒烟;哮喘
吸烟可加重呼吸系统疾病症状,目前人们已明确吸烟与戒烟对慢性阻塞性肺病(COPD)患者的影响〔1〕,但关于吸烟与戒烟对哮喘患者的影响,相关报导鲜有。因此,本研究制备哮喘模型大鼠,通过观察其被动吸烟及戒烟后大体症状、肺功能及机体炎症反应的变化,明确吸烟与戒烟对哮喘患者的影响,以期对哮喘患者的戒烟治疗提供实验依据。
1 材料与方法
1.1 实验动物分组
重150~220 g(中国医科大学动物中心提供)。随机分为4组,A:对照组、B:致敏组、C:吸烟致敏组、D:戒烟致敏组,每组10只。各组饲料、饮水相同,均予自由饮水和摄食。
1.2 各实验组模型制备
白腹腔注射,14 d后以生理盐水60 ml代替卵白蛋白雾化吸入。B、C、D组分别于第1天和第8天以10%的卵白蛋白1 ml,氢氧化铝干粉100 mg腹腔注射致敏,第14天后将大鼠置于透明密闭容器中给予1%的卵白蛋白溶液60 ml雾化吸入激发,每日1次,每次40 min,共10 w,制备哮喘模型;在激发第3周开始,将
A组以生理盐水2 ml代替卵白蛋
实验动物选用Wistar雄性大鼠40只,体C组及D组大鼠置于自制熏箱内进行被动吸烟。吸烟室大小60 cm ×50 cm ×40 cm,给予每天吸烟10支,每支香烟燃烧约10 min,换烟时停止5 min,每周6 d,C组共连续吸烟8 w,D组连续吸烟4 w后再戒烟4 w。
1.3 各组大鼠大体情况观察
包括毛发、活动量、激发时喘息症状等。
1.4 肺功能测定
采用AniRes2005动物肺功能分析系统测定各组大鼠肺功能。室温下,将大鼠置体描器内,呼吸时体描器的容积变化经处理可计算出潮气量及每分钟呼气量(VE)。然后将大鼠麻醉(5%水合氯醛0.7 ml/100 g)经自制面罩外加25 cm H2O的压力,迫使动物深吸气,再以25 cm H2O的负压吸引,造成深呼气,能较准确地测出最大呼气流速(PEF)、第0.3秒用力呼气容积(FEV0.3)。
1.5 支气管肺泡灌洗液(BALF)的制备
气管插管,0.9%氯化钠注射液进行支气管肺泡灌洗,每次5 ml,共3次。回收BALF,离心(3 000 r/min,4℃)10 min,PBS 重悬沉淀物,细胞图片,瑞氏染色,计数除上皮细胞和红细胞以外的其他细胞,巨噬细胞(MФ)、淋巴细胞(Ly)、中性粒细胞(PMN)、嗜酸性粒细胞(EOS)。
1.6 IL-13、IgE的蛋白质含量测定
取0.5 μl血清用ELISA试剂盒检测IL-13、IgE的蛋白质含量,操作步骤按试剂盒说明
书进行。
1.7 统计学处理
2 结果
2.1 大体症状观察
B组大鼠表现为毛发失去光泽、活动减少,激发时烦躁不安、搔痒、呼吸较促、腹肌抽搐和喘鸣等症状,肺大体充血、肿胀。A组大鼠无上述症状。C组大鼠临床表现较B组显著加重。D组大鼠较C组症状略有减轻。
2.2 肺功能检测
B 组较A组通气指标显著减低,C组较B组更有下降,戒烟后D组短期内即有恢复,见表1。
表1 各组大鼠肺功能测定及比较结果(± s,n=10)
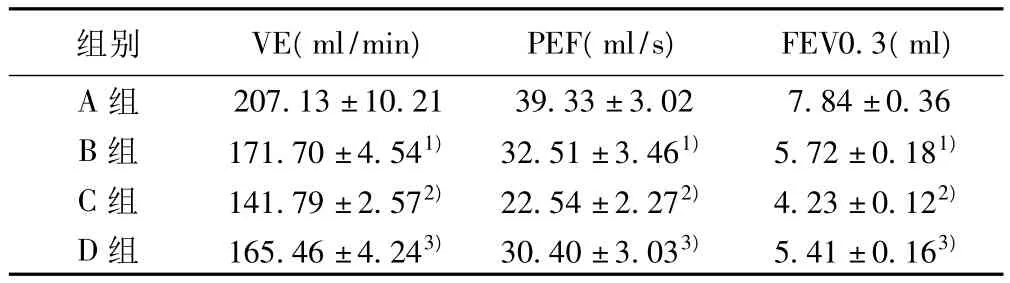
表1 各组大鼠肺功能测定及比较结果(± s,n=10)
组别 VE(ml/min) PEF(ml/s) FEV0.3(ml)A组207.13±10.21 39.33±3.02 7.84±0.36 B组 171.70±4.541) 32.51±3.461) 5.72±0.181)C组 141.79±2.572) 22.54±2.272) 4.23±0.122)D组 165.46±4.243) 30.40±3.033) 5.41±0.163)
与A组比较:1)P<0.05;与B组比较:2)P<0.05;与C组比较:3)P<0.05;下表同
2.3 BALF细胞分类计数
B 组BALF中细胞总数以及EOS、PMN、Ly占细胞总数的百分比均显著高于A组(P<0.05),MΦ占细胞总数的百分比显著低于A组(P<0.05);与B组比较,C组BALF中细胞总数及MΦ占细胞总数的百分比显著升高,而EOS、Ly占细胞总数的百分比显著降低;与C组比较,D组细胞总数及MΦ占细胞总数的百分比略有下降,而EOS占细胞总数的百分比略有上升。见表2。
表2 各组大鼠BALF细胞分类计数及比较(± s,n=10)

表2 各组大鼠BALF细胞分类计数及比较(± s,n=10)
组别 细胞总数(×109/L)Ly百分比(%)EOS PMN MΦ A组 2.82±0.32 1.02±0.88 5.23±1.04 84.54±4.32 9.21±3.36 B组6.33±0.531)6.04±1.571) 13.52±2.461)65.23±5.881)15.21±3.011)C组7.26±0.542)2.10±0.792) 14.73±2.87 72.85±6.532)10.32±1.022)D组6.84±0.633)3.42±1.203) 15.35±1.96 70.14±6.423)11.09±3.33
2.4 血清IL-13及IgE蛋白质含量的检测
与A组比较,B组血清IL-13及IgE水平明显升高;与B组比较,C组上述指标更有上升;戒烟后D组IgE水平较C组略有下降。见表3。
表3 各组大鼠血清IL-13及IgE含量测定及比较± s,n=10)

表3 各组大鼠血清IL-13及IgE含量测定及比较± s,n=10)
组别 IL-13(pg/ml) IgE(IU/ml)A组33.21±2.16 35.62±3.43 B组 42.28±5.241) 306.42±12.871)C组 50.66±6.352) 344.53±18.662)D组 49.25±5.29 332.46±13.823)
3 讨论
支气管哮喘(简称哮喘)患者的吸烟情况非常普遍,这其中包括成人哮喘患者主动吸烟和在环境烟草烟雾中暴露的被动吸烟。美国和部分西方国家哮喘患者的吸烟率为20%~35%〔2,3〕,急诊就诊的哮喘患者中有 35% 是吸烟者〔4〕。吸烟的哮喘患者急性发作次数比非吸烟哮喘患者多,且与吸烟的严重程度呈正相关〔5〕。尽管戒烟很重要,但吸烟与戒烟对哮喘患者影响的相关报道却鲜有。
国外有研究认为〔6〕,2/3的哮喘患者戒烟后症状无改善或是加重。但在我们的研究中可见,吸烟加重哮喘模型大鼠气促、喘息症状,而戒烟后症状可有所减轻。同样也有其他的研究证实〔7〕,与不戒烟者相比,哮喘患者戒烟后可以有较少的咳嗽、咳痰量及喘息。这将预示着,大多数哮喘患者的喘息症状可以恢复到未吸烟前。
吸烟与哮喘同时存在加速了肺功能的恶化。哥本哈根心脏研究中心的一个长达15年的研究发现在吸烟哮喘患者中FEV1下降更明显〔8〕。年龄在40~59岁的非吸烟哮喘男性年平均 FEV1降低33 ml,而吸烟者年平均 FEV1降低则高达58 ml。本文研究结果显示,戒烟可使哮喘大鼠肺功能短期内即有所改善,这与国外一些研究结论相符〔9〕。
吸烟哮喘大鼠BALF比例下降,而PMN比例升高。有研究提出〔10〕,吸烟与非吸烟的哮喘患者气道炎症有所不同,前者以PMN浸润为主,后者以EOS浸润为主,由此推测可能吸烟引发了一种独特的PMN浸润型哮喘,也可能因吸烟使原先EOS浸润型哮喘转变成了PMN浸润型。烟草中尼古丁可能抑制巨噬细胞释放前体炎症因子,而引起EOS功能的二重调节。哮喘模型大鼠戒烟后,同时可见PMN比例降低,而EOS比例上升。
哮喘是一种涉及多种细胞因子及炎症介质相互作用的慢性气道炎症性疾病。在众多参与哮喘的细胞因子中,IL-13是在人体内发现的可以直接促进IgE合成的细胞因子〔11〕。同时哮喘动物模型表明,IL-13在诱发气道高反应中起重要作用〔12〕。吸烟可使哮喘模型大鼠血清IL-13及IgE水平明显升高,而戒烟后IgE水平略有下降,IL-13水平无明显变化。
综上所述,本文研究结论提示,吸烟可加重哮喘模型大鼠喘息症状,使得肺通气功能进一步减低,炎症反应加重;通过戒烟,可明显改善哮喘模型大鼠生存状态。因此,临床医师必须鼓励吸烟哮喘患者努力戒烟,对于无法戒烟的患者,可进一步寻找其他有效的治疗方法。
1 吴 卓,姜洪芳,田大力,等.戒烟对慢性阻塞性肺病模型大鼠肺组织病理及肺功能的影响〔J〕.中国老年学杂志,2011;31(4):646-8.
2 Strine TW,Balluz LS,Ford ES.The associations between smoking,physical inactivity,obesity,and asthma severity in the general US population〔J〕.J Asthma,2007;44(8):651-8.
3 Yun S,Chanetsa F,Kelsey A,et al.Active and passive smoking among asthmatic Missourians:implications for health education〔J〕.Prev Med,2006;42(4):286-90.
4 Silverman RA,Boudreaux ED,Woodruff PG,et al.Cigarette smoking among asthmatic adults presenting to 64 emergency departments〔J〕.Chest,2003;123(5):1472-9.
5 Gallefoss F,Bakke PS.Does smoking affect the outcome of patient educa-tion and self management in asthmatics〔J〕?Patient Edu Couns,2003;49(1):91-7.
6 Hillerdahl G,Rylander R.Asthma and smoking cessation〔J〕.Clin Allergy,1984;14(1):45-7.
7 Suzuki K,Tanaka H,Kaneko S,et al.Respiratory symptoms and cigarette smoking in 3,197 pulmonologist-based asthmatic patients with a highly prevalent use of inhaled corticosteroid〔J〕.J Asthma,2003;40(3):243-50.
8 Lange P,Parner J,Vestbo J,et al.A 15-year follow-up study of ventilatory function in adults with asthma〔J〕.N Engl J Med,1998;339(17):1194-200.
9 Fennerty A,Banks J,Ebden P,et al.The effect of cigarette withdrawal on asthmatics who smoke〔J〕.Eur J Respir Dis,1987;71(5):395-9.
10 Chalmers GW,Macleod KJ,Thomson L,et al.Smoking and airway inflammation in patients with mild asthma〔J〕.Chest,2001;120(6):1917-22.
11 Kasaian MT,Mkller DK.IL-13 as a therapeutic target for respiratory disease〔J〕.Biochem Pharmacol,2008;76(2):147-55.
12 Lukacs NW,Tekkanat KK,Berlin A,et al.Respiratory syncytial virus predisposes mice to augmented allergic airway responses via IL-13-mediated mechanisms〔J〕.J Immunol,2001;167(2):1060-5.
R562.25
A 〔
1005-9202(2012)22-4956-03;
10.3969/j.issn.1005-9202.2012.22.048
姜洪芳(1979-),女,硕士,讲师,主要从事老年疾病的诊断及治疗。
〔2011-08-05收稿 2011-10-10修回〕
(编辑 曹梦园)
