有氧运动对糖尿病大鼠肝脏微量元素及肝细胞组织形态结构的影响
2012-11-20张胜林王东良
张胜林,王东良,龚 云,李 敏
(1.兰州理工大学体育部,甘肃 兰州 730050;2.甘肃省体育科学研究所,甘肃 兰州 730050;3.西北师范大学体育学院,甘肃 兰州 730070;4.甘肃省西和县苏合中学,甘肃 陇南 742100)
糖尿病(Diabetes mellitus DM)是一种由于胰岛素分泌相对或绝对不足所导致的代谢紊乱综合症状群,微量元素(Trace elements)的代谢受损也囊括其中,微量元素对胰岛素的合成、分泌、贮存、活性有很大的影响,同样胰岛素不足也影响微量元素的体内平衡状况;肝脏是各种营养物质代谢的中心脏器,而肝脏与胰腺在解剖学、内分泌学、胚胎学上关系非常密切,成为唇齿相依如影相随的脏器,因而患有糖尿病者,难免涉及肝脏。糖尿病患者肝脏病理形态学改变有3种主要的表现:肝肿大、肝脏脂肪浸润和肝硬化,此三种形态学改变有可能成为失控的糖尿病病程进展的时间性演变,此种演变过程纯系糖尿病引起肝脏组织学及功能的改变。运动是治疗糖尿病的“三驾马车”之一,是治疗糖尿病的一剂良药,但同时也是一柄双刃剑,这主要决定于运动时间、运动量和运动强度。所以,本课题选择有氧运动(Aerobic exercise)作为治疗糖尿病的干预手段,观察8周末糖尿病大鼠的血糖(Glu)和血清胰岛素(Ins)水平,判断有氧运动抗糖尿病效果,进而观察有氧运动对糖尿病大鼠肝脏微量元素代谢紊乱的影响和肝脏组织细胞形态结构的变化,为糖尿病性肝病的治疗提供实验理论依据。
1 材料与方法
1.1 主要药品
链尿佐菌素,柠檬酸,柠檬酸钠(sigma公司产品),血糖试剂条(北京麦邦科技有限公司产品)。
1.2 实验对象
选用体重160-180g 8周龄健康雄性Wistar大鼠50只(兰州大学医学院实验动物中心提供),国家标准啮齿类动物饲料喂养。动物室温度18-28℃,相对湿度40%-70%,自然通风光照,饲养室、用具每周紫外线消毒一次。
1.3 动物建模及分组
实验大鼠适应性喂养一周后禁食12-16小时(不禁水),进行糖尿病建模。随机抽取10只作为对照组,剩余40只作为糖尿病模型组。模型组按60mg/kg[1-2]体重腹腔快速注射 STZ(注射 STZ前,用冷的PH为4.0-4.5的0.1mol/l的枸橼酸缓冲液溶解后配成2%的溶液),对照组动物腹腔注射等体积0.1%枸橼酸盐缓冲液。注射STZ 48h后,连续3天同一时间测空腹血糖(尾静脉取血)。若血糖稳定升高,一周后,大鼠出现多饮、多尿、多食、体重明显减轻,复测血糖≥16.67mmol/l就判定为建模成功[3]。在糖尿病建模成功后随机将模型组动物分为:糖尿病组20只(DM),糖尿病有氧运动组20只(DMS)。
1.4 运动方案
采用Bedford跑台训练方法。正常对照组,正常笼内生活不运动;其余进行一周跑台适应性训练,强度由15m/min(持续15min),逐渐增加到20m/min(持续30min)。此后糖尿病安静组和正常对照组不参与运动,正常笼内生活;糖尿病运动组进行持续6周的正规训练,时间30min,强度25m/min。每天训练一次,每周六天,均在下午16:00-18:00时训练,坡度为零,训练期间,每周测一次体重,并观察饮食变化和精神状态。训练开始后,大鼠自由饮水、自由进食,大鼠跑台训练安排[1]见表1。

表1 大鼠跑台训练安排一览
1.5 实验标本的制备
1.5.1 实验动物处死及血液标本的制备
为了减小运动对测试指标的影响,在最后一次运动结束后禁食12小时左右称大鼠体重,依次用2%戊巴比妥钠50mg/kg腹腔注射麻醉,腹腔采血,抽取6ml注入试管中,全部血样2h内,在4℃以下3 000r/min离心10min弃上层血浆,留血清于-20℃保存,待测血糖、血清胰岛素。
1.5.2 肝脏标本的制备
大鼠处死后,迅速取其肝脏,滤纸拭干血渍称重,切取1cm2见方的肝组织放于10%中性福尔马林固定液中,固定数小时等其稍硬再行修切成1×1×0.3cm的小块继续固定。
再切取1-2g肝组织用去离子水洗漂洗数次,于烘箱中烘干,置干燥器中备用。
1.6 测试指标及方法
从动物建模当日到实验结束处死前于每日上午更换饲料时,用电子称测定并记录每只大鼠体重。实验前建模时的血糖(Glu)用血糖仪由断尾采血测定。实验结束后血糖采用全自动生化分析仪测定。血清胰岛素(Ins)放射免疫法。肝脏微量元素Fe、Zn、Cu、Mn由兰州大学草原生态研究所采用原子吸收法测定。肝脏组织细胞形态结构的变化使用HE染色。
1.7 数据的统计学处理
2 实验结果
2.1 实验前后大鼠体重和血糖的变化
本实验在表2中明确显示,各组实验大鼠的体重在实验前和实验末发生了明显的变化。与实验前相比,正常对照组(N)体重变化非常显著(P<0.01),而糖尿病模型组体重变化较为显著(P<0.05);实验末与DM组相比,N组体重增加非常显著(P<0.01),DM组体重增加比较显著(P<0.05)。

表2 各组大鼠实验前后体重的变化
由表3可知,正常对照组大鼠实验前后血糖在正常范围内波动.糖尿病模型组实验前和实验末血糖表现出非常显著的变化(P<0.05,P<0.01)。在实验末与DM组相比DMS血糖有所降低(P<0.05)。

表3 各组大鼠实验前后血糖的变化
2.2 有氧运动对糖尿病大鼠血清胰岛素的影响
在实验末,各组实验大鼠血清胰岛素含量各异。表4显示,与N组相比DM组和DMS组血清胰岛素含量非常显著性降低(P<0.01),与DM组相比N组非常显著性升高(P<0.01),DMS组升高较显著(P<0.05)。

表4 有氧运动对糖尿病大鼠血清胰岛素的影响
2.3 有氧运动对糖尿病大鼠肝脏组织微量元素Fe、Zn、Cu、Mn 的影响
有研究表明在糖尿病时存在着微量元素受损现象,由表5可知,与N组相比Fe、Zn在糖尿病时呈降低趋势(P<0.05,P<0.01),而Cu的含量与N组相比DM组增高非常显著,但在DMS组在有显著降低(P<0.05),Mn在各组间并未出现显著性变化。
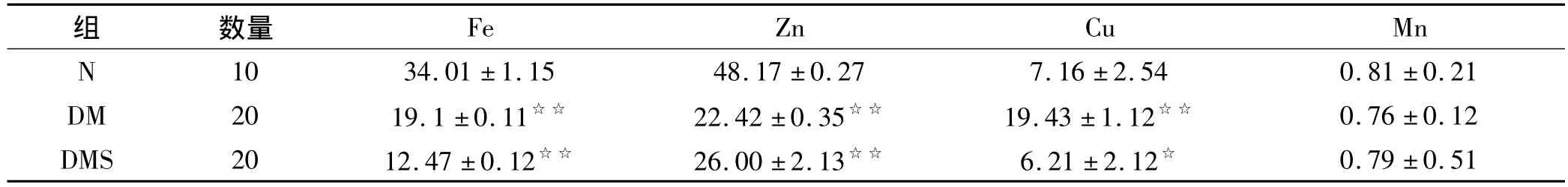
表5 各组实验大鼠肾脏微量元素变化的比较
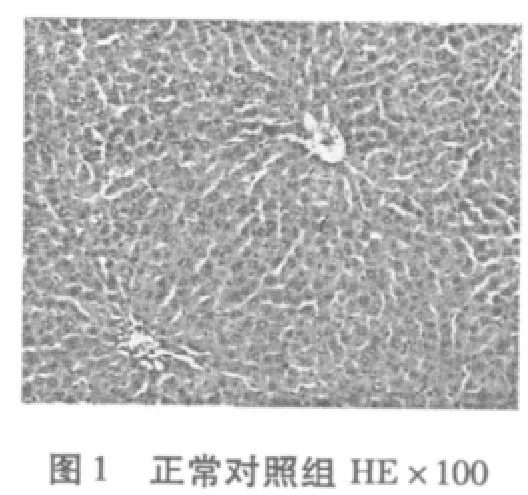
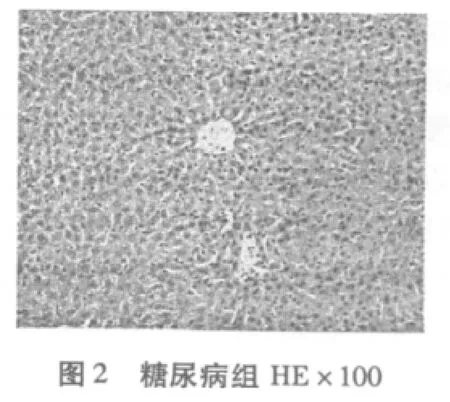
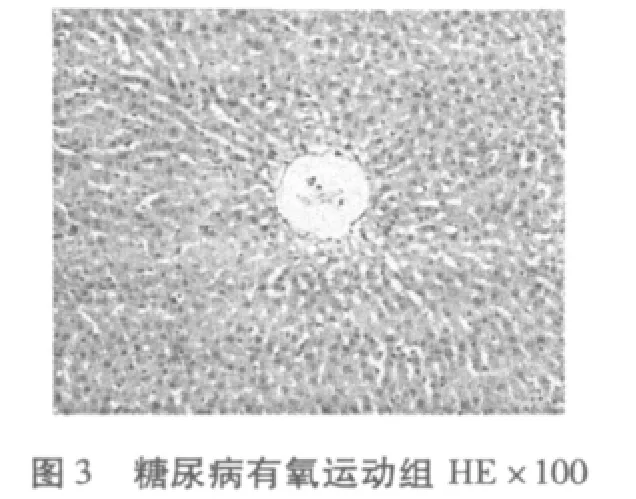
2.4 有氧运动对糖尿病大鼠肝脏细胞组织形态结构变化的影响
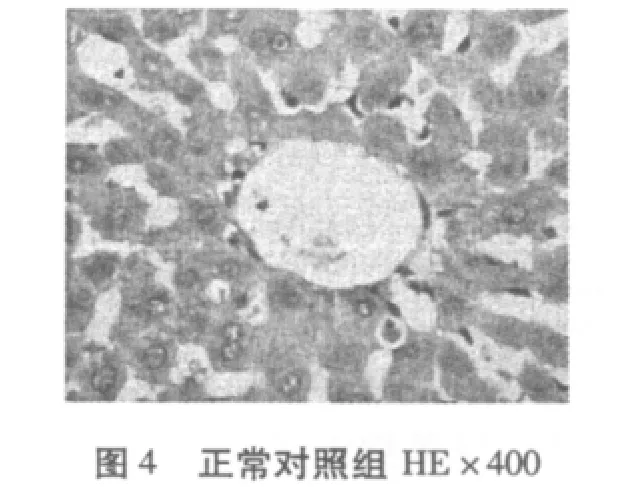
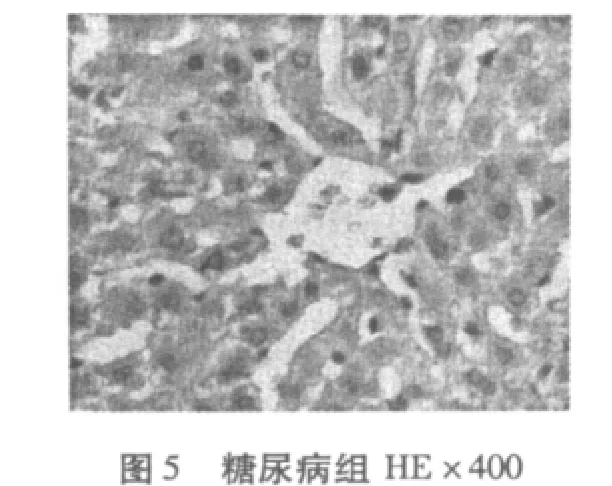
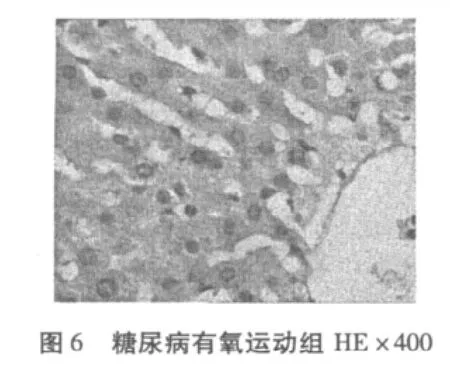
从图1-图6可知,正常对照组(N)肝脏细胞结构完整清晰,肝小叶结构正常,肝细胞无脂肪变性等异常改变。糖尿病模型组(DM)有极少量的脂肪变性,表现为肝小叶界限不清,肝细胞索排列轻度紊乱,大部分肝窦消失,且有坏死细胞,肝细胞——呈圆形,胞浆内可见大小不等、数量不一的脂滴溶液(脂肪变性),且有散在的嗜酸变性。糖尿病有氧运动组有散见肝细胞颗粒变性和嗜酸变性以及少量脂肪变性,未见坏死,肝小叶结构较糖尿病组有所恢复,细胞结构较为完整,细胞索排列较规则。
3 讨论
正常情况下,机体受各种因素的调节血糖处于动态平衡状态,从而维持血糖浓度的相对稳定。糖尿病时由于胰岛素的分泌缺乏或胰岛素作用不足而引起的持续高血糖的疾病,其威胁在于持续性高血糖的发生波及全身的慢性并发症,如糖尿病性脂肪肝。
运动可以促进骨骼肌对葡萄糖的直接摄取,使血糖降低,提高胰岛素靶细胞的敏感度。运动还会持续消耗肌糖原与肝糖原,使高血糖状态缓解,运动后血糖又转变成糖原储存起来,使血糖持续下降,从而改善胰岛素的利用率。Boule等[4]通过14项临床试验分析发现,在体重不减轻的情况下,50%—60%最大摄氧量的踏车练习使T2DM患者的GhbA1水平下降0.66%。Kelley等[5]发现葡萄糖输注速率在运动后显著高于运动前休息状态,提示运动能增加Ins诱导的葡萄糖利用率。
在本实验中正常对照组大鼠实验前后血糖变化甚微(P<0.05);在糖尿病模型组实验前和实验末血糖表现出明显的变化(P<0.05,P<0.01),这说明血糖是反映糖尿病最简单的指标,可使糖尿病与非糖尿病区别开来。在本实验中经有氧运动干预后糖尿病模型组内部血糖也表现出明显的变化,与糖尿病组(DM)相比糖尿病有氧运动组降低最为显著(P<0.01),血清胰岛素却呈现出相反的趋势,糖尿病组最低(P<0.01)。经有氧运动干预后出现了一定的显著性变化,胰岛素呈升高趋势,据此可以看出有氧运动可改善糖尿病大鼠胰岛素状况,有利于糖尿病的治疗。
大量的实验研究和临床已证明糖尿病时机体内存在微量元素代谢受损现象[6],近年来在治疗糖尿病的过程中也发现一些微量元素具有胰岛素般降糖效应,而胰岛素要发挥降糖作用也必须依赖某些微量元素[4];所以胰岛素分泌的绝对或相对不足影响微量元素在人体内的平衡,而微量元素对胰岛素的合成、分泌、贮存及能量代谢也起着重要作用。铁(Fe)是动物组织中含量丰富的微量元素之一,其主要存在于骨骼肌的铁蛋白、含铁血黄素和肌球蛋白中,铁在正常情况下,排出体外的量非常少,主要是通过改变小肠黏膜对铁的吸收量来进行调节的,以保持其含量恒定。本实验结果显示,糖尿病组铁含量明显低于正常对照组,与临床检测糖尿病患者全血中铁含量降低的报道一致;但在糖尿病有氧运动组Fe的含量依旧在降低,这是因为有氧运动所导致的缺铁还是其它机制所使,目前还不清楚。锌(Zn)是许多重要代谢通路中酶的基本成分,存在于核酸和骨组织中,缺锌可引起胰岛素颗粒减少,分泌障碍和增加组织对胰岛素作用的抵抗[7]。锌还可以影响葡萄糖在体内的平衡过程,并通过激活羧肽酶B促进胰岛素原转变为胰岛素,Zn的缺乏与胰岛素分泌的减少以及组织对胰岛素作用的抵抗有关[8]。我们发现M组肝脏组织中Zn含量明显低于对照组(N),这可能与DM时胰岛素分泌绝对缺乏有关,其具体机制有待进一步研究。
Cu和Mn是过渡金属元素,其化学性质也较为相似,Cu是参与人体多种酶合成、活化代谢的必需微量元素。它与其他元素一起有助于神经周围的阻断性髓鞘的合成。有实验报道[9]DM患者血清Cu明显高于健康对照组水平,这一结果和本实验研究相一致,糖尿病组Cu含量明显高于正常对照组,但在糖尿病有氧运动组含量非常接近正常对照组,这与有氧运动、操作的规范还是与糖尿病的自愈有关,还需进一步探讨。诸多报道显示锰(Mn)与糖代谢异常有关,这与本实验结果一致。
糖尿病是脂肪肝主要的病因之一,脂肪肝发生于脂肪过程浸润,浸润的脂肪又不能被消耗运往他处,于是形成脂肪微滴,散布于肝中,脂肪浸润的过程先从肝小叶周边开始,以后逐渐扩散到整个肝小叶,凡经过治疗的糖尿病病人的肝周围细胞胞质内,含较丰富的糖原,但在中央细胞中糖原减少或缺失,最常见细胞核内糖原沉积着的空泡,此种核的空泡更多见于胞质糖原最少的细胞。显微镜下可见库普弗细胞肿大,并充满大小不等的脂肪滴,将细胞核推向一边,这些现象主要由于胰岛素分泌不足导致脂肪异常增加,其中以中性脂肪更为突出[10]。在本实验中正常对照组(N)肝脏细胞结构完整清晰,肝小叶结构正常;肝细胞无脂肪变性等异常改变。糖尿病模型组(DM)有少量的脂肪变性,表现为肝小叶界限不清,肝细胞索排列轻度紊乱,大部分肝窦消失,且有坏死细胞,胞浆内可见大小不等数量不一的脂滴溶液(脂肪变性),且有散在的嗜酸变性,糖尿病运动组散见肝细胞颗粒变性和嗜酸变性以及少量脂肪变性,未见坏死。由此可知,在患糖尿病8周时,大鼠肝脏已有脂肪浸润现象,进而使肝脏细胞结构破坏、肝窦消失、细胞坏死等脂肪肝症状产生,经有氧运动干预后这一现象有所缓解。
4 结论
糖尿病时大鼠血糖持续升高,血清胰岛素含量降低,微量元素代谢受损,肝脏组织细胞结构破坏,出现脂肪肝现象。有氧运动可缓解高血糖状态提高胰岛素含量,部分低纠正微量元素代谢紊乱现象,使肝脏组织细胞结构有所改善明显遏制了脂肪肝的发展,从而达到了控制糖尿病的作用。
[1]赵守香,董鹏.糖尿病与运动[J].中国慢性病预防与控制,2004,12(1):46-48.
[2]李聪然,游雪甫,蒋建东.糖尿病动物模型及研究进展[J].中国比较医学,2005,15(1):59-63.
[3]黄国钧,黄勤挽.医用实验动物模型-制作与应用[M].北京:化学工业出版社,2008:121-124.
[4]Boule NG,Haddad E,Kenny GP,et al.Effects of exercise on glycemic control And body mass in type 2 diabetes mellitus:a meta-analysis of controlled cinical trials[J].JAMA,2001,286(10):1218-1227.
[5]Chu YJ ,Liu QY ,Hou C ,et al.Blood selenium concentration in resit dents of areas in China haying a high incidence of lung cancer[J].BiolTrace Element Res ,1984(6):133.
[6]龚云,李敏,亢建国.有氧运动以及补充灵芝多糖抗糖尿病大鼠睾丸脂质过氧化机制的探讨[J].甘肃联合大学学报,2010(4):79-82.
[7]孙燕,朱本章.微量元素与糖尿病氧化应激[J].国外医学:医学地理分册,2004,25(4):159-161.
[8]薛殿凯.糖尿病患者缺少哪些微量元素[J].食品与生活,2002(10):26-27.
[9]沈兴平,舒昌达,何军.糖尿病大鼠肋间肌微量元素与氧化应激变化的研究[J].中国病理生理志,2008,24(3):599–601.
[10]蔡永敏,杨辰华,王振涛.糖尿病临床诊疗学[M].上海:第二军医大学出版社,2006:274-278.
