槲皮素包合物微球的制备及其体外释放研究Δ
2012-11-17胡英孙宝莹高珊
胡英,孙宝莹,高珊
(1.浙江医药高等专科学校,浙江宁波3 1 5 1 0 0;2.济南市中心医院神内科,济南2 5 0 0 1 3)
槲皮素包合物微球的制备及其体外释放研究Δ
胡英1*,孙宝莹2,高珊1
(1.浙江医药高等专科学校,浙江宁波3 1 5 1 0 0;2.济南市中心医院神内科,济南2 5 0 0 1 3)
目的:制备槲皮素β-环糊精包合物-壳聚糖微球(QT-CD-CM),并考察其理化性质和药物体外释放性能。方法:采用有机溶剂挥发法制备槲皮素β-环糊精包合物,再用乳化分散-离子交联法、以三聚磷酸钠为交联剂制备壳聚糖微球,并考察其形态、粒径、包封率、载药量和体外释放情况。结果:制备的QT-CD-CM形态规则、均质、无粘连,平均粒径(3.3 2 7±0.1 2 4)μm,包封率为3 2.4%,载药量为1 2.3%,在5%乙醇-磷酸盐缓冲液介质中7 2h可以达到完全释药,释药过程符合一级动力学模型。结论:QT-CD-CM理化性质及体外释药性能良好,制备工艺简单,有望成为理想的槲皮素给药系统。
槲皮素;包合物;壳聚糖;微球;制备;体外释放
槲皮素(Quercetin,QT)及其衍生物是自然界分布最广的黄酮类化合物,具有抗炎、抗氧化、抗过敏、抗菌、抗病毒、抗癌等多方面的药理作用[1]。由于QT不溶于水,且油水分配系数小,难以通过胃肠道黏膜吸收,故生物利用度低,至今尚无一种较有效的制剂应用于临床。将难溶性的药物包合后可增加其溶解度[2],从而提高溶出度和生物利用度,降低刺激性和不良反应[3],其中β-环糊精(β-CYD)是良好的天然包合材料。以微球作为微粒给药系统的研究已相对深入,但主要涉及水溶性药物控释或缓释方面,由于难溶性药物存在释药不完全的问题,对其研究相对较少。
本试验将难溶性药物QT先形成包合物,再在此基础上制成微球,并研究该包合物微球的理化性能及体外释药行为。其中,选择壳聚糖(CS)作为微球材料,因其是一种天然、可生物降解的高分子阳离子聚合物材料,具有良好的生物相容性和生物可降解性[4],已被广泛应用作微球材料。
1 仪器与试药
1.1 仪器
U3 0 0 0型高效液相色谱(HPLC)仪(美国戴安公司);CRY-2 P差热分析仪(上海天平仪器厂);XL3 0扫描电镜(荷兰Philips公司);XSZ-3显微镜(北京市科仪电光仪器厂);Zetasizer Nano激光衍射粒度分析仪(英国马尔文仪器有限公司);AL2 0 4型电子天平(梅特勒-托利多(上海)仪器有限公司)。
1.2 试药
QT原料药(山西慧科植物开发有限公司,批号:1 0 1 1 1 8,纯度:>9 8%);QT对照品(美国Sigma公司,批号:1 1 3 k1 0 5 1,纯度:>9 9%);CS(玉环海洋生化有限公司,分子量:8 0 0 0 0,去乙酰度:8 5%);β-CYD(上海源聚生物科技有限公司,批号:1 0 0 6 2 1);甲醇为色谱纯,水为纯化水,其余试剂均为分析纯。
透析袋(上海蓝季科技发展有限公司,分子量:1万~1.4万)。
2 方法与结果
2.1 QT包合物(QT-CD)的制备
采用有机溶剂挥发法[5]。称取约0.5 6 8 5 g的β-CYD溶于1 0 mL水中达到饱和,再加入用适量乙醇溶解的约0.1 8 g QT,有机溶剂挥发后,在6 0℃下,磁力搅拌4 h,即得。
2.2 空白微球(CM)的制备
采用乳化分散-离子交联法制备微球[6]。取CS(2%)-醋酸(2%)溶液9 mL,以水-油比1∶3(V/V)量取混合溶液,加至体积分数为1%吐温8 0和4%司盘8 0的液体石蜡2 7 mL中,室温下搅拌0.5 h,得到W/O型乳液。按照NH2-多聚磷酸钠(TPP)=1.5∶1(摩尔比)的比例,滴入质量分数为8%的TPP溶液6 mL,继续搅拌1.5h。依次用适量的石油醚、N,N-二甲基甲酰胺(DMF)、丙酮洗涤,抽滤,真空干燥,备用。
2.3 载药QT微球(QT-CM)的制备
按照QT-CS=1∶1(质量比)的药载比先将约0.1 8 g QT用乙醇溶解后,再加入到CS(2%)-醋酸(2%)溶液9 mL中,搅拌1 5 min,静置得到QT-CS混合溶液,再采用“2.2”项下方法制备微球。
2.4 载药QT包合物微球(QT-CD-CM)的制备
按照QT-CS=1∶1(质量比)的药载比将QT-CD加入到CS(2%)-醋酸(2%)溶液9 mL中,搅拌1 5 min,静置得到QT-CDCS混合溶液,再采用“2.2”项下方法制备微球。
2.5 微球载药量和包封率的测定[6]
称取微球适量,在研钵中研碎,用适量无水乙醇浸泡,超声1 h,3 7℃恒温振荡2 4 h,取上清液用适量5 0%乙醇稀释使QT完全溶出,离心后经0.4 5μm滤膜过滤得澄清的溶液,用HPLC法在3 7 3 nm波长测定其峰面积(A),代入“2.7.3”项下回归方程计算出浓度(c),求得QT的含量及包封率:载药量=(微球内药物质量/微球的总质量)×1 0 0%;包封率(%)=(系统中药物总量-游离药物量)/系统中药物总量×1 0 0%。结果QT-CM、QT-CD-CM包封率分别为6.5%、3 2.4%,载药量分别为9.3%、1 2.3%,后者明显更高。可见QT形成包合物后增加了药物的溶解度,易被包裹于CM中。
2.6 微球的形态及粒径观察
2.6.1 CM及QT-CD-CM的形态。用显微镜初步观察2种微球的外观形态,通过电镜进一步观察其表面形态和结构。2种微球的形态图见图1。

图1 2种微球的形态图Fig 1 Morphology of 2kinds of microspheres
由图1可见,显微镜下微球形态完整,表面光滑,呈类球形,粒子形状较规则,大小较为均匀,无粘连。电镜下微球表面呈一定的皱折状,CM表面多孔且凹陷;QT-CD-CM表面孔略小,但凹陷更明显。
2.6.2 3种微球的粒径及分布。用激光衍射粒度分析仪测得CM、QT-CM、QT-CD-CM 3种微球的粒径及分布情况,三者的粒径分别为(3.2 1 4±0.0 5 6)、(3.2 9 6±0.1 1 8)、(3.3 2 7±0.1 2 4)μm,多分散指数(PDI)分别为0.1 3 2、0.1 4 1、0.1 9 2。
2.7 体外释药
2.7.1 QT的含量测定[2]。色谱条件:色谱柱为Hypersil BDSC18(2 5 0mm×4.6mm,5μm),流动相为甲醇-磷酸盐缓冲液(PBS)(6 0∶4 0,PBS由4mL H3PO4+2mL三乙胺+1L的水组成),流速为1 mL·min-1,检测波长为3 7 3 nm,进样量为1 0 μL,柱温为3 0℃。理论板数按QT峰计不低于3 0 0 0。
2.7.2 溶液的制备。取QT对照品约1 7.5 mg,精密称定,置于1 0 0 mL量瓶中,用流动相溶解并定容,摇匀,得1 7 5 μg·mL-1的对照品溶液。精密称取QT-CD-CM和QT-CM适量,置于1 0 0 mL量瓶中,用流动相溶解并定容,摇匀,过滤,取续滤液适量,用流动相分别制备成1 7 5 μg·mL-1的溶液作为供试品溶液。
2.7.3 标准曲线的建立[2]。精密吸取对照品溶液1、2、4、8、1 0 mL,分别置于2 5 mL量瓶中,加甲醇定容至刻度,使成7、1 4、2 8、5 6、7 0 μg·mL-1的溶液。用0.4 5 μm滤膜过滤得澄清溶液,取样分析,记录色谱图。以浓度(c)为横坐标,相应峰面积(A)为纵坐标,进行线性回归,得方程:A=1.4 2 7 c+0.0 2 0(r=0.9 9 9 9 8),表明QT检测浓度线性范围为7~7 0 μg·mL-1。
2.7.4 精密度、重复性、稳定性和回收率试验。根据相关方法学要求进行考察。(1)精密度试验:对照品溶液连续测定6次的RSD=0.1 3%。(2)重复性试验:分别取3批QT-CM、QT-CDCM样品,制备成供试品溶液各3份,结果QT-CM供试品中QT含量的RSD分别为1.1 2%、1.4 3%、2.1 1%,QT-CD-CM供试品中QT含量的RSD分别为2.1 2%、0.9 8%、1.6 7%。(3)稳定性试验:2种供试品室温下放置,于1 2 h内每隔2 h测定1次,结果QT-CM供试品中QT含量的RSD=1.3 6%,QT-CD-CM供试品中QT含量的RSD=2.1 0%。表明在测定条件下,QT在2种微球中1 2h内均稳定。(4)回收率试验:精密称取对应处方量8 0%、1 0 0%、1 2 0%的QT对照品,分别加至QT-CM和QT-CDCM对应处方量的辅料中,制得高、中、低浓度的回收率试验溶液,分别测定3次。结果平均回收率分别为9 7.9%和9 9.1%,RSD分别为1.2 5%和2.1 7%。
2.7.5 载药QT体外释药试验。根据预试验,分别精密称取QT含量相同的QT-CM、QT-CD-CM适量,分别置于透析袋中,两端紧扎。将其置于2 5mL释放介质(5%乙醇-PBS(pH=5.3))中 ,每种样品试验3次,平行对照,将其置于(3 7±0.5)℃水浴振荡器中,振荡频率为1 0 0次/min,于0.5、1、3、6、1 2、2 4、4 8、7 2、9 6、1 4 4、1 8 0 h时间点各取样1 mL,同时补充同温度的新鲜介质1 mL。样品经0.4 5 μm滤膜过滤后,HPLC法测定,计算其累积释放率,结果见图2。

图2 2种载药微球的体外累积释放曲线Fig 2 Drug release curves of 2kinds of drug-loaded microspheres in vitro
由图2可见,QT-CD-CM释放速度较快,在7 2 h左右就可以释放完全。将累积释放率与时间进行线性回归后[5],得到QT-CD-CM的释放速率为1.7 9 92h-1,而QT-CM的释放速率为0.7 7 5 9 h-1,前者释放速率明显更快。
2.7.6 体外释药模型的拟合。采用常用药物释放模型即一级动力学方程、Higuchi方程、Weilbull方程对QT-CM、QT-CDCM释药数据进行拟合,结果见表1。
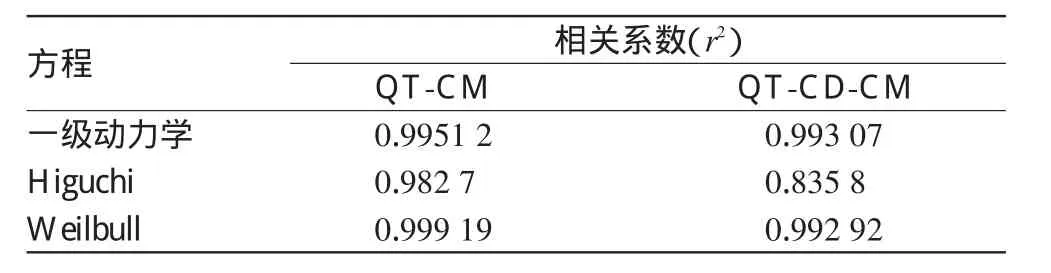
表1QT-CM、QT-CD-CM体外释药模型拟合结果Tab 1 Fitted drug release model of QT-CM and QT-CD-CM in vitro
由表1结果表明,QT-CM的体外释药更符合Weilbull动力学方程,QT-CD-CM体外释药更符合一级动力学方程。
3 讨论
CS是一种氨基葡糖与N-乙酰葡糖胺的共聚物,是迄今发现的唯一的天然碱性多糖,具有良好的组织相容性和体内降解性,故作为药物载体有着极大的前景。但对于难溶性药物,CS作为微球材料所得微球的载药量和包封率均较低,但经CYD包合后再形成微球可提高药物的包封率和载药量,从而改变药物的释放性能[5]。
微球的粒径取决于CS溶液的浓度、乳剂的稳定性、搅拌速度、固化剂的种类等,其中搅拌速度、表面活性剂用量对该微球粒径的影响较大[7]。本试验在微球制备过程中选择表面活性剂占外相比为5%(1%吐温8 0和4%司盘8 0),此时制备的微球外观形态圆整,粒径大小均匀,粒度分布范围窄。
从本试验结果可见,2种载药微球(QT-CM、QT-CD-CM)的粒径改变不大,但药物的释药性能改变比较大,可以认为难溶性药物经过包合作用后再制成微球,可以提高其释药性能,因此本文对槲皮素制剂的开发应用具有一定的意义。
[1] 孟德胜,汪仕良.槲皮素的抗癌作用[J].中草药,2 0 0 1,3 2(2):1 8 6.
[2] 李剑惠,胡 英.HPLC测定槲皮素自微乳中槲皮素的含量[J].华西药学杂志,2 0 0 6,7(5):8 9.
[3] 陶 涛.伊曲康唑/羟丙基-β-环糊精包合物的制备和特性[J].中国新药杂志,2 0 0 5,1 7(5):3 6 4.
[4] 龚金兰,汪森明,胡喜钢,等.紫杉醇壳聚糖纳米微球的制备及体外释放性能[J].医学研究生学报,2 0 0 8,1 9(2):1 8.
[5] 王 飞,梁文权.吲哚美辛包合物微球的制备和释放研究[J].中国现代应用药学,2 0 0 3,2 0(6):4 8 3.
[6] 李国明,叶俊生,郑国红,等.左旋多巴-壳聚糖微球的制备及其释药性能[J].应用化学,2 0 0 7,2 4(9):3 6 7.
[7] 赵瑞玲,丁 红,谢 茵.阿霉素聚乳酸微球制备工艺研究[J].山西医科大学学报,2 0 0 1,3 2(5):4 2 0.
Study on the Preparation of Quercetin Inclusion Complex Microsphere and Its Drug Release in Vitro
HU Ying,GAO Shan(Zhejiang Pharmaceutical College,Zhejiang Ningbo 3 1 5 1 0 0,China)
SUN Bao-ying(Dept.of Neurology,Jinan Central Hospital,Jinan 2 5 0 0 1 3,China)
OBJECTIVE:To prepare Quercetin-β-cyclodextrin inclusion complex-chitosan microspheres(QT-CD-CM),and to investigate their physiochemical property and release characteristics in vitro.METHODS:The quercetin-β-cyclodextrin inclusion complexes were prepared by organic solvent evaporation methods,and then formed chitosan microspheres which were prepared using emulsion-linking technique with sodium tripolyphosphate as the cross-linker.The morphology,particle size,encapsulation efficiency,drug-loading amount and release kinetics of microspheres were investigated.RESULTS:Prepared QT-CD-CM were regular,discrete and uniform spheres with mean particle size of(3.3 2 7±0.1 2 4)μm,encapsulation efficiency of 3 2.4%and drug-loading amount of 1 2.3%.Prepared microspheres released completely in 5%ethanol-PBS in 7 2h,which was in line with first-order kinetic model.CONCLUSION:QT-CD-CM are sound in physicochemical and release property and simple in preparation technology,and can be used as ideal drug delivery system for quercetin.
Quercetin;Inclusion complex;Chitosan;Microsphere;Preparation;In vitro release
R9 4 3
A
1 0 0 1-0 4 0 8(2 0 1 2)3 3-3 1 0 5-0 3
DOI1 0.6 0 3 9/j.issn.1 0 0 1-0 4 0 8.2 0 1 2.3 3.1 3
2 0 1 1-0 9-0 2
2 0 1 2-0 3-2 8)
