1991-2010年26个撤市药品分析
2012-11-21冯柳曹晨于元元胡元佳王一涛澳门大学中华医药研究院中药质量控制国家重点实验室澳门
冯柳,曹晨,于元元,胡元佳,王一涛(澳门大学中华医药研究院/中药质量控制国家重点实验室,澳门)
1991-2010年26个撤市药品分析
冯柳*,曹晨,于元元,胡元佳,王一涛#(澳门大学中华医药研究院/中药质量控制国家重点实验室,澳门)
目的:分析撤市药品,为制药企业保证产品在市场的稳定性提供参考。方法:对由艾美仕市场研究公司及美国FDA 1991-2010年公布的26个撤市药品进行治疗类别,药品研发过程中的合作、并购、专利情况,不同时间撤市药品的数量,退市时间与替代药品注册时间的分析。结果与结论:治疗类别对撤市药品的影响并不明显,专利与合作经营已经不再能保证产品在市场的稳定性。严格的药品安全监管体制、副作用小且疗效较好的替代药品是影响药品撤市的主要原因。
撤市药品;监管;药品替代;原因分析
2010年,汤姆森路透社旗下国际医药研究公司(CMR)国际研究中心公布的数据显示,过去10年间,新药研发费用每年呈6.3%的增长,5年内上市的新药的销售占比跌至7%[1]。可见,新药的研发费用越来越高,而实际产出水平却在下降。与此同时,撤市药品的数量却与之呈现相反的逐年递增的趋势。根据医药行业权威数据公司艾美仕市场研究公司(IMS Health Inc)及美国FDA公布的数据,1991-2010年全球共有26个药品撤市。尽管撤市药品数量并不庞大,然而,近年来的撤市药品数量相较于往年已经有明显的提升。仅2010年,被强制撤市的药品数量已经高达5个。2009年辉瑞制药推出的药品Exubera仅上市1年就被强制撤出市场[2]。药品撤市不仅难以实现制药企业预期的利润收入,更难以负担研发过程中的高昂费用,给制药企业带来了巨大的损失。
尽管药品被强制撤市的原因均是由于药品安全性等问题,但是所有药品在上市之前,均已在Ⅰ、Ⅱ、Ⅲ期临床试验中对其安全性进行了监测。换句话说,也就是药品在上市时已经将副作用控制在一定范围内,但是却由于同样的原因遭到强制撤市。为此,本文深入分析撤市药品,以期帮助制药企业在药品研发过程中明确研究方向、把握研究节奏、避免研究风险,为制药企业保证产品在市场的稳定性提供参考。
1 数据来源
为保证数据的准确性,本文所用数据来源于IMS Health Inc及FDA所公布的官方信息。
2 研究方法
本文对1991-2010年26个撤市药品进行分析,包括药品的治疗类别,药品研发过程中的合作、专利和并购情况,不同时间撤市药品的数量,以及退出时间与替代药品注册时间的关系。
3 结果
3.1 药品的治疗类别情况
对26个撤市药品的治疗类别进行统计分析,结果见图1。
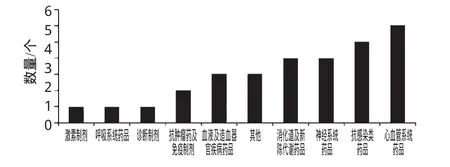
图1 26个撤市药品治疗类别情况Fig 1 Classification of 26kinds of drugs for withdrawal therapeutic areas
由图1可知,26个撤市药品的治疗类别呈现一定的集中趋势。消化道及新陈代谢类药品、神经系统药品分别占总数的15%,抗感染类药品占总数的19.2%,心血管系统药品排名第1,占总数的23.1%。这4个主要治疗类别的药品占总数的72.3%。
为深入探讨治疗类别对药品撤市的影响,本文另外对2001-2010年通过审批的226个新药的治疗类别进行统计分析,结果见图2。

图2 2001-2010年通过审批的新药治疗类别情况Fig 2Classification of approved new drugs for therapeutic areas during 2001-2010
由图2可知,226个新药的治疗类别呈现与撤市药品相同的趋势,主要类别为抗感染类药品、抗肿瘤药及免疫制剂、神经系统药品、消化道及新陈代谢药品,这4大类别药品占总数的57.52%。
3.2 药品研发过程中合作、专利和并购情况
为探讨是否由于研发过程中的产品维护缺陷造成药品在上市后缺乏竞争力,从而导致药品撤市,本文进一步对26个撤市药品在研发过程中的合作、专利和并购情况进行了分析,结果见图3。
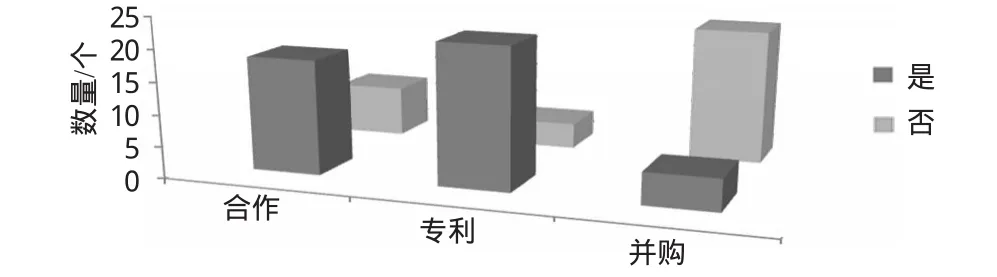
图3 26个撤市药品在研发过程中的合作、并购和专利情况Fig 3 Cooperation,M&A and patents situation during the R&D process of 26kinds of withdrawal drugs
由图3可知,69.2%的撤市药品在研发过程中选择了与其他企业合作,即采取授权的方式进行药品销售;84.6%的撤市药品拥有专利权;只有19.2%撤市药品的制药企业在产品上市之后发生过并购行为。
3.3 不同时间撤市药品的数量
为探讨药品退市时间与撤市药品数量之间的关系,对26个撤市药品退市时间进行分析,除药品TECZEM的退市时间无法确定之外,另外25个撤市药品在1991-2010年的退市时间分布情况见图4。

图4 25个撤市药品在1991-2010年的退市时间分布情况Fig 4 Delisting time distribution of 25kinds of withdrawal drugs during 1991-2010
由图4可知,撤市药品数量的增加发生在2005年及之后的时间里,相比1991-1999年有8个药品撤市,2000-2004年中仅2001年有2个药品撤市,在2005-2010年撤市药品数量高达15个,是过去15年的1.5倍。
3.4 替代药品对撤市药品的影响
药品撤市的另外一个原因即替代药品对撤市药品的影响。本文的替代药品定义为使用药品小分类,即药品的解剖学、治疗学及化学分类系统(ATC),确定药品在治疗效果上具有相似作用。本文所选取的替代药品,需精确到ATC编码下3位,例如,磷丙泊酚钠的ATC编码为NB5,意味着该药品属于N类(神经系统用药)→N5(精神阻滞药)→N5B(催眠药、镇静药)。为进一步探究替代药品对撤市药品的影响,将替代药品分为销售额优势和销售增长优势替代药品,前者即在同一治疗类别中销售额最大的药品,后者是指在同一治疗类别下全球销售排名前20的药品中增长速度最快的药品。
在研究过程中,进一步通过IMS Health Inc数据库查询销售额优势替代药品和销售增长优势替代药品的注册时间和在FDA或欧洲药品审评署(EMEA)的注册时间,共计4组时间,分别与撤市药品的退市时间进行皮尔森相关分析。结果,撤市药品的退市时间与销售额优势替代药品、销售增长优势替代药品的注册时间均无明显差异,即表明替代药品注册时间与撤市药品的退市时间可理解为相同时间。
4 讨论
4.1 治疗类别对药品撤市的影响
撤市药品主要集中在消化道及新陈代谢类药品、神经系统药品、抗感染类药品、心血管系统药品。但是,由于审批通过的新药治疗类别也同样集中在这4类药品,表明治疗类别对药品撤市的影响并不明显。
4.2 药品的合作、并购、专利对撤市药品的影响
现今的制药企业通过各种途径以确保药品的竞争力,这些途径包括药品在研发过程中与其他厂商的合作,通过授权的方式将自身企业研发的药品委托其他厂商进行销售;也包括在研发过程中,对产品进行专利保护:很多产品在产品线初期已经注册专利,或者有部分产品是在已经获得专利的基础之上进行剂型的修正,例如卫材制药在2009年通过审批的药品磷丙泊酚钠注射液早在1998年即由美国堪萨斯州立大学申请并获得专利。同时,制药行业的并购趋势在当今已成为行业中为扩充产品线、分担风险的主要战略。
对撤市药品的分析发现,这些药品所在企业选择了通过授权的方式进行销售,这种合作率高达69.2%;同时,撤市药品中84.6%的药品在研发过程中已经获得了专利。尽管如此,这些药品仍然难以逃脱撤市的命运。专利及合作经营已经不再是保护产品在市场保持稳定的保护伞。同时,含有撤市药品的企业更不容易被并购,证明并购前在企业的评估中,对产品的审核比较准确。
4.3 监管制度对药品撤市的影响
21世纪初,新药安全成为美国参、众两议院及公众关注的焦点,其导火索是默克公司新一代关节镇痛药Vioxx的撤市。然而更加关键的是,Vioxx的治疗风险不是由FDA通过现有新药上市后安全监控机制获得,而是由默克公司自己发现主动撤市的,而FDA在这个过程中未起到任何作用。
2005年美国政府通过Grassley-Dodd提案,提出建立独立于FDA的药物安全办公室,给FDA更大的权利,加大临床监督力度,要求药品生产者上市后进行安全监测等措施。在Grassley-Dodd提案通过的同一时间,药品撤市的数量开始有所增加,自2005年开始到目前为止,已经达到了1991-2004年间总数的1.5倍。因此,近年来的药品撤市现象与这一提案的通过密切相关,表明严格的药品安全监管体制对药品的质量、安全要求也更高。
4.4 替代药品对药品撤市的影响
由之前替代药品注册时间与撤市药品退市时间的皮尔森相关分析可见,这2个时间具有较强的相关性。换句话说,在替代药品出现时间附近,撤市药品即面临退市。替代药品不仅在临床用途和治疗效果上接近或者超过撤市药品,且副作用小。因此,在替代效果良好的情况下,原有副作用较大的药品即被强制撤市。同时,替代药品由于其不可替代性,可以完成良好的销售业绩,故在同一治疗领域中遥遥领先。
[1] Thomson Reuters CMR International.Global Pharmaceutical R&D Productivity declining[EB/OL].http://cmr.thomsonreuters.com/.2011-05-28.
[2] 石永进.从Exubera看辉瑞制药的研发现状[J].世界临床药物,2008,29(3):184.
Analysis of the 26Kinds of Withdrawal Drug during 1991-2010
FENG Liu,CAO Chen,YU Yuan-yuan,HU Yuan-jia,WANG Yi-tao(State Key Lab of Quality Control for TCM/Institute for Chinese Medicine Science,The University of Macau,Macau,China)
OBJECTIVE:To analyze withdrawal drugs,and to provide reference for the stability guarantee of product in the market by pharmaceutical manufacturers.METHODS:26kinds of withdrawal drugs announced in 1991-2010by IMS Health Inc.and USA FDA were analyzed from therapeutic classification,cooperation,M&A and patent situation during the R&D process,number of different time,withdrawal time and marketed time of substitutes.RESULTS&CONCLUSIONS:Drugs withdrawal is hardly affected by therapeutic areas,and patent and co-operation can no longer guarantee the stability of market.Main reasons for drugs withdrawal are strict supervision system,substitutes with low side effect and high efficiency.
Withdrawal drug;Supervision;Drug substitution;Analysis of reasons
R95
C
1001-0408(2012)33-3158-02
DOI10.6039/j.issn.1001-0408.2012.33.35
*硕士研究生。研究方向:医药管理。电话:00853-83974685。E-mail:fengliu0918@gmail.com
#通讯作者:教授。研究方向:医药管理、法规和医药经济研究。电话:00853-83974691。E-mail:ytwang@umac.mo
2011-09-13
2011-11-26)
